环状RNA在缺氧/复氧诱导的大鼠H9c2细胞焦亡中的作用及其机制
2022-06-24陈鑫哲王飞王凯王曼
陈鑫哲 王飞 王凯 王曼
(青岛大学转化医学研究院,山东 青岛 266021)
据统计,自2010年以来,心血管系统疾病已经成为中国居民死亡率最高的疾病,每5例死亡者中就有2例死于心血管系统疾病[1]。心肌梗死作为心血管系统疾病的死亡原因之首,值得引起重视并需要进行深入研究。因此,有效的早期诊断和治疗对于提高心肌梗死患者的生存质量以及降低死亡率至关重要[2]。环状RNA(circRNA)是一类不含5′端帽和3′端Poly A尾首尾结合的共价闭合环状非编码RNA[3]。研究显示,circRNA广泛存在于真核生物中,其表达有组织或细胞特异性,而且circRNA结构相对稳定,具有成为生物标记物的潜力。近期研究显示,circRNA与心血管系统疾病的发生发展密切相关。例如,自噬相关circRNA(ACR)通过调控PlNKl/FAM65B信号通路,以减轻小鼠心肌缺血再灌注(I/R)损伤[4];circ_00023通过吸附miR-26b-5p,促进小鼠心脏成纤维细胞的纤维化[5]。因此,circRNA在诊断和治疗心血管系统疾病方面具有较大潜力,但其具体的调控机制仍不明确。
2001年COOKSON等[6]发现半胱氨酸天冬氨酸蛋白酶1(caspase-1)引起的促炎性细胞死亡方式,并首次提出了细胞焦亡(pyroptosis)的概念。细胞焦亡,又被称为细胞炎性坏死,是一种由炎症小体介导的细胞程序性死亡,主要表现为细胞不断肿胀膨大直至细胞破裂,致使细胞内容物释放,从而触发强烈的炎症反应。研究显示,caspase-1抑制剂VX-765能够抑制细胞焦亡通路,减少I/R损伤大鼠模型的心肌梗死面积[7],表明细胞焦亡与心血管系统疾病的发生密切相关。circRNA-NNT通过靶向miR-33a-5p调节泛素特异性蛋白酶46(USP46),促进心肌细胞焦亡和心肌I/R损伤[8]。同时circRNA可能参与心肌I/R损伤的发病机制;然而,目前仍缺乏关于circRNA对心肌I/R损伤调控机制的深入研究。基于本实验室前期的高通量测序分析结果,发现在缺氧/复氧(H/R)处理的H9c2细胞中mmu_circ_0000723的表达水平显著降低。在circBase数据库查询结果显示,mmu_circ_0000723位于17号染色体上的内含子区域,其序列由环化点间的所有碱基构成,序列全长1 946个碱基,是一类内含子circRNA。尽管mmu_circ_0000723已被circBase数据库所收录,但是尚未见关于mmu_circ_0000723的研究报道,并且mmu_circ_0000723在H/R诱导心肌细胞焦亡中的作用机制仍不清楚。本研究通过敲低H9c2细胞中mmu_circ_0000723的表达水平及检测H9c2细胞焦亡活性,进一步探讨mmu_circ_0000723在H/R诱导H9c2细胞焦亡中的作用及其分子机制,为心肌I/R损伤的治疗提供数据参考。
1 材料与方法
1.1 试剂
大鼠心肌细胞H9c2由本实验室保存,反转录试剂盒AG11705、实时荧光定量PCR(RT-qPCR)试剂盒AG11701购自于湖南艾科瑞生物工程有限公司,乳酸脱氢酶(LDH)试剂盒A020-2(南京建成生物科技有限公司),焦亡素D蛋白C端肽段(GSDMD-C)抗体AF4012(美国AffinitY公司),mmu_circ_0000723特异性siRNA(siRNA-mmu_circ_0000723)以及阴性对照siRNA(NC)均由上海吉玛制药技术有限公司合成。
1.2 细胞培养
将大鼠H9c2细胞置于含体积分数0.10 FBS和体积分数0.01双抗混合液(100 kU/L青霉素和100 mg/L链霉素)的DMEM高糖培养基中,于含体积分数0.05 CO2的37 ℃湿润的培养箱中进行培养,每隔48 h换培养液一次,待细胞处于对数生长期并且生长良好的情况下传代,将对数生长期的细胞悬液接种于直径6 cm的培养皿中培养12 h,用于后续实验。
1.3 研究方法
1.3.1H/R处理的H9c2细胞焦亡活性检测及最佳缺氧时间的确定 取对数生长期的H9c2细胞,以每孔约5×104个细胞接种于6孔板中,待细胞密度约达80%时,分别进行缺氧0 h(A组)、1 h(B组)、3 h(C组)、6 h(D组)、12 h(E组)、24 h(F组)处理后,再进行6 h复氧。并严格按照LDH试剂盒的操作方法检测各组细胞上清液中LDH活性。采用Western blot方法检测各组细胞中焦亡相关蛋白GSDMD-C、IL-1β和caspase-1的表达水平。各实验均重复3次,结果取均值。根据各组H9c2细胞上清液中LDH活性和焦亡相关蛋白的表达水平,确定诱导细胞焦亡的最佳缺氧时间,后续实验均采用该时间点进行细胞缺氧处理。
1.3.2H/R处理的H9c2细胞中circRNA表达水平的检测 取对数生长期的H9c2细胞,以每孔约5×104个细胞接种于6孔板中,待细胞密度约达80%时进行实验。将置于细胞培养箱正常培养12 h的H9c2细胞作为对照组,H/R处理的H9c2细胞作为实验组。通过Trizol法提取两组细胞总RNA,使用逆转录试剂盒将RNA反转为cDNA,随后严格按照RT-qPCR方法进行操作,以GAPDH作为内参照,检测circRNA的相对表达水平。实验重复3次,结果取均值。引物名称及其序列见表1。
1.3.3siRNA-mmu_circ_0000723敲低目标基因效果验证 取对数生长期的H9c2细胞,以每孔约5×104个细胞接种于6孔板中,待细胞密度约达60%时进行转染。根据不同的处理方法将细胞分为G~I组。G组置于细胞培养箱中正常培养12 h,H组转染NC,I组转染siRNA-mmu_circ_0000723,并于转染24 h后收集细胞。采用Trizol法提取G~I组细胞的总RNA,使用逆转录试剂盒将RNA反转为cDNA,并严格按照RT-qPCR试剂盒说明进行实验操作,以GAPDH作为内参照,检测mmu_circ_0000723的相对表达水平。实验重复3次,结果取均值。引物名称及其序列见表1。

表1 引物名称及其序列
1.3.4敲低mmu_circ_0000723对H9c2细胞焦亡的影响 取对数生长期的H9c2细胞,以每孔约5×104个细胞接种于6孔板中,根据不同的处理方法将细胞分为J~M组。J组置于细胞培养箱中正常培养12 h,K组置于厌氧培养箱进行H/R处理;H9c2细胞密度约达60%时,L和M组分别转染对照NC和siRNA-mmu_circ_0000723,并于转染24 h后进行H/R处理。严格按照LDH试剂盒进行操作,分别检测J~M组H9c2细胞上清液中LDH活性,采用Western blot方法检测J~M组H9c2细胞中焦亡相关蛋白表达水平。实验重复3次,结果取均值。
将10 mm×10 mm盖玻片铺入24孔板中,取对数生长期的H9c2细胞,以每孔约2×104个细胞接种于24孔板中的盖玻片上,按照上述J~M组分组方式进行处理。严格按照碘化丙啶(PI)染色法对J~M组细胞进行染色,检测H9c2细胞死亡情况;采用抗荧光淬灭的封片剂封片,置于荧光显微镜下观察并拍照,计算PI阳性细胞比率。PI阳性细胞比率(%)=死亡细胞数/总细胞数。实验重复3次,结果取均值。
1.4 统计学分析

2 结 果
2.1 H/R处理后H9c2细胞焦亡活性检测及最佳缺氧时间的确定
经H/R处理后,A~F组H9c2细胞上清液中LDH活性及GSDMD-C、IL-1β和caspase-1蛋白表达水平差异均具有显著性(F=24.86~2 153.00,P<0.05);与A组相比,D组细胞中上述4个指标显著升高(t=4.14~62.88,P<0.05)。缺氧处理6 h的H9c2细胞(D组)中caspase-1、GSDMD-C和IL-1β的蛋白表达水平最高,因此,后续细胞缺氧时间均采用6 h。见图1及表2。
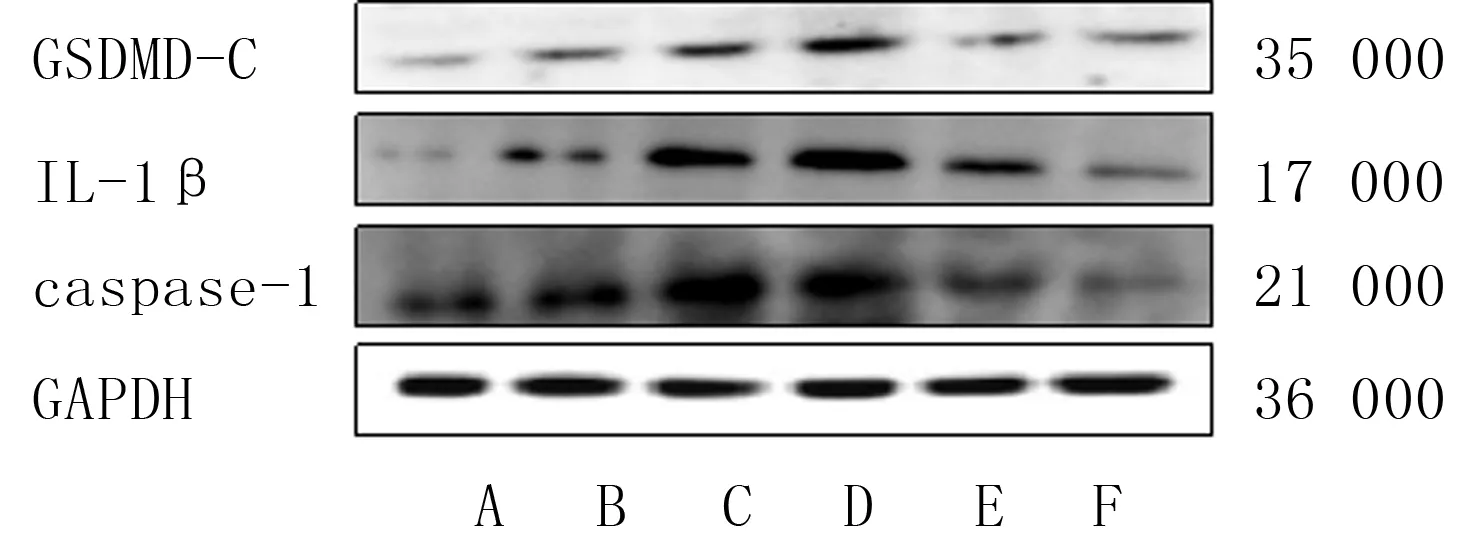
A~F代表A~F组
表2 A~F组中焦亡相关蛋白的表达水平及LDH活性比较
2.2 对照组和实验组H9c2细胞中circRNA的表达水平比较
RT-qPCR结果显示,对照组和实验组H9c2细胞当中mmu_circ_0000723的相对表达水平分别为1.00±0.01、0.56±0.01。与对照组相比,实验组中mmu_circ_0000723的表达水平明显降低(t=9.78,P<0.05);对照组和实验组中circRNA_010的相对表达水平分别为1.00±0.01、0.92±0.01,两组比较差异无显著性(P>0.05)。
2.3 siRNA-mmu_circ_0000723敲低目标基因效果验证
RT-qPCR结果显示,G~I组中mmu_circ_0000723的表达水平分别为1.00±0.01、0.99±0.02和0.57±0.03,组间比较差异有显著性(F=348.20,P<0.05);I组mmu_circ_0000723的相对表达水平与G组相比显著降低(t=22.88,P<0.05);H组中mmu_circ_0000723的相对表达水平与G组相比差异无显著性(P>0.05)。
2.4 敲低mmu_circ_0000723对H9c2细胞焦亡的影响
J~M组H9c2细胞上清液中LDH活性、PI阳性细胞比例以及GSDMD-C、IL-1β和caspase-1蛋白相对表达水平比较,差异有显著性(F=34.39~8 528.00,P<0.05)。与K组相比较,M组细胞中上述5个指标均明显升高(t=4.99~54.00,P<0.05),而L组细胞中上述5个指标差异均无显著性(P>0.05)。见图2、3及表3。
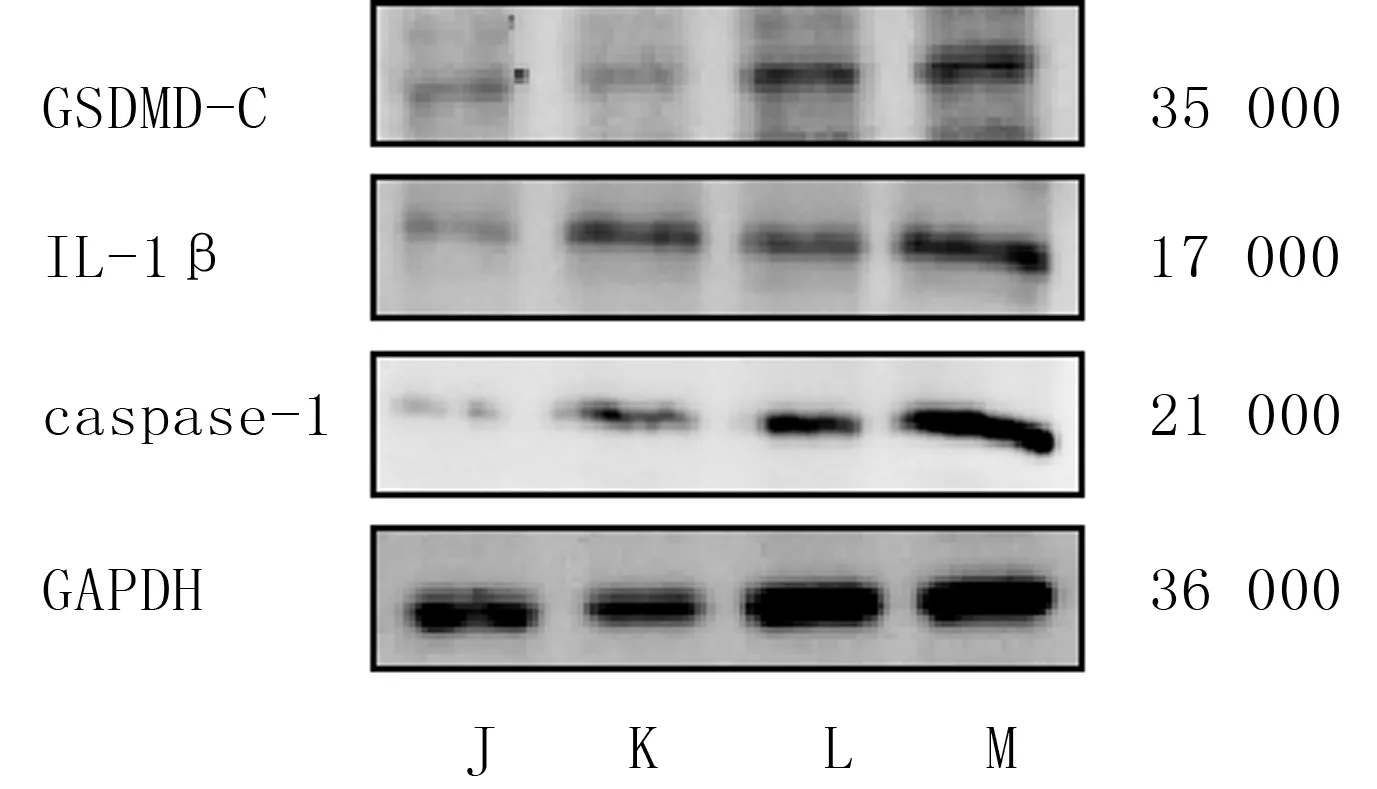
J~M代表J~M组
表3 J~M组细胞焦亡相关蛋白表达水平和LDH活性比较

J~M代表J~M组,PI染色,200倍
3 讨 论
心血管疾病是危害人类健康的主要疾病之一,患者死亡率逐年增高[1]。既往研究表明,炎症参与多种心血管疾病病变过程。细胞焦亡是近年来发现并证实的一种促炎性的细胞程序性死亡方式,与多种疾病的发生和发展有着高度相关性。焦亡的细胞主要表现为细胞膜肿胀失去完整性,但细胞核却保持完整,DNA片段化、染色质高度凝集、细胞纤维结构被破坏,并伴有明显的炎症反应,会加速细胞的死亡进程[9]。作为促炎性的程序性细胞死亡方式,细胞焦亡参与了心血管系统疾病的发生发展整个过程[10-13]。研究显示,GSDMD是细胞焦亡通路中的主要执行蛋白[14-16],GSDMD本身没有活性,而活化的caspase-1能够将GSDMD切割为N端(GSDMD-N)和C端(GSDMD-C)两个相互独立的结构域,GSDMD-N通过转移至细胞质膜附近,与磷脂结合并多聚化,在细胞膜上形成孔洞,导致细胞膨胀破裂,最终引发焦亡[17]。为了阐明细胞焦亡在心肌I/R损伤中作用机制,本研究通过H/R处理H9c2细胞,模拟心肌I/R损伤,分别采用LDH试剂盒以及Western blot方法检测H/R诱导H9c2细胞上清液中LDH活性以及细胞中焦亡相关蛋白的表达水平。H9c2细胞进行缺氧0、1、3、6、12、24 h,复氧6 h处理后,收集细胞裂解液行Western blot检测。结果显示,缺氧6 h处理后,H9c2细胞中caspase-1、GSDMD-C和IL-1β蛋白的表达水平最高。随着缺氧时间不断增加,细胞上清液中LDH活性不断升高。以上结果表明,H/R处理能够促进H9c2细胞中焦亡通路蛋白表达和LDH释放,诱导细胞焦亡。
研究显示,circRNA能够作为分子海绵,有结合小分子RNA(microRNA)和蛋白的活性,广泛参与多种细胞信号通路[18-20]。已有研究证实了circRNA在骨骼肌缺血性损伤、糖尿病心肌病、糖尿病肾病和急性胰腺炎等疾病中的作用[21-24]。另外,circRNA与心血管系统疾病的发生和发展也有密切关系[25]。WANG等[26]研究发现circRNAMFACR可以通过与miR-652-3p的相互作用,调控线粒体蛋白18(MTP18)基因的表达,介导H/R诱发的小鼠心肌细胞凋亡和心肌梗死。然而,circRNA在心肌细胞焦亡中的作用机制仍不清楚。因此,寻找心脏中特异表达且参与调控心肌细胞焦亡的circRNA至关重要。在本实验的前期研究中,对H/R处理H9c2细胞的高通量测序结果显示,mmu_circ_0000723在H/R处理的H9c2细胞中表达水平较低。以此为基础,本研究以mmu_circ_0000723为研究对象,通过RT-qPCR方法证实mmu_circ_0000723在H/R处理的H9c2细胞当中的表达水平显著下调,提示mmu_circ_0000723可能在H/R诱导的H9c2细胞焦亡中发挥重要作用。为了进一步探讨mmu_circ_0000723的生物学功能,本研究采用siRNA敲低H9c2细胞中mmu_circ_0000723的表达并分析其对H/R诱导的心肌细胞焦亡的调控作用。本研究实验结果显示,与对照H9c2细胞相比,H/R处理组PI阳性细胞比例和LDH活性增高,且H/R处理的H9c2细胞中caspase-1、GSDMD-C和IL-1β蛋白表达水平升高。因此,H/R能够诱导H9c2细胞焦亡。与仅进行H/R处理的H9c2细胞相比,敲低mmu_circ_0000723后进行H/R处理组的PI阳性细胞比例、LDH活性以及caspase-1、GSDMD-C和IL-1β蛋白的表达水平均明显升高。以上结果表明,敲低mmu_circ_0000723能够促进H/R诱导的H9c2细胞焦亡。
综上所述,本研究的结果显示,在H/R处理的H9c2细胞中mmu_circ_0000723的表达水平明显降低。敲低mmu_circ_0000723能够促进H/R诱导的caspase-1、GSDMD-C和IL-1β蛋白表达,加剧H9c2细胞焦亡。因此,mmu_circ_0000723作为潜在的治疗靶标,在心血管疾病诊断和治疗方面有巨大的价值。本研究成果为心血管疾病诊断标志物的筛选和治疗药物的研发提供了一定的理论基础。
