基于性别连锁SNP特异性引物延伸反应的斑点叉尾遗传性别鉴定方法的建立与应用
2022-06-24徐思琪张世勇陈校辉王明华钟立强李联泰边文冀
徐思琪 张世勇 陈校辉 王明华 钟立强 李联泰 边文冀

摘要:为建立一种准确和快速鉴定斑点叉尾遗传性别方法,根据其性别连锁SNP(single nucleotide polymorphism)位点,设计外围引物、SNP特异性延伸引物和DNA探针。性别连锁SNP特异性引物延伸反应结束后,将扩增终产物与DNA探针杂交,并应用基于免疫胶体金技术的核酸检测试纸检测性别连锁SNP,从而实现遗传性别分子水平的可视化鉴定。结果显示,该方法能够准确地鉴定斑点叉尾的遗传性别,与基于性别连锁微卫星标记的遗传性别鉴定方法所得结果一致,表明斑点叉尾性别连锁SNP特异性引物延伸反应联合基于免疫胶体金技术的核酸试纸能够准确、快速地完成斑点叉尾的遗传性别鉴定。
关键词:斑点叉尾;遗传性别鉴定;特异性引物延伸反应;性别连锁SNP;免疫胶体金
中图分类号: S965.128文献标志码: A
文章编号:1002-1302(2022)12-0189-05
收稿日期:2021-08-17
基金项目:江苏省农业重大新品种创制项目(编号:PZCZ201741);国家现代农业产业技术体系建设专项(编号:CARS-46);江蘇省自然科学基金(编号:BK20191487)。
作者简介:徐思琪(1996—),女,吉林通化人,硕士研究生,研究方向为鱼类遗传育种。E-mail:121972467@qq.com。
通信作者:张世勇,E-mail:shiyongzhang@hotmail.com;边文冀,E-mail:js6060@sina.com。
斑点叉尾(Ictalurus punctatus)隶属鲇形目科,原产于北美,是一种世界性淡水养殖鱼类[1]。由于斑点叉尾对不同环境有较强适应能力,已引种至多个国家开展人工养殖。我国于1984年首次引种斑点叉尾,此后30余年间,根据其生物学特征进行了系统的本土化研究,极大地促进了我国斑点叉尾产业的发展[2]。斑点叉尾雌雄鱼生长具有较大差异,雌鱼达到一定规格后,生长减慢,卵巢发育加快,较大的卵巢组织一定程度上降低了其食用比例,导致雌鱼的市场需求不高[3]。因此,为提高斑点叉尾养殖效益,有必要开展全雄品种选育研究。
性逆转是培育鱼类全雄或全雌品种的必要途径,性逆转的开展要求精准的遗传性别鉴定方法予以辅助。随着分子标记技术在鱼类中的应用,已鉴别出大量鱼类RFLP(restriction fragment length polymorphism)、RAPD(random amplified polymorphic DNA)、AFLP(amplified fragment length polymorphism)、SSR(simple sequence repeats)、SNP(single nucleotide polymorphism)等性别特异性分子标记。1991年,Devlin等采用RFLP分子标记技术首次获得大鳞大马哈鱼(Oncorhynchus tshawytscha)性别特异分子标记[4]。使用RAPD分子标记技术鉴定出性别特异分子标记的物种主要有虹鳟(Oncorhynchus mykiss)[5]、大菱鲆(Scophthalmus maximus)[6]等;AFLP分子标记技术鉴定出性别特异分子标记的物种主要有:三刺鱼(Gasterosteus aculeatus)[7]、金枪鱼(Thunnus orientalis)[8]等;SSR分子标记技术鉴定出性别特异分子标记的物种主要有:尼罗罗非鱼(Oreochromis niloticus)[9]、半滑舌鳎(Cynoglossus semilaevis)[10]、斑点叉尾[11]等。随着高通量测序技术地进步,基于测序技术筛选性别特异性分子标记已成为目前最主流的方法。近年,基于高通量测序技术陆续在大西洋庸鲽(Hippoglossus hippoglossus)[12]、大口鲇(Silurus meridionalis)[13]、斑点叉尾[14]等物种中鉴定出多个性别连锁SNPs标记。根据鱼类性别特异性分子标记开发出多种遗传性别鉴定方法,但大部分性别鉴定方法耗时、耗力,且需要借助较为精密的仪器。
将性别连锁SNP特异性引物延伸反应与基于免疫胶体金技术的核酸检测试纸相结合,鉴定鱼类遗传性别的方法目前尚未见报道。本研究基于笔者所在课题组前期开发的斑点叉尾性别连锁SNP标记[14],设计SNP位点特异性延伸反应引物,并联合基于免疫胶体金技术的核酸检测试纸,首次建立了快速鉴定斑点叉尾遗传性别方法。该方法不仅能够高效、准确地鉴定出斑点叉尾遗传性别,还能够为其他物种遗传性别鉴定方法的开发提供参考。
1 材料与方法
1.1 试验材料
本试验所用的试验鱼来自国家级江苏斑点叉尾遗传育种中心扬中基地培育的斑点叉尾G3代选育群体。采集180日龄雌雄斑点叉尾各10尾,MS-222(Merck公司,德国)麻醉后解剖,根据其性腺记录其性别信息,同时,剪取部分尾鳍组织于1.5 mL离心管中,加入无水乙醇保存。
1.2 基因组DNA提取
取20 mg尾鳍组织,剪碎后置于1.5 mL离心管中。使用DNA Isolation Mini Kit试剂盒(南京诺维赞生物科技有限公司)提取基因组DNA,操作过程按照说明书进行。利用Qubit荧光光度计(Invitrogen,Carlsbad,CA,USA)评估DNA质量,并在0.6%琼脂糖凝胶上电泳检测其完整性。合格的DNA样本于-20 ℃保存。
1.3 引物设计
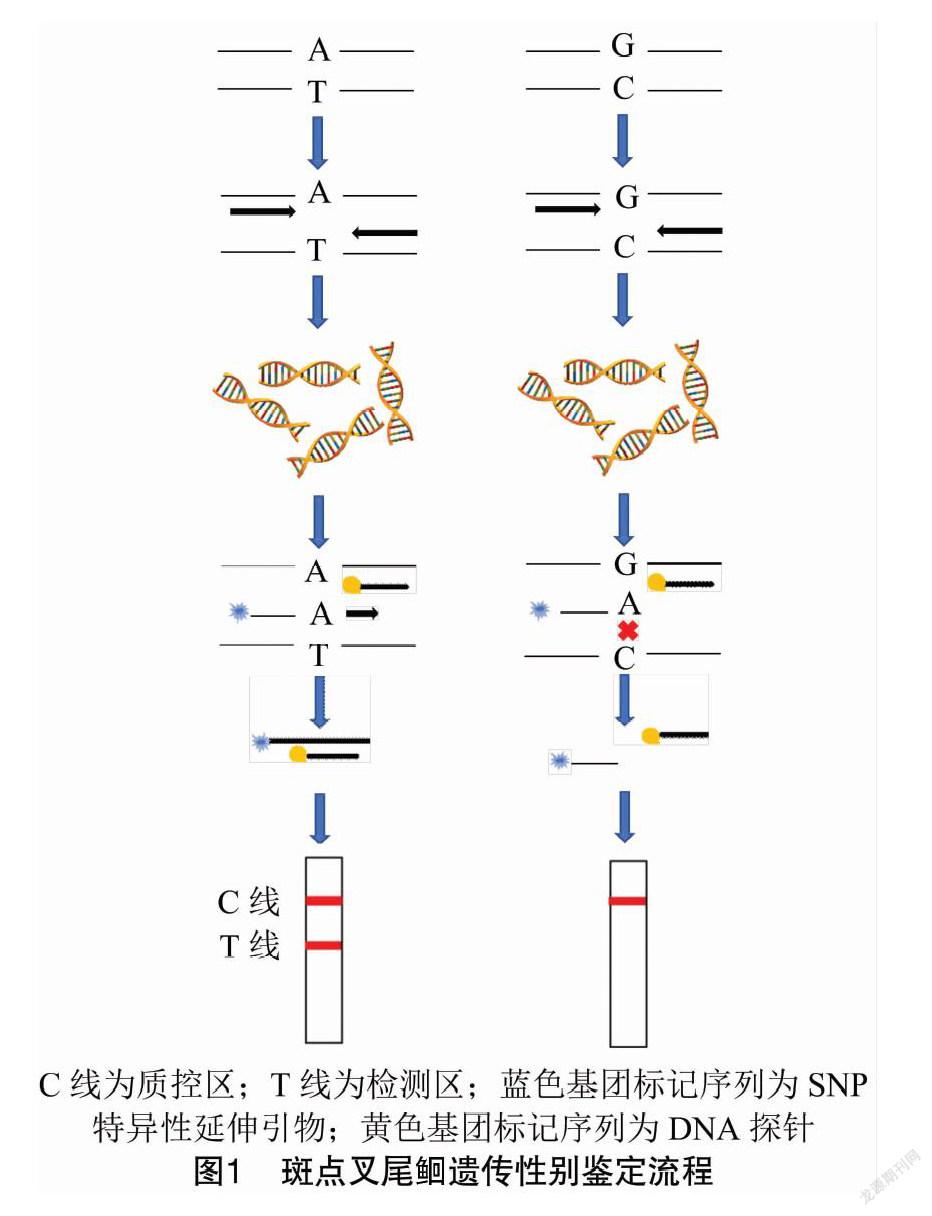
应用NCBI数据库Primer BLAST在线软件设计扩增斑点叉尾性别连锁SNP位点(scaffold99_205834 G>A)[14]的外围引物(WF/WR)、特异性延伸引物(ASE)和DNA探针(ASE-DP);使用Oligo软件检验ASE引物与DNA探针二级结构间相互关系,避免产生二聚体。ASE引物3′端最后一个位点为雄性特异性碱基,5′端用6-羧基荧光素(6-FAM)荧光基团标记,DNA探针3′端用生物素(Biotin)标记,引物及探针的合成和标记委托生工生物工程(上海)股份有限公司完成,序列见表1。3FA4C0FF-2B1A-47A8-BBFA-EB7E822326D4
1.4 巢式PCR扩增反应
第1轮PCR反应扩增斑点叉尾性别连锁SNP位点(scaffold99_205834 G>A)。反应总体系:40 μL,其中,2×Phanta Max Master Mix 0 μL(南京诺维赞生物科技有限公司)、模板DNA 1 μL、外围引物(WF和WR)各1 μL,ddH2O 17 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,57~53 ℃(每个循环减1 ℃)退火30 s,72 ℃延伸60 s,每个退火温度2个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,15 个循环;72 ℃延伸10 min。
第2轮PCR反应为性别连锁SNP位点特异性引物延伸反应,将第1轮PCR反应产物稀释10倍后用作第2轮PCR反应的模板DNA。反应总体系:20 μL,其中,2×Phanta Max Master Mix 10 μL、模板DNA 1 μL、ASE延伸引物(ASE)、DNA探针(ASE-DP)各1 μL、ddH2O 7 μL。第2轮PCR反应分2步进行,第1次擴增:95 ℃,5 min;94 ℃30 s,66 ℃ 30 s,20个循环;第2次扩增:94 ℃30 s,50 ℃ 30 s,25 个循环。
1.5 遗传性别鉴定结果判读
本试验所用核酸检测试纸及其配伍碱性缓冲液,均购自杭州优思达生物科技有限公司。第2轮PCR完成后,滴加20 μL核酸检测试纸配伍的碱性缓冲液于微孔板中,在核酸检测试纸的样品垫上滴加10 μL第2轮PCR扩增产物。将已滴加扩增产物的核酸检测试纸插入含有缓冲液的100 μL微孔板中,保证样品垫最下端与缓冲液接触。上述过程完成后10~15 min内对试纸显色结果进行判读。
1.6 遗传性别鉴定准确性验证
从斑点叉尾遗传育种中心样本库中随机选取96个样本,应用本研究鉴定的方法对96个样本遗传性别进行鉴定,并将鉴定结果与数据库中记录的性别信息进行比对,以期检验该方法准确性。此外,应用基于斑点叉尾性别连锁微卫星标记的遗传性别鉴定方法[15]对上述试验鱼的遗传性别进行鉴定,并比较2种方法的鉴定结果。
1.7 第2轮PCR反应循环次数对鉴定结果的影响
选择遗传性别为雄性的斑点叉尾DNA样本,在进行第1轮PCR反应后,第2轮PCR反应程序中第2次扩增循环次数由25个循环逐次递减5个循环,直至减少至0个循环,其他反应程序不变。将巢式PCR反应产物按照核酸检测试纸显色及判读步骤进行。
2 结果与分析
2.1 遗传性别鉴定方法
本研究建立的基于性别连锁SNP位点特异性引物延伸反应的斑点叉尾遗传性别鉴定方法流程见图 主要包括:SNP位点外围引物扩增、SNP位点特异性引物延伸反应、延伸反应产物与DNA探针杂交及显色反应等步骤。外围引物(WF/R)扩增主要完成SNP位点区间目的片段的大量富集,保证SNP位点特异性引物延伸反应的有效性和准确性。SNP位点特异性延伸反应引物(ASE)的3′端为雄性特异碱基,5′端为6-FAM荧光基团标记,引物能够与雄性个体在该SNP位点特异性结合并完成扩增反应。DNA探针(ASE-DP)的3′端标记有Biotin基团,从而保证其不能够完成扩增反应,仅起到与SNP位点特异性延伸反应产物杂交的目的。核酸检测试纸的检测区能够特异性地识别DNA探针与SNP位点特异性延伸反应产物杂交产物,经过显色反应可直观地呈现出不同斑点叉尾个体的遗传性别信息。
2.2 遗传性别鉴定结果及准确性
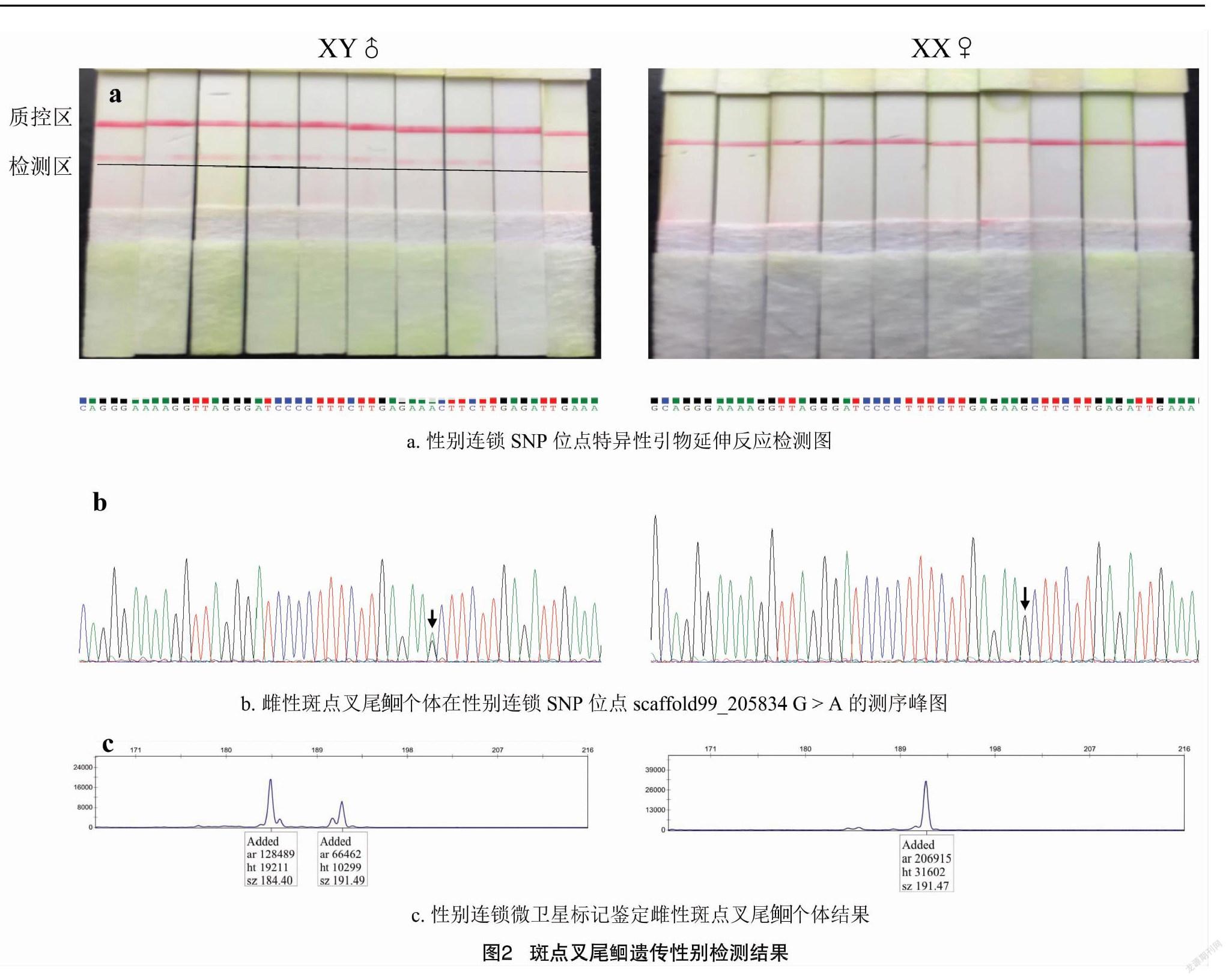
本研究分别使用10尾雌雄个体,性别连锁SNP位点特异性引物延伸反应产物与DNA探针的杂交产物在核酸检测试纸上的显色反应见图2。由图2可知,雌雄个体在质控区均出现红色条带,雄性个体在检测区显示红色条带,雌性个体在检测区不显色,鉴定结果与性别连锁SNP位点测序图谱一致。为验证本研究建立的斑点叉尾遗传性别鉴定方法的准确性,使用96份未知性别样本对该方法进行测试,结果表明鉴定结果与96份样本在数据库中记录的性别信息一致,该遗传性别鉴定方法准确率为100%。
基于斑点叉尾性别连锁微卫星标记的遗传性别鉴定方法中,雌性个体的DNA分型结果具有1个峰值(192 bp),雄性个体的DNA分型结果具有2个峰值(186、192 bp),其中,186 bp峰值为雄性个体所特有。使用2种方法对96尾斑点叉尾个体的遗传性别进行鉴定,结果显示2种方法的鉴定结果一致,检测结果见图2-c。
2.3 第2轮PCR反应循环次数对显色反应的影响
第2轮PCR反应的第1次扩增主要是对第1轮PCR反应中剩余外围引物的消耗,减少其对试验结果的干扰。因此,在其他反应程序不变情况下,第2次扩增循环次数为25时检测线最为清晰,随着循环次数的依次递减,检测线颜色逐渐变浅,直至完全消失。
3 讨论
在本研究之前,笔者所在课题组在斑点叉尾基因组中鉴定出多个性别连锁SNP位点[14],由于这些SNP位点均与雄性性别连锁遗传,因此,选择其中1种,利用SNP特异性引物延伸反应,并结合基于免疫胶体金技术的核酸试纸即可实现斑点叉尾遗传性别的快速和准确鉴定。
胶体金免疫层析技术因其具有高效、简单、快速的特点而广泛应用于药残[16]、毒素[17]、细菌[18]、病毒[19]等检测。应用胶体金技术研发的新型SARS-CoV-2抗原检测试剂盒可用于COVID-19临床血清检测,为病毒早期筛查提供准确的检测方法[20-22]。在应用胶体金免疫层析技术过程中,以氯金酸(HAuCl4)为还原剂,Au作为胶体颗粒,在碱性缓冲溶液中携带负电荷基团,与Biotin单克隆抗体的正电荷基团牢固结合,通过静电作用形成金标Biotin抗体。本试验中,雄性样本在核酸检测试纸的质控区和检测区均显示红色, 雌性样本仅在质控3FA4C0FF-2B1A-47A8-BBFA-EB7E822326D4
區显色,而在检测区不显色,主要是因为特异性延伸引物的3′末端为雄性特异碱基,且5′端标记6-FAM基团, 该引物延伸反应产物与3′端标记Biotin的DNA探针进行杂交,形成同时包含Biotin和6-FAM的双标记杂交产物。该双标记杂交产物与固定在检测区的6-FAM抗体特异性结合,同时大量募集金标Biotin抗体,从而使检测区显示红色条带;固定于质控区的Biotin同样能够大量募集金标Biotin抗体,使质控区也显示红色条带。
假阳性信号的产生会严重干扰本试验建立的斑点叉尾遗传性别鉴定方法的准确性[23]。本方法在特异性延伸引物与DNA探针的设计过程,应用Oligo软件检验其二级结构间相互关系,防止由于形成二聚体而出现假阳性信号。在SNP位点外围引物延伸反应完成后,将扩增产物适当稀释,从而降低第二轮PCR体系中外围引物的浓度,同时通过第二轮PCR反应的第1次扩增对残留引物再次消耗,最终保证第2次扩增中SNP特异性延伸反应顺利进行。
将雄性遗传性别斑点叉尾个体逆转为生理性别为雌性后,再与正常雄鱼杂交,获得的子代染色体类型包括:XX型(雌性)、XY型(雄性)、YY型(雄性),其中,YY型斑点叉尾与正常雌鱼杂交后,子二代即为全雄斑点叉尾[24]。本研究建立的遗传性别鉴定方法亦可应用于XY型、YY型雄性斑点叉尾子代的筛选,将SNP位点特异性延伸引物3′端设计为雌性个体特异碱基,经过特异性引物延伸反应和核酸检测试纸显色反应后,可快速鉴定出XY型子代。
4结论
本研究成功建立了一种斑点叉尾遗传性别快速鉴定方法,通过性别连锁SNP特异性引物延伸反应结合核酸检测试纸完成对鱼类遗传性别的鉴定尚属首次,整个过程仅数小时,且能够同时检测多个样本。在斑点叉尾性别控制育种过程中,使用本研究建立的遗传性别鉴定方法能够实现对性逆转个体的快速筛选,也能够为其他鱼类的遗传性别鉴定技术开发提供参考。
参考文献:
[1]Zhong L Q,Song C,Chen X H,et al. Channel catfish in China:historical aspects,current status,and problems[J]. Aquaculture,2016,465:367-373.
[2]张振东,肖友红. 美斑点叉尾法案系统性回顾[J]. 海洋与渔业,2017(1):65-66.
[3]钟立强,王明华,陈校辉,等. 世界斑点叉尾产业近况Ⅱ:中国斑点叉尾产业发展与展望[J]. 水产养殖,2018,39(9):7-11.
[4]Devlin R H,McNeil B K,Groves T D D,et al. Isolation of a Y-chromosomal DNA probe capable of determining genetic sex in Chinook salmon (Oncorhynchus tshawytscha)[J]. Canadian Journal of Fisheries and Aquatic Sciences,199 48(9):1606-1612.
[5]Iturra P,Medrano J F,Bagley M,et al. Identification of sex chromosome molecular markers using RAPDs and fluorescent in situ hybridization in rainbow trout[J]. Genetica,1997,101(3):209-213.
[6]Vale L,Dieguez R,Sánchez L,et al. A sex-associated sequence identified by RAPD screening in gynogenetic individuals of turbot (Scophthalmus maximus)[J]. Molecular Biology Reports,2014,41(3):1501-1509.
[7]Griffiths R,Orr K L,Adam A,et al. DNA sex identification in the three-spined stickleback[J]. Journal of Fish Biology,2000,57(5):1331-1334.
[8]Agawa Y,Iwaki M,Komiya T,et al. Identification of male sex-linked DNA sequence of the cultured Pacific bluefin tuna Thunnus orientalis[J]. Fisheries Science,2015,81(1):113-121.
[9]Lee B Y,Penman D J,Kocher T D.Identification of a sex-determining region in Nile tilapia (Oreochromis niloticus) using bulked segregant analysis[J]. Animal Genetics,2003,34(5):379-383.
[10]Zheng Y,Wang N,Xie M S,et al. Establishment and characterization of a new fish cell line from head kidney of half-smooth tongue sole (Cynoglossus semilaevis)[J]. Fish Physiology and Biochemistry,2012,38(6):1635-1643.3FA4C0FF-2B1A-47A8-BBFA-EB7E822326D4
[11]Zhang S Y,Zhang X H,Chen X H,et al. Construction of a high-density linkage map and QTL fine mapping for growth-and sex-related traits in channel catfish (Ictalurus punctatus)[J]. Frontiers in Genetics,2019,10:251.
[12]Palaiokostas C,Bekaert M,Davie A,et al. Mapping the sex determination locus in the Atlantic halibut (Hippoglossus hippoglossus) using RAD sequencing[J]. BMC Genomics,2013,14:566.
[13]Zheng S Q,Wang X S,Zhang S,et al. Screening and characterization of sex-linked DNA markers and marker-assisted selection in the Southern catfish (Silurus meridionalis)[J]. Aquaculture,2020,517:734783.
[14]张世勇. 斑点叉尾生长和性别决定相关基因研究及分子标记开发[D]. 北京:中国科学院大学,2021:61-84.
[15]张世勇,陈校辉,边文冀,等. 斑点叉尾性别连锁的微卫星标记引物及遗传性别鑒定方法:CN109161603B[P]. 021-06-04.
[16]伍 姿,黄冬梅,娄晓祎,等. 动物源性食品中氨苯砜及其代谢物残留的分析方法研究进展[J]. 农产品质量与安全,2021(3):60-65.
[17]蔡 芬,陈 伟. 侧向层析试纸条现场检测牛奶中黄曲霉毒素M1[J]. 合肥工业大学学报(自然科学版),202 44(6):845-850.
[18]张 帅,齐颖颖,张红星,等. 快速检测生鲜肉中三种食源性致病菌[J]. 江苏农业学报,2016,32(4):939-945.
[19]江地科,尹清清,项明源,等. 检测猪瘟病毒胶体金和量子点试纸条的初步研制[J]. 江苏农业学报,2020,36(1):116-121.
[20]贾兴旺,刘 青,陈泽衍,等. 胶体金法检测血清2019新型冠状病毒 IgM和IgG抗体的临床应用及干扰因素分析[J]. 标记免疫分析与临床,2020,27(5):845-849.
[21]Terpos E,Ntanasis-Stathopoulos I,Skvarcˇ M.Clinical application of a new SARS-CoV-2 antigen detection kit (colloidal gold) in the detection of COVID-19[J]. Diagnostics,202 11(6):995.
[22]Li X J,Yin Y,Pang L,et al. Colloidal gold immunochromatographic assay (GICA) is an effective screening method for identifying detectable anti-SARS-CoV-2 neutralizing antibodies[J]. International Journal of Infectious Diseases,202 108:483-486.
[23]单洪波,金亚南. 基于PCR和位点特异性引物延伸反应的SNP检测方法的建立[J]. 检验医学,2018,33(6):530-535.
[24]Davis K B,Simco B A,Goudie C A,et al. Hormonal sex manipulation and evidence for female homogamety in channel catfish[J]. General and Comparative Endocrinology,1990,78(2):218-223.3FA4C0FF-2B1A-47A8-BBFA-EB7E822326D4
