内蒙古荒漠灌木内生解磷菌类群及其解磷和产铁载体能力分析
2022-06-24孟建宇郭慧琴贾丽娟杨鸿儒冯福应
孟建宇 郭慧琴 贾丽娟 杨鸿儒 冯福应
摘要:旨在揭示内蒙古荒漠灌木内生解磷菌类群,为认识和利用荒漠植物内生促生菌提供基础。用无机磷、有机磷培养基分离筛选荒漠灌木内生解磷菌;用16S rDNA基因序列分析解磷菌的菌群结构;用钼锑钪比色法测定菌株的解无机磷能力;用钒钼比色法测定菌株的解有机磷能力;通过铬天青S(CAS)定性检测和分光光度计定量分析菌株的产铁载体能力。结果表明,从荒漠灌木根部共分离得到12株解磷细菌,分属于4纲7属,其中芽孢杆菌纲(Bacilli,41.67%)为最优势菌纲,芽孢杆菌属(Bacillus,41.67%)为最优势菌属;8株菌可以使无机磷培养基(PVK培养基)变色,解无机磷能力较强,达5.32~23.99 μg/mL;这8株菌中有6株菌可在有机磷培养基上生长,其解有机磷能力为 .01~96.15 μg/mL;有5株具有产铁载体能力,其产铁载体的相对含量(As/Ar)范围为0.47~0.87。由研究结果可以看出,内蒙古荒漠灌木植物内生解磷细菌类群多样,可作为多种植物内生促生菌的重要来源。
关键词:荒漠灌木;内生解磷菌;解磷能力;产铁载体能力;芽孢杆菌
中图分类号:S154.39;S182文献标志码: A
文章编号:1002-1302(2022)12-0260-05
收稿日期:2021-07-27
基金项目:内蒙古自治区自然科学基金(编号:2018MS03042、2020BS03045);内蒙古自治区应用技术研究与开发资金(编号:2021GG0360);2020-科技兴蒙-草种业技术创新中心-2项目(编号:RZ2100000122);内蒙古农业大学生命科学学院科研创新团队项目(编号:202104)。
作者简介:孟建宇(1977—),男,内蒙古乌兰察布人,硕士,副教授,从事资源与环境微生物研究,E-mail:meng_jianyu@imau.edu.cn;共同第一作者:郭慧琴(1979—),女,内蒙古呼和浩特人,硕士,副教授,从事应用与环境微生物研究,E-mail:huiqinguo@126.com。
磷是植物生长过程中必需的重要营养元素和养分资源[1],对植物的抗逆性、抗病性和光合作用都有影响。土壤中生物可利用的磷仅占总磷含量的0.1%,可利用磷的匮乏导致植物获取有效磷的途径受限,严重影响了作物的正常生长[2-3]。据报道,土壤中无效态磷占95%以上,很难被植物直接吸收利用,严重限制了农业可持续发展[4]。与其他环境相比,寒旱区土壤缺磷更是普遍存在的现象[5],是影响农业高产的主要因素。
土壤中存在大量解磷微生物,可以提高植物对磷的需求,并且它们广泛参与不可溶性磷的转化[6]。解磷微生物通过溶解和矿化作用将土壤中的无效磷转化为有效磷。此外,解磷微生物不仅可以促进土壤中其他养分(如碳、氮)的运转和循环,也可以促进植物的生长和发育。因此,利用解磷微生物提高土壤有效磷含量是既经济又有利于农业可持续发展的措施。
植物内生细菌在宿主体内多定殖于植物的根、茎、叶、果实及种子中,与宿主形成互惠共生关系,通过信号传导或自身代谢物对其施加影响[7],在植物-土壤反馈机制中扮演着重要角色[8],是高效解磷菌的重要来源库[9]。植物内生解磷菌的促生和生防功效能协助植物抵御各种逆境胁迫[10-11]。因此,探究植物内生菌在磷素循环中的作用意义重大。
灌木作为荒漠的主要植被组成,在防风固沙、保持水土和改善气候等方面具有重要的生态功能[12]。由于内蒙古自治区51.50%的面积为荒漠区,因此分析内蒙古自治区荒漠灌木内生解磷菌类群、认识荒漠解磷菌多样性及促生功能,对于改良和保护荒漠地区的生态环境具重要意义。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 试验样品为2019年9月采自内蒙古西鄂尔多斯巴拉贡地区的霸王、 四合木、沙冬青、半日花和白刺5种灌木植物的主根和须根。
1.1.2 培养基配方 牛肉膏蛋白胨培养基:3.0 g/L牛肉膏,10.0 g/L蛋白胨,5.0 g/L氯化钠,pH值为7.0~7.5。LB培养基:10.0 g/L胰蛋白胨,5.0 g/L酵母粉,5.0 g/L氯化钠,pH值为7.2。无机磷培养基:10.00 g/L葡萄糖,10.00 g/L磷酸钙,0.30 g/L硫酸镁,0.30 g/L氯化钾,0.50 g/L硫酸铵,0.30 g/L氯化鈉,0.03 g/L硫酸亚铁,0.03 g/L硫酸锰,pH值为7.0~7.5。无机磷培养基(PVK培养基):10.000 g/L 葡糖糖,5.000 g/L磷酸钙,0.500 g/L硫酸铵,0.200 g/L氯化钠,0.100 g/L硫酸镁,0.200 g/L 氯化钾,0.500 g/L酵母粉,0.002 g/L硫酸锰,0.002 g/L硫酸亚铁,0.600 g/L 0.4%溴酚蓝,18.000 g/L琼脂,pH值为7.0~7.2。有机磷培养基:10.0 g/L葡萄糖,0.2 g/L硫酸铵,5.0 g/L氯化镁,0.5 g/L硫酸镁,0.1 g/L氯化钾,2.0 g/L植酸钙。液体发酵培养基:15.00 g/L葡萄糖,3.00 g/L蛋白胨,20.00 g/L可溶性淀粉,0.50 g/L硫酸铵,0.50 g/L氯化钾,0.03 g/L 硫酸镁,0.03 g/L硫酸锰,0.04 g/L硫酸亚铁,0.02 g/L磷酸二氢钾,pH值为5.5。蔗糖-天冬氨酸(MSA)培养基:20.0 g/L蔗糖,2.0 g/L天冬酰胺,1.0 g/L磷酸氢二钾,0.5 g/L硫酸镁,pH值为7.0。铬天青S(CAS)固体培养基:葡萄糖 100.0 g/L,蛋白胨 0.0 g/L,硫酸镁 0.5 g/L,氯化钙5.0 g/L,哌嗪1,4-二乙磺酸32.24 g/L,琼脂20.0 g/L,氯化铁0.002 7 g/L,铬天青S 0.06 g/L,十六烷基三甲基溴化铵0.073 g/L,pH值为6.8。
1.2 试验方法
1.2.1 植物内生解磷细菌的分离 称取2 g植株根部小段,按如下方法进行表面消毒:用75%乙醇浸泡2 min→用无菌水漂洗→用0.1%氯化汞浸泡 1~3 min→用无菌水漂洗5~6次。然后在无菌研钵(含10 mL无菌水)中研磨。将研磨液转入无菌玻璃管中进行稀释后倒平板,各稀释梯度设置3个平行,于26℃培养。5 d后挑取形态各异的单菌落划线纯化培养。将纯化后的菌株分别接种于PVK固体培养基和有机磷培养基上进行筛选。
1.2.2 菌株的16S rDNA的鉴定及其同源性分析 菌株的16S rDNA基因扩增引物为细菌通用引物27F、1492R。PCR产物送至生工生物工程(上海)股份有限公司进行测序,将测序得到的16S rDNA序列通过Blast-n与EX-TAXON数据库进行比对,用MEGA 6.0构建系统发育树。
1.2.3 解无机磷能力的测定 将菌株在PVK培养基平板上划线培养3 d,挑选变为蓝色的菌落。采用钼锑钪比色法测定菌株的解磷能力。将初筛菌株接种于LB培养基上后,在28 ℃摇床中振荡过夜。将菌液在10 000 r/min条件下离心后制成菌悬液,取0.5 mL接种到无机磷培养基上,在30 ℃、170 r/min摇床上培养7 d后,10 000 r/min离心并测定上清液的pH值。取1.25 mL上清液于比色管中,再加入2.5 mL钼锑抗比色剂,用去离子水定容后静置 30 min,测定D730 nm,根据标准曲线y=2.733x+0.011(r2=0.997 5)计算含磷量。
1.2.4 解有机磷能力的测定 利用钒钼比色法测定菌株解植酸磷能力。将能在有机磷培养基上生长的菌株接种于LB液体培养基上,在28 ℃摇床上培养过夜,10 000 r/min离心收集菌体。用生理盐水稀释菌体制成菌悬液,取0.5 mL菌悬液接种到发酵培养基中,在30 ℃、160 r/min摇床上发酵培养 72 h 后10 000 r/min离心,取1 mL上清液,再加入1 mL浓度为8.4 g/L的植酸钠溶液,于37 ℃保温30 min后中止反应,测定D415 nm。参照标准曲线y=24.389x+0.037(r2=0.994 7)计算含磷量。
1.2.5 产铁载体能力的测定 用灭菌牙签挑取单菌落后接种于CAS培养基平板上,每个平板接种4个点,每个菌株设3次重复,于28 ℃恒温培养96 h。测定晕圈直径(D)及菌落直径(d)并计算其比值(D/d)。对于筛选得到的产铁载体能力较强的菌株,参考Payne的方法[13]进行定量测定。将菌株接种到MSA培养基中培养48 h,将菌液于6 000 r/min条件下离心后取1.5 mL上清液,再加1.5 mL CAS溶液充分混匀,1 h后测定D630 nm(As),以双蒸水为对照。另取 1.5 mL CAS溶液,加入1.5 mL MSA培养基的上清液后测定D630 nm(参比值,Ar)。以As/Ar表示铁载体的相对含量,其值越低,表示铁载体的含量越高。As/Ar(1.0~0.0)表示每减小0.2增加1个“+”;As/Ar低于0.5,表示产铁载体能力较强(+++)[14]。
2 结果与分析
2.1 内生解磷菌的分离及类群分析
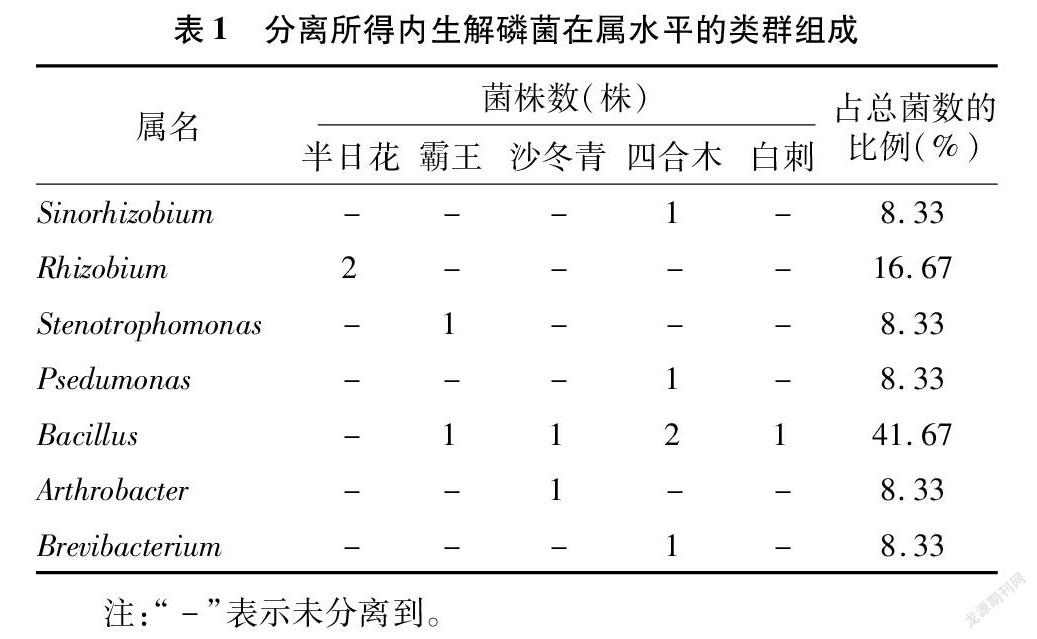
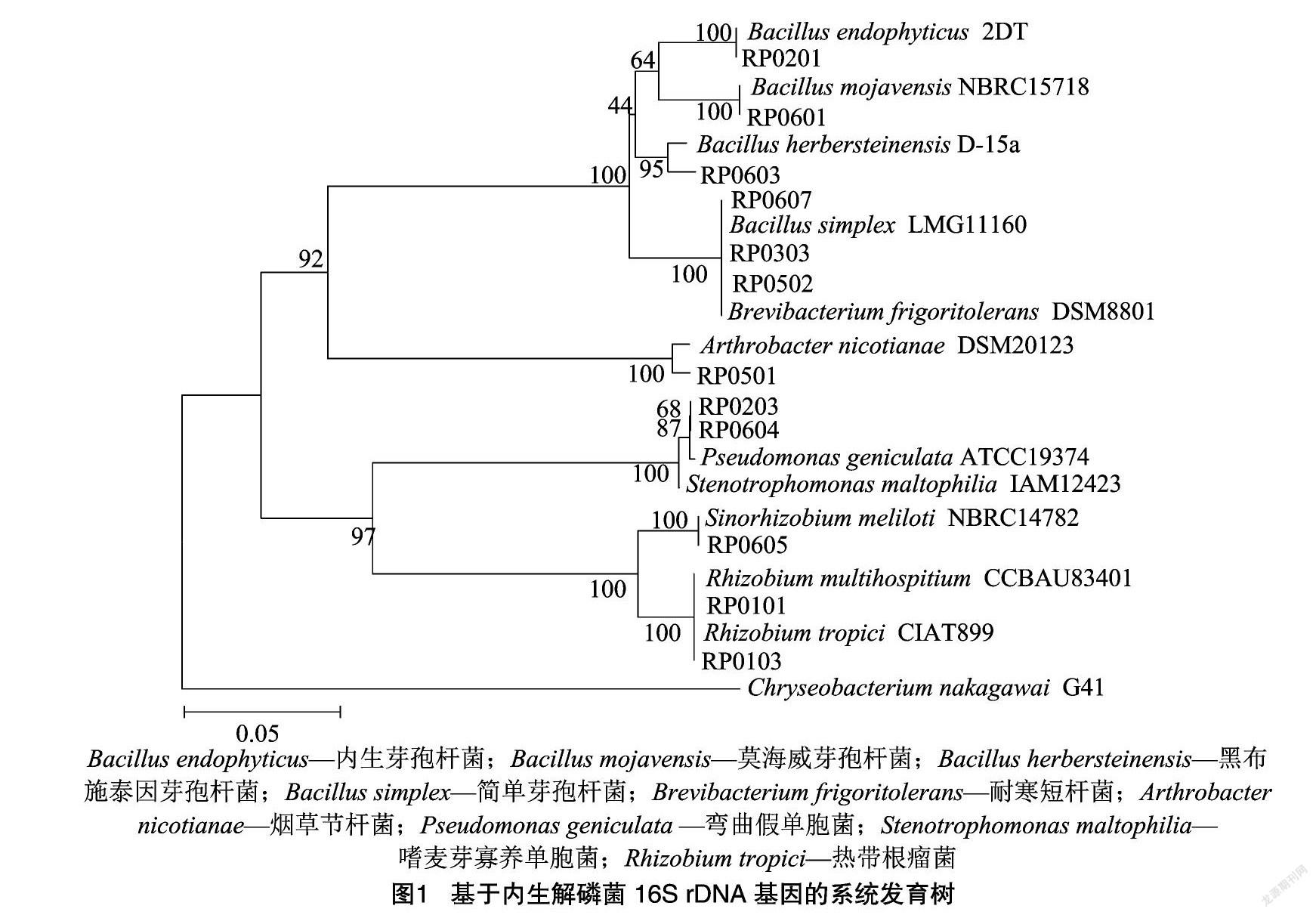
从内蒙古荒漠5种灌木根内共分离得到12株解磷细菌,其中半日花2株,霸王2株,白刺1株,沙冬青2株,四合木5株。内生解磷细菌分类类群组成(表1)和系统发育分析结果(图1)表明,12株解磷细菌分属于α-变形菌纲(α-Proteobacteria,占比25.00%)、γ-变形菌纲(γ-Proteobacteria,占比16.67%)、芽孢杆菌纲(Bacilli,占比41.67%)和放线菌纲(Actinobacteria,占比16.67%),其中芽孢杆菌纲为最具优势的类群,其次为γ-变形菌纲和放线菌纲。在属分类水平上,12株解磷细菌分属于7个属,分别为根瘤菌属(Rhizobium,2株)、中华根瘤菌属(Sinorhizobium,1株)、单胞菌属(Stenotrophomonas,1株)、假单胞菌属(Psedumonas,1株)、芽孢杆菌属(Bacillus,5株)、节杆菌属(Arthrobacter,1株)和短杆菌属(Brevibacterium,1株),其中芽孢杆菌属为最具优势的菌属,占总菌数的41.67%,其次为根瘤菌属,占总菌数的16.67%。在不同灌木之间,分离得到的内生解磷细菌类群组成差异较明显,其中芽孢杆菌属分布较广,存在于4种灌木中,其余属仅分布于1种灌木中,如根瘤菌属只在半日花中分离到,中华根瘤菌屬、假单胞菌属和短杆菌属只在四合木中分离到,单胞菌属只在霸王中分离到,节杆菌属只在沙冬青中分离到。
2.2 解无机磷能力
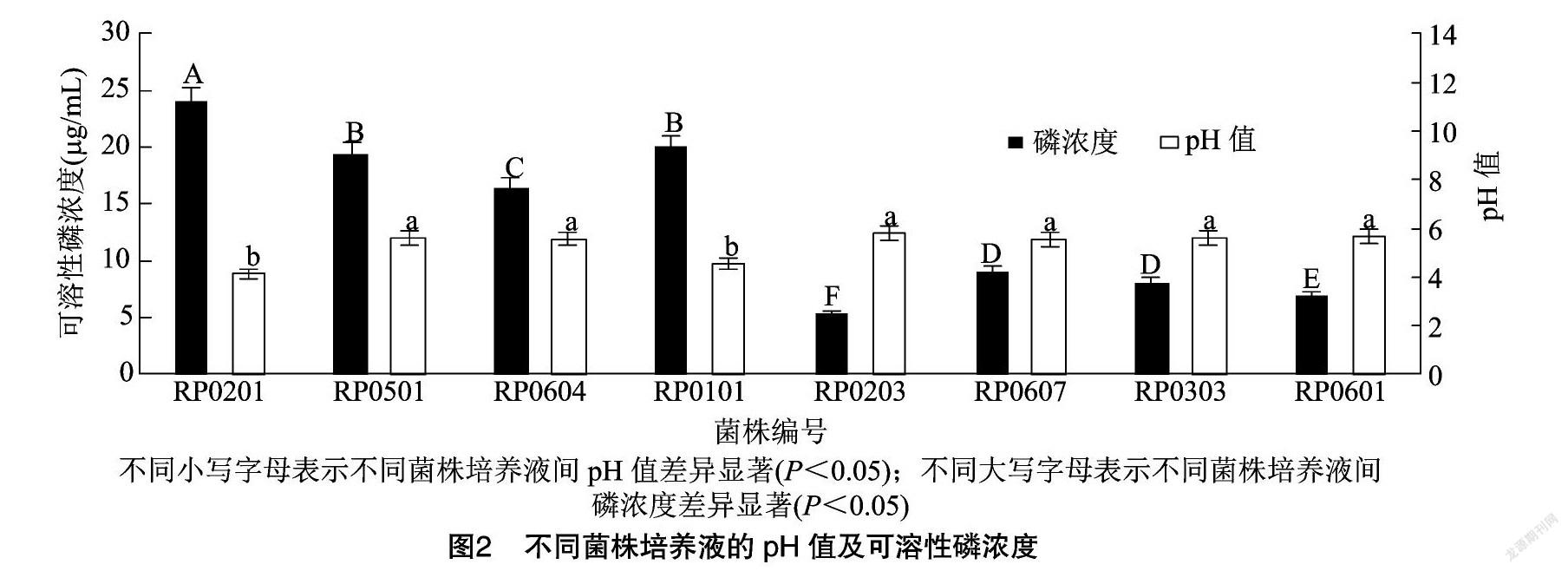
对既能在无机磷培养基上生长,又能使PVK平板产生明显颜色变化的8株菌(RP0201、RP0501、RP0604、RP0101、RP0203、RP0607、RP0303、RP0601)的解磷能力进行测定,由图2可知,各菌株的解无机磷(磷酸钙)能力在5.32~9.08 μg/mL之间;有4株菌的解磷能力大于16 μg/mL,占总数的50%,其余4株菌的解磷能力在5.32~9.08 μg/mL 之间;解磷能力最强的是分离自霸王的菌株RP020 为23.99 μg/mL,具有良好的应用潜力。
2.3 解有机磷能力
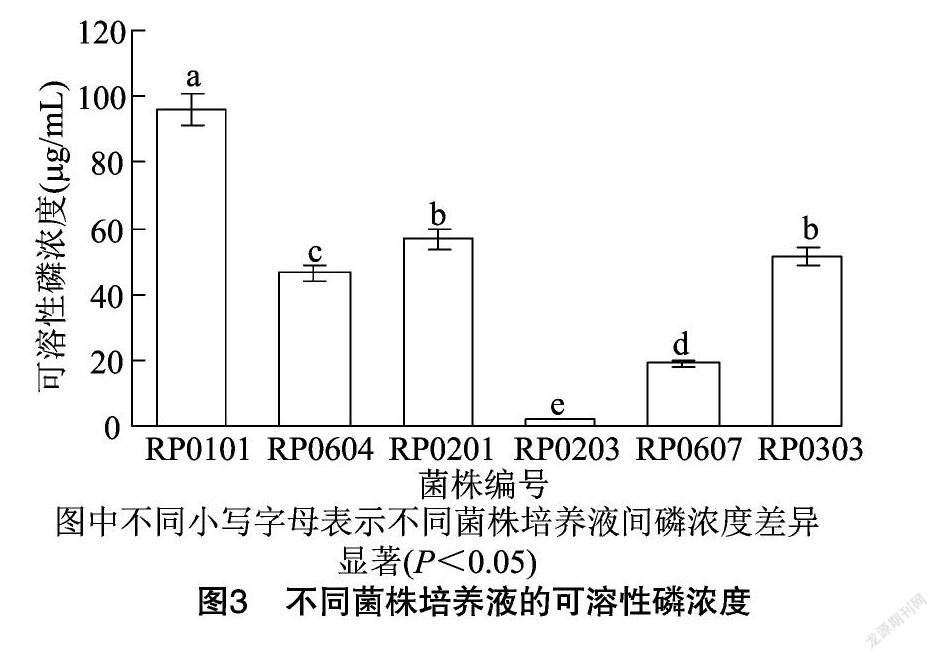
本研究对菌株的解无机磷能力进行定性分析后,将解无机磷能力较强的8株菌在有机磷液体发酵培养基中进行培养,发现其中6株菌有解有机磷(植酸磷)的能力。从图3可以看出,解有机磷能力高于 45 μg/mL 的菌株有4株,占总数的66.67%,分别是分离自半日花的菌株RP0101(96.15 μg/mL)、分离自四合木的菌株RP0604(46.52 μg/mL)、分离自霸王的菌株RP0201(56.64 μg/mL)和分离自白刺的菌株RP0303(51.40 μg/mL); 分离自四合木的菌株RP0607的解有机磷能力为19.08 μg/mL,而分离自霸王的菌株RP0203只有2.01 μg/mL。综上可知,菌株RP0101的解有机磷能力最强,具有较好的应用潜力。
2.4 产铁载体分析
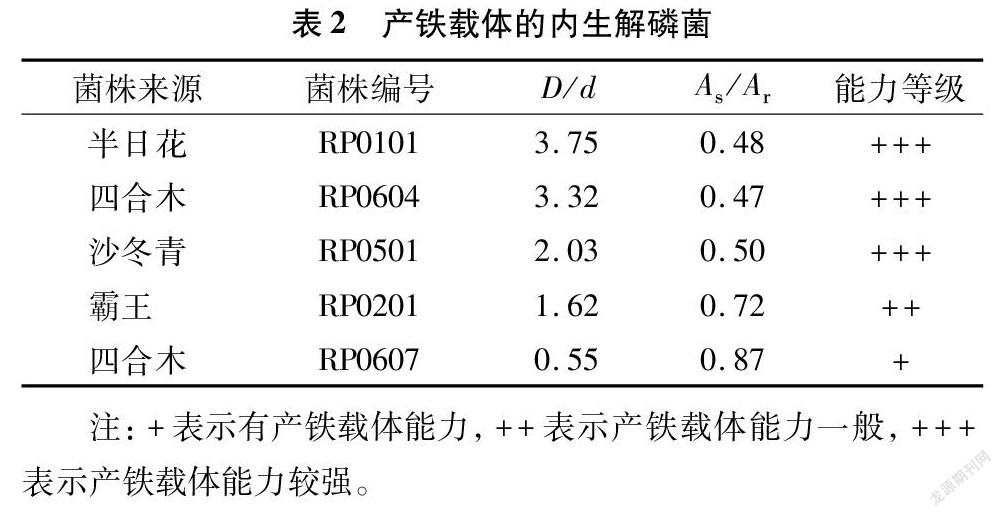
利用CAS检测平板和分光光度法对筛选出的8株内生解磷菌的产铁载体能力进行测定。由表2可以看出,有5株解磷菌具有产铁载体能力,这些菌株的As/Ar范围为0.47~0.87;菌株RP0101、RP0604和RP0501的产铁载体能力较高;所筛选的内生解磷菌中产铁载体菌株占62.5%,能力较强的菌株所占比例为37.5%。
3 结论与讨论
目前,有关解磷菌的研究主要集中于土壤和根际,对于内生菌的解磷活性报道还较少。本研究从内蒙古5种植物根内生組织中分离得到12株解磷细菌,分属4纲7属,说明内蒙古荒漠灌木有种类丰富的根内解磷菌资源。Kumar在印度哈里亚纳邦干旱半干旱地区所分离得到的解磷菌绝对优势门、属分别为厚壁菌门(Firmicutes)、芽孢杆菌属[15],本研究中干旱的内蒙古荒漠灌木根部优势解磷菌群的研究结果与之一致。
经过PVK平板划线后,很多菌株都没有表现出解无机磷的能力,即便具有解磷能力,其能力也都不高。目前已报道的解磷能力较强的植物内生菌都是来自生长环境条件较好的作物或草地优势植物,如李振东等从乳白香青中分离得到4株内生解磷菌,解磷量为65.24~315.36 mg/L[9]。本研究中发现,解磷菌培养液的pH值(4.13~5.79)都有不同程度的下降,但与解磷量没有很强的正相关性,这与很多研究报道的结果[16-18]类似。
在本研究筛选出的解有机磷菌中,绝大多数为假单胞菌(33.3%)和芽孢杆菌(50.0%)。其中,解有机磷能力高于45 μg/mL的有4株,解有机磷能力最高的菌株是RP010 解有机磷能力高达 96.15 μg/mL,处于较高水平。在本研究中,具有解有机磷能力的菌株占所筛菌株总数的50%,分属于3属,表明荒漠环境中具有丰富的解有机磷植物内生菌。本研究筛选得到的具有产铁载体能力的菌株占总菌数的41.67%,且绝大多数(80%)为解有机磷细菌,表明内蒙古荒漠植物可成为筛选较高促生能力的解有机磷内生菌的重要来源。
参考文献:
[1]Alori E T,Glick B R,Babalola O O. Microbial phosphorus solubilization and its potential for use in sustainable agriculture[J]. Frontiers in Microbiology,2017,8:971-978.
[2]Ingle K P,Padole D A. Phosphate solubilizing microbes:an overview[J]. International Journal of Current Microbiology and Applied Science,2017,6(1):844-852.
[3]Kihara J,Njoroge S. Phosphorus agronomic efficiency in maize-based cropping systems:a focus on western Kenya[J]. Field Crops Research,2013,150:1-8.
[4]Romanyà J,Blanco-Moreno J M,Sans F X. Phosphorus mobilization in low-P arablesoils mayinvolve soilorganic C depletion[J]. Soil Biology and Biochemistry,2017,113:250-259.
[5]Sun L,Wang S,Zhang Y,et al. Conservation agriculture based on crop rotation and tillage in the semi-arid Loess Plateau,China:effects on crop yield and soil water use[J]. Agriculture,Ecosystems and Environment,2018,251:67-77.
[6]Babalola O O,Glick B R. Indigenous African agriculture and plant associated microbes:current practice and future transgenic prospects[J]. Science Research and Essays,2012,7(28):2431-2439.
[7]Behie S W,Zelisko P M,Bidochka M J. Endophytic insect-parasitic fungi translocate nitrogen directly from insects to plants[J]. Science,2012,22:1576-1577.
[8]张丽珍,冯利利,蒙秋霞,等. 一株柠条内生解磷菌的分离鉴定及实时荧光定量PCR检测[J]. 生态学报,2013,33(13):3941-3946.
[9]李振东,陈秀蓉,杨成德,等. 乳白香青内生解磷菌的筛选鉴定及解磷特性研究[J]. 草业学报,2013,22(6):150-158.
[10]Verma S C,Ladha J K,Tripathi A K. Evaluation of plant growth promoting and colonization ability of endophytic diazotrophs from deep water rice[J]. Journal of Biotechnology,200 91:127-141.
[11]Wakelin S A,Warren R A,Harvey P R,et al. Phosphate solubilization by Penicillium spp. closely associated with wheat roots[J]. Biology and Fertility of Soils,2004,40:36-43.
[12]蘇辉兰,莫雪雪,余炳锋,等. 贡柑果园高效解磷菌的筛选及其解磷条件优化[J]. 北方园艺,2019(5):101-107.
[13]Payne S M. Detection,isolation,and characterization of siderophores[J]. Methods in Enzymology,1994,235:329-344.
[14]Persmark M,Expert D,Neilands J B. Isolation,characterization,and synthesis of chrysobactin,a compound with siderophore activity from Erwinia chrysanthemi[J]. The Journal of Biological Chemistry,1989,264(6):3187-3193.
[15]Kumar V,Kayasth M,Chaudhary V,et al. Diversity of diazotrophs in arid and semi-arid regions of Haryana and evaluation of their plant growth promoting potential on Bt-cotton and pearl millet[J]. Annals of Microbiology,2014,64(3):1301-1313.
[16]Thomas G V,Shantaram M V,Saraswathy N. Occurrence and activity of phosphate-solubilizing fungi from coconut plantation soils[J]. Plant and Soil,1985,87(3):357-364.
[17]Asea P E A,Kucey R M N,Stewart J W B. Inorganic phosphate solubilization by two Penicillium species in solution culture and soil[J]. Soil Biology and Biochemistry,1988,20(4):459-464.
[18]Narsian V,Patel H. Aspergillus aculeatus as a rock phosphate solubilizer[J]. Soil Biology and Biochemistry,2000,32(4):559-565.
