蓝光处理对夏菊优香组培苗生长发育的影响及其分子机制
2022-06-24刘涛程培蕾赵坤坤王丽君蒋甲福
刘涛 程培蕾 赵坤坤 王丽君 蒋甲福




摘要:为研究蓝光对夏菊生长发育的影响,并探究光质影响菊花生长发育的分子机制,选用菊花优香 [Chrysanthemum morflorium (Ramat.) Kitam.‘ Yuuka’]为试验材料,应用植物组织培养技术,经蓝光照射组培苗后,对组培苗进行表型观察、叶绿素含量测定、石蜡切片制作及相关基因表达量分析,进而从表观、细胞、分子3个层面来观察蓝光照射对菊花的影响。结果表明,在组培苗生长前期,蓝光处理会抑制菊花根的发育,而在后期该抑制作用减弱;同时蓝光照射会使植株发生矮化,且叶片明显变小,但植株总叶片数并未改变。基于石蜡切片的结果显示,蓝光处理60 d后,植株较白光对照组,茎明显变细,根变粗,叶片中栅栏细胞明显变大;同时,在叶绿素含量方面,蓝光照射对叶绿素含量的影响并不明显;而在基因表达水平上,蓝光处理会使光敏色素基因CmPHYA、CmPHYB、CmPHYC和隐花色素基因CmCRY1、CmCRY2的表达量升高,使CmCRY1.2的表达量下降。另外,蓝光处理对开花调控基因CmCO的表达没有明显影响,但能诱导开花素基因CmFT1、CmFT2、CmFT3的表达。
关键词:菊花;蓝光;石蜡切片;开花基因
中图分类号:S682.1+10.4+3 文献标志码: A
文章编号:1002-1302(2022)12-0150-06
收稿日期:2021-07-28
基金項目:国家自然科学基金(编号:31872146)。
作者简介:刘 涛(1993—),男,山东青岛人,硕士,农艺师,主要从事园艺作物组培、栽培、育种研究。E-mail:773018081@qq.com。
通信作者:蒋甲福,博士,教授,博士生导师,主要从事菊花遗传育种与分子生物学研究。E-mail:jiangjiafu@njau.edu.cn。
菊花(Chrysanthemum morflorium)原产于我国,多为短日照植物,秋季开花,因其观赏价值极高,深受人们的喜爱。作为世界四大切花之一,菊花的栽培生产遍布世界各地,且对其生长发育的研究也得到了人们的普遍重视。优香作为菊花品种之一,表现为光周期不敏感,因此夏季即可开花[1],其较为独特的开花机制一直是人们研究的热点。已有研究表明,不同光质对植物生长发育所产生的影响是不同的,如红光相对于蓝光对葡萄的形态建成所起的作用更大[2];而在蝴蝶兰组培苗方面的研究表明,不同光质对植物组培苗的生长发育也会产生不同的影响[3]。当然,在光质影响菊花生长发育方面也有类似报道,如在菊花神马中的研究表明,白光和红光对菊花神马的生长更加有利[4];Kim等研究表明,不同光质对菊花组培苗的光合速率及气孔数目有不同的影响[5];Jeong等研究表明,补加蓝光对菊花的净光合率及开花时间会产生影响[6]。然而在以上报道中,虽涉及蓝光处理,但此类报道多集中在表型观察方面,并未深入研究,且试验普遍选用秋菊,对于光周期不敏感的夏菊,并不能完全参考。另外,为进一步探究光质影响植物生长发育的分子机制,研究者发现了光敏色素、隐花色素以及向光素的存在,而光敏色素、隐花色素已有研究证实,其参与了植物的开花调控路径[7-8],且隐花色素作为一种蓝光受体,在光信号感知及信号传导过程中也起着重要作用[9]。
本试验以夏菊优香为材料,为避免大田栽培过程中存在的环境差异,选用组培苗进行光照处理。通过表型观察、数据分析、石蜡切片制作及实时荧光定量PCR等技术手段,对蓝、白光处理后的差异进行比较分析,旨在探究蓝光处理对夏菊的影响机制,并希望借此对菊花的组培、栽培提供一定的帮助。
1 材料与方法
1.1 试验材料
本试验于2017年在南京农业大学菊花遗传育种实验室进行,材料夏菊[C. morflorium (Ramat.) Kitam.]品种优香(Yuuka)取自南京农业大学菊花遗传及分子育种实验室,取材后经外植体消毒、植物组织培养等操作于组培瓶中培养,待组培苗长大后,取组培苗相同位点节间,转置新组培瓶中,每瓶放3株,置于组培室中进行光照处理。处理在LED(全白、全蓝)灯光下进行,处理时间维持2个月。处理过程中,组培室温度恒定为25 ℃,白光、蓝光光周期均为 16 h/8 h,光强度均为38 μmol/(m2·s)。处理结束后进行如下取样:叶绿色含量直接称取新鲜叶片0.2 g进行测定;石蜡切片制作取样根、茎、叶置于酒精醋酸福尔马林混合(FAA)固定液中固定,4 ℃冰箱保存;相关基因表达量测定取样根、茎、叶、生长点,并置于液氮中进行速冻,-80 ℃冰箱保存。
1.2 表型观察
光照处理过程中观察记录组培苗生根数、生根长度、植株高度并拍照;光照处理60 d取组培苗统计单株叶片数,随机选取组培苗5株,取每株最大叶片3张,进行测量计算并拍照。
1.3 石蜡切片制作
将FAA固定液中固定的根、茎、叶取出,经脱水、透明、渗蜡、包埋、切片等操作进行石蜡切片制作[10],并使用番红固绿双重染色法和固绿快速染色法对切片进行染色,封片后,显微镜下观察各组织器官形态、大小。
1.4 叶绿素含量测定
取新鲜叶片0.2 g,加石英砂、碳酸钙进行研磨,随后使用95%乙醇进行萃取,并用分光光度计测量665、649、490 nm 3个波长下的吸光度,通过计算,求得叶绿素a、叶绿素b、类胡萝卜素含量。
1.5 荧光实时定量PCR
使用Trizol试剂盒(TaKaRa)进行总RNA的提取。取0.2 g左右根、茎、叶、生长点样品在液氮中研磨,加入2 mL Trizol后按说明书步骤操作。其中在第1次三氯甲烷抽提后使用DNaseⅠ消化基因组DNA。提取的RNA溶于20 μL 无酶无菌水中。使用两步法反转录试剂盒进行反转录得到cDNA。根据孙静克隆得到的CmFT1(GenBank:AB545936.2)、CmFT2(GenBank:AB677317.1)、CmFT3(GenBank:AB679272)[11]设计定量引物(表1),根据夏菊优香转录组库序列分析(SRP029991),设计CmPHYA(AB733629)、CmPHYB(AB733630)、CmPHYC、CmCRY1.2(KC202424)、CmCRY1、CmCRY2(KJ463737)、CmCO(JQ693394)的定量引物(表1)。使用菊花Elongation Factor 1α (CmEF1α,KF305681)进行cDNA 第1链检测并作为内参对照,对比其他基因表达量的差异,内参引物为CmEF1α-F和CmEF1α-R。定量PCR仪使用Mastercycler ep realplex S(Eppendorf),程序为: 95 ℃ min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 0 s,40 个循环。程序结束后得到每个样品的CT值,假定扩增效率为100%,并假定标准曲线及每次扩增之间的效率保持一致,采用2-ΔΔCT 法进行相对定量分析[12]。
2 结果与分析
2.1 表型观察
2.1.1 蓝、白光处理不同阶段根的生长情况
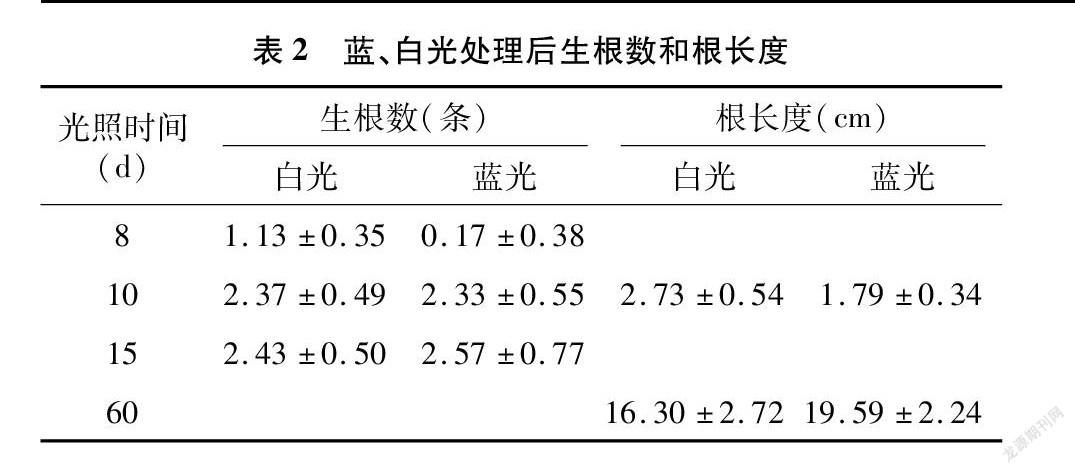
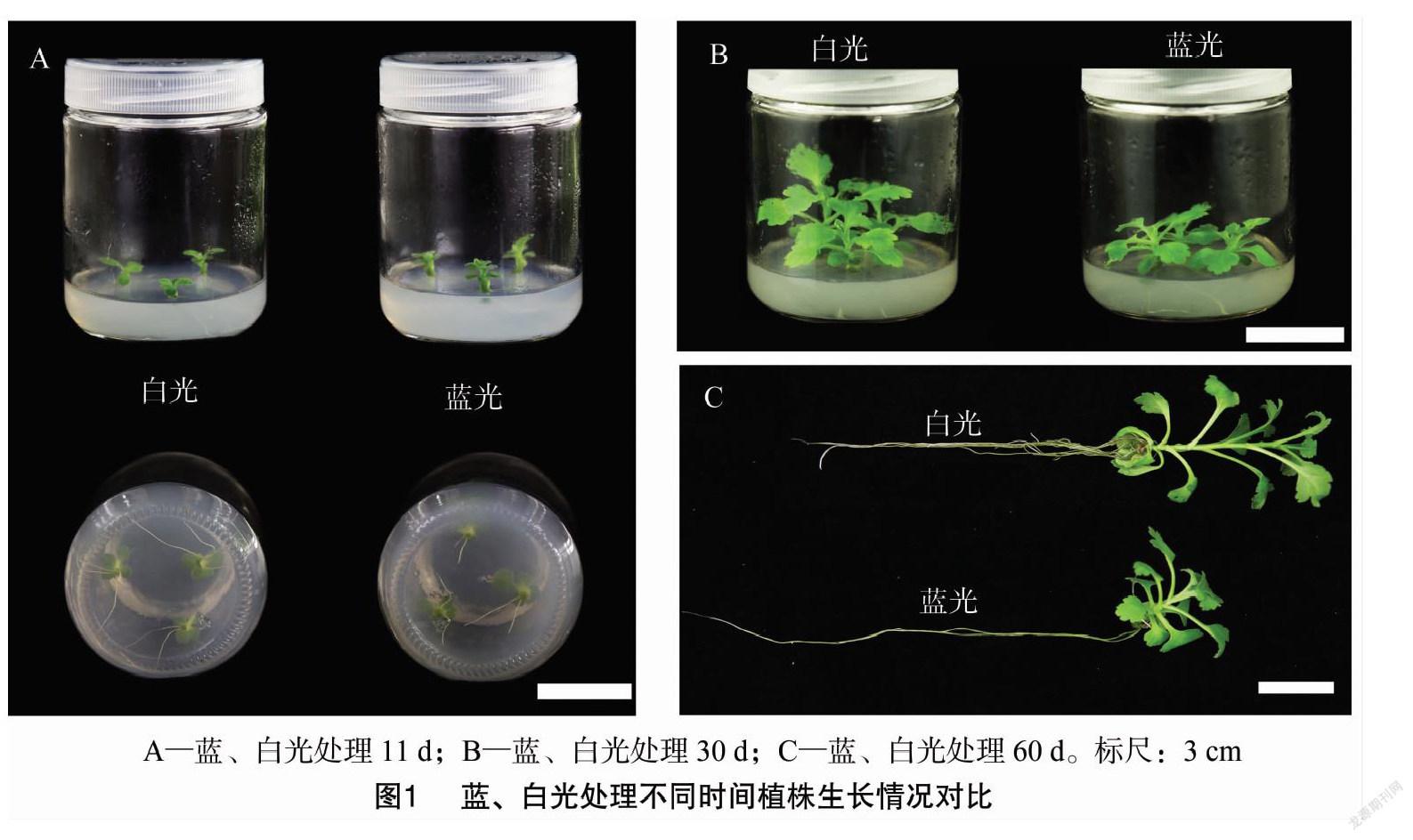
分别统计光照处理8、10、15 d藍、白光下组培苗生根数,并对光照处理10、60 d的根长度进行测量,计算平均值(表2)。根据统计结果,相对于白光,蓝光处理下的组培苗在生长前期,其生根速度及根长度较对照明显受到抑制,而在生长后期,该抑制逐渐消失,前期的抑制效果被逐渐弥补(图1)。
2.1.2 蓝、白光处理不同阶段地上部分的生长情况
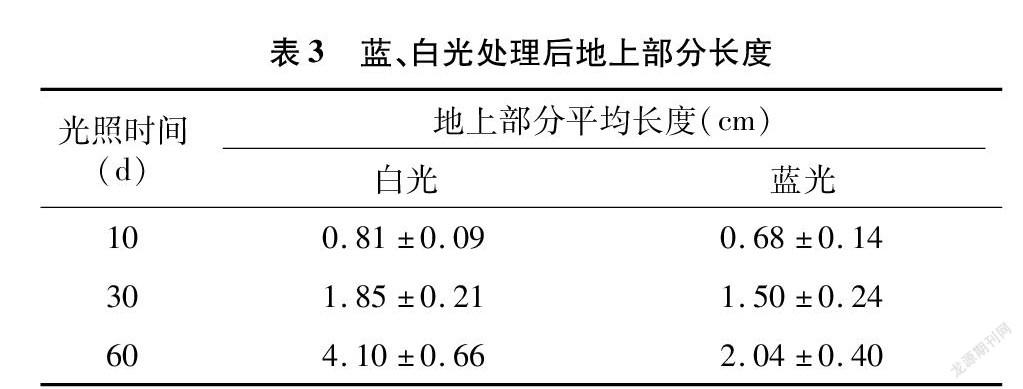
分别测量统计10、30、60 d优香组培苗地上部分长度,并计算平均值(表3)。结果发现,在蓝光照射下的组培苗较白光均明显变矮,光照60 d蓝光下植株仅为对照组高度的1/2(图1)。
2.1.3 蓝、白光处理后期植株叶片生长情况
光照处理60 d后, 统计组培苗的叶片数和叶面积(表4),
并拍照记录(图2)。经比较发现,夏菊优香组培苗经蓝光处理60 d后,单株叶片总数保持不变,但叶面积较白光对照组明显变小。
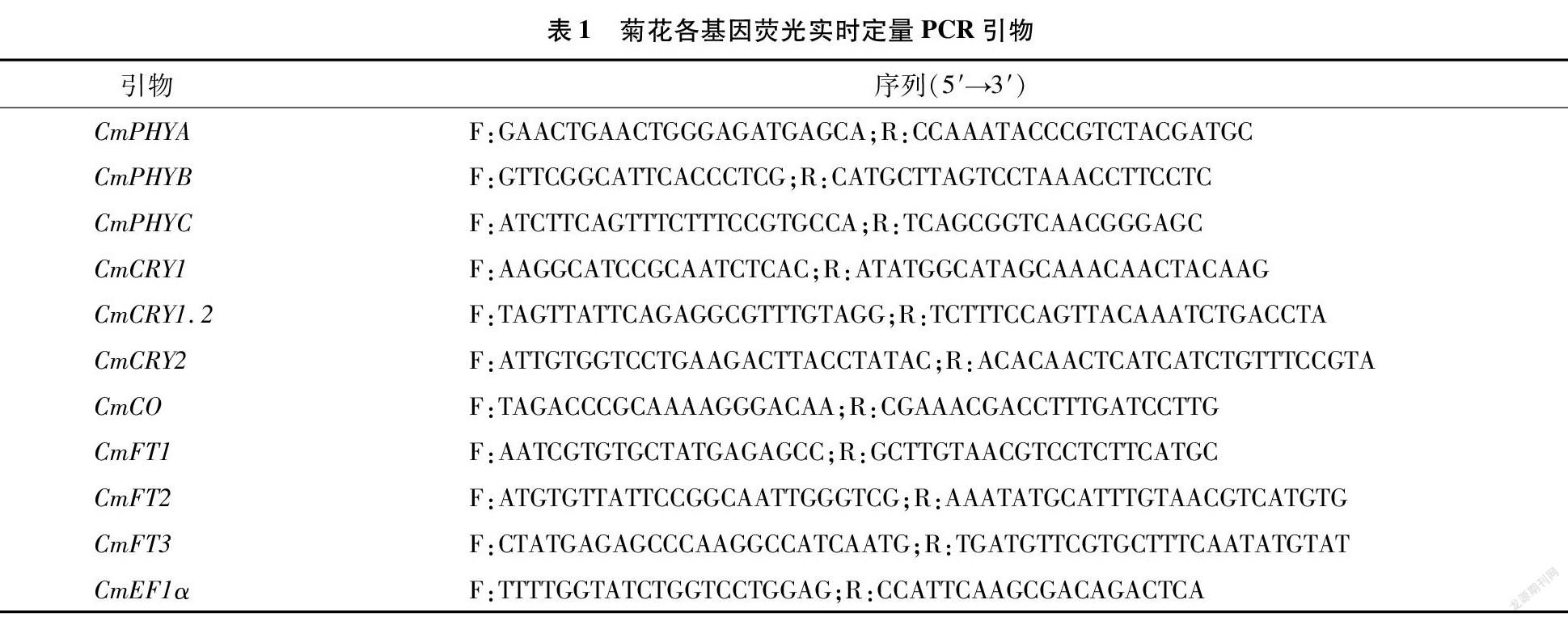
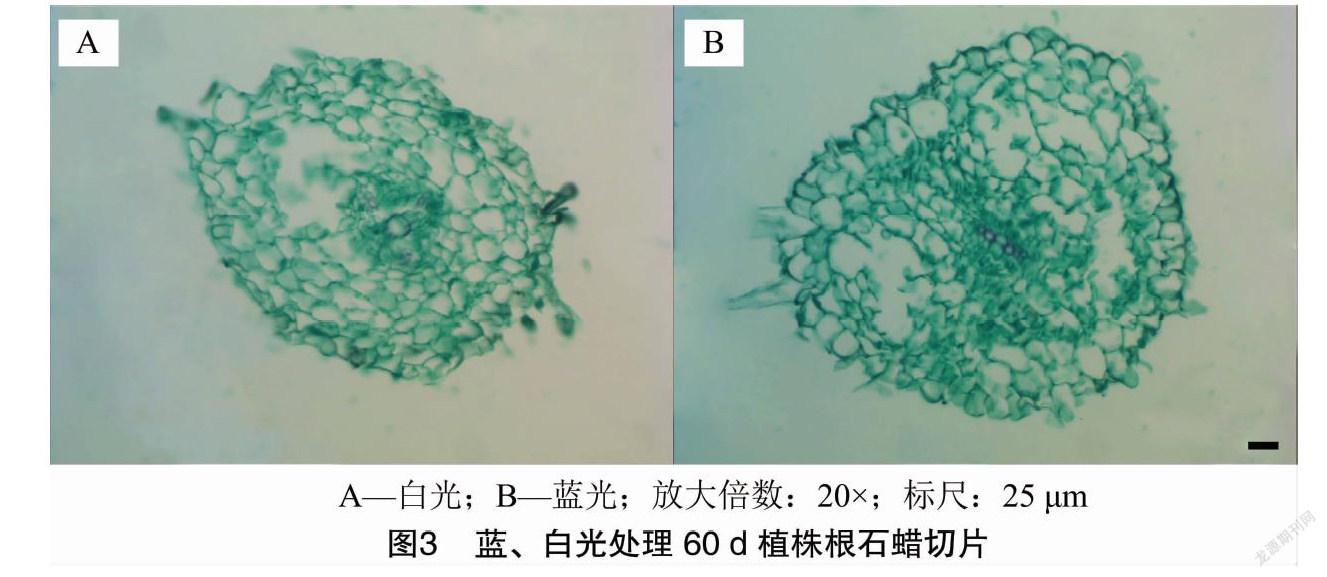
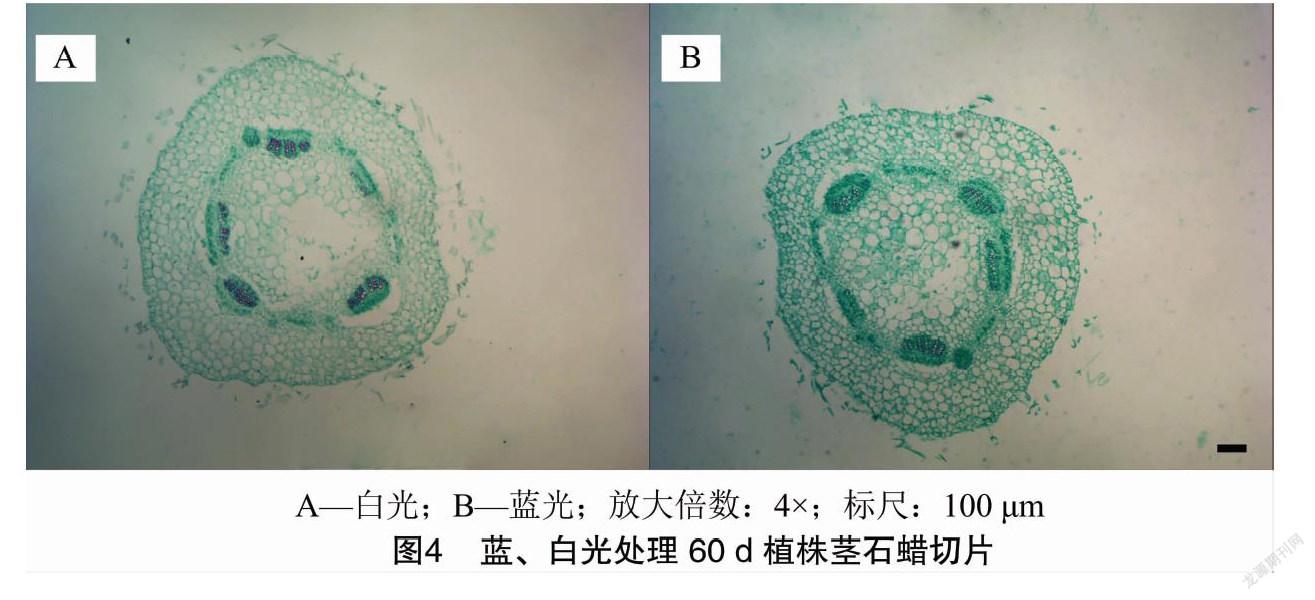
2.2 石蜡切片结果
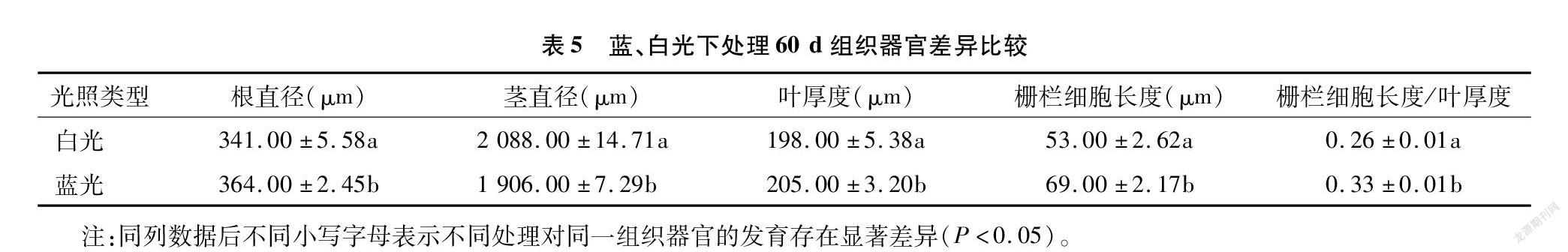
光照处理60 d后,随机选取蓝、白光下各3株组培苗的成熟区根段、茎中段及叶面积最大的3张叶片,经渗蜡、切片、番红固绿双重染色(叶片选用固绿快速染色法染色)后,置于显微镜下观察根的最大直径(图3),茎的最大直径(图4),叶片的叶厚度及栅栏细胞厚度(图5),进行测量统计,随后计算各部位平均值,结果见表5。比较发现,夏菊优香组培苗经蓝光处理60 d后,根变粗,茎显著变细,叶厚度变厚而栅栏细胞长度显著变长,栅栏组织厚度占叶片总厚度的比值明显变大。
2.3 叶绿素含量测定
取蓝、白光处理60 d组培苗叶片,使用分光光度法进行叶绿素含量的测定。由表6可知, 蓝光处理后,叶绿素b、类胡萝卜素含量基本保持不变,仅叶绿素a含量略微升高。
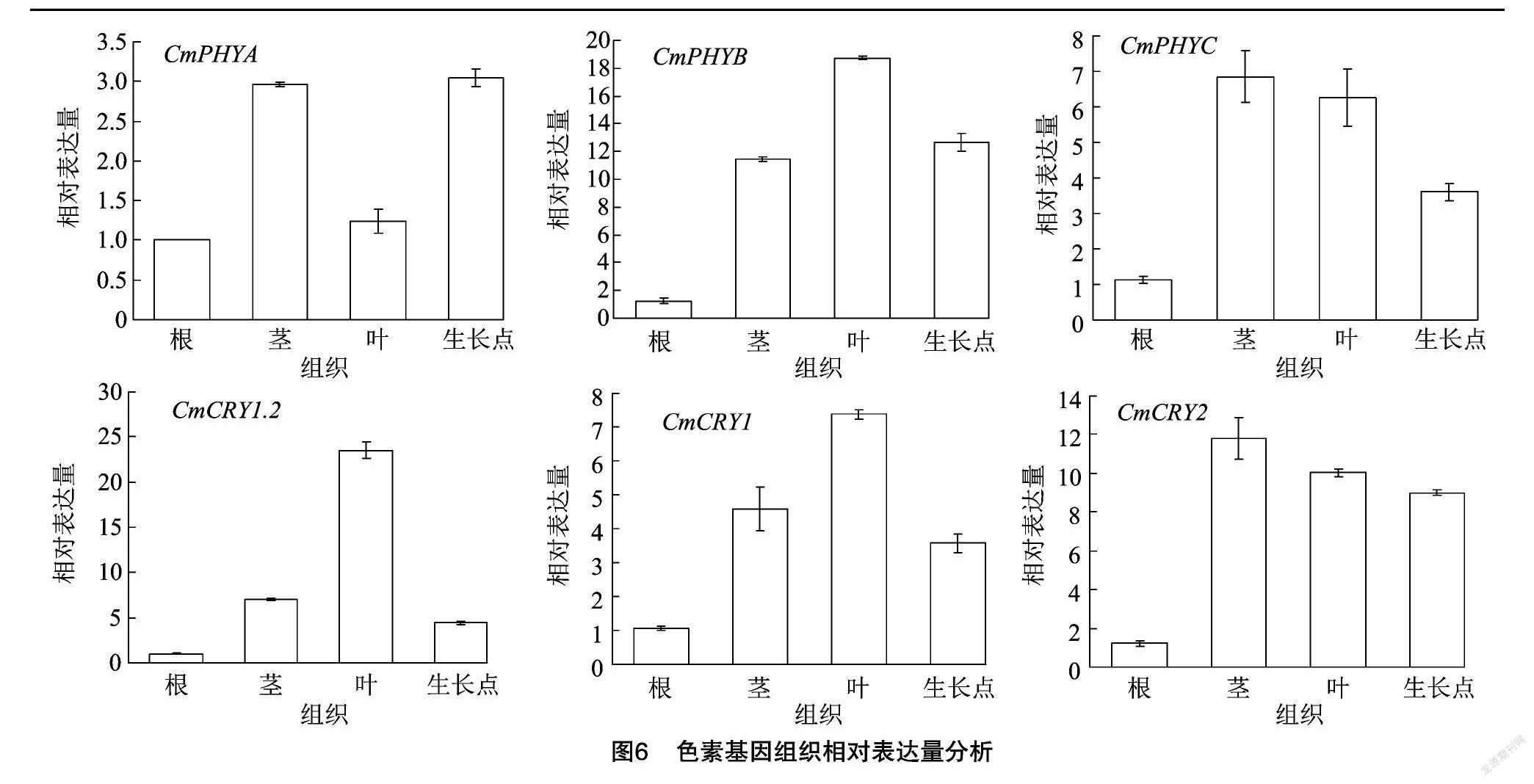
2.4 色素基因组织相对表达量分析
取白光处理60 d组培苗根、茎、叶、生长点反转录后的cDNA,利用实时荧光定量对光敏色素基因CmPHYA、CmPHYB、CmPHYC,隐花色素基因CmCRY1.2、CmCRY1、CmCRY2的相对表达量进行分析。由图6可知,在菊花组培苗中各色素基因在不同部位的表达量是不同的,CmPHYA表达量最高的部位是茎和生长点,在根中表达量最低;CmPHYB表达量最高的部位是叶,最低部位是根;CmPHYC表达量最高的部位是茎,最低部位是根;CmCRY1.2表达量最高的部位是叶,最低部位是根;CmCRY1表达量最高的部位是叶,最低部位是根;CmCRY2表达量最高的部位是茎,最低部位是根。
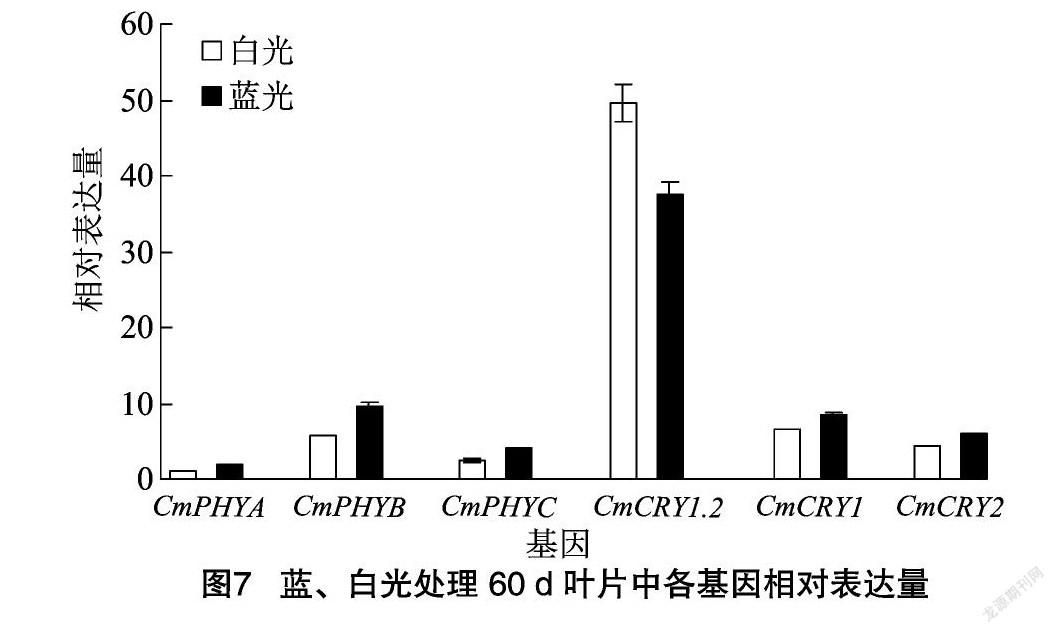
2.5 叶片中色素基因相对表达量及蓝光处理后表达量变化
取蓝、白光处理60 d的组培苗叶片反转录后的cDNA,利用实时荧光定量PCR对光敏色素基因CmPHYA、CmPHYB、CmPHYC,隐花色素基因CmCRY1.2、CmCRY1、CmCRY2的相对表达量进行分析。由图7可知,在叶片中CmCRY1.2的相对表达量最高,CmPHYA的相对表达量最低。经蓝光处理后,除CmCRY1.2的相对表达量降低外,其他基因的相对表达量都有所增加。
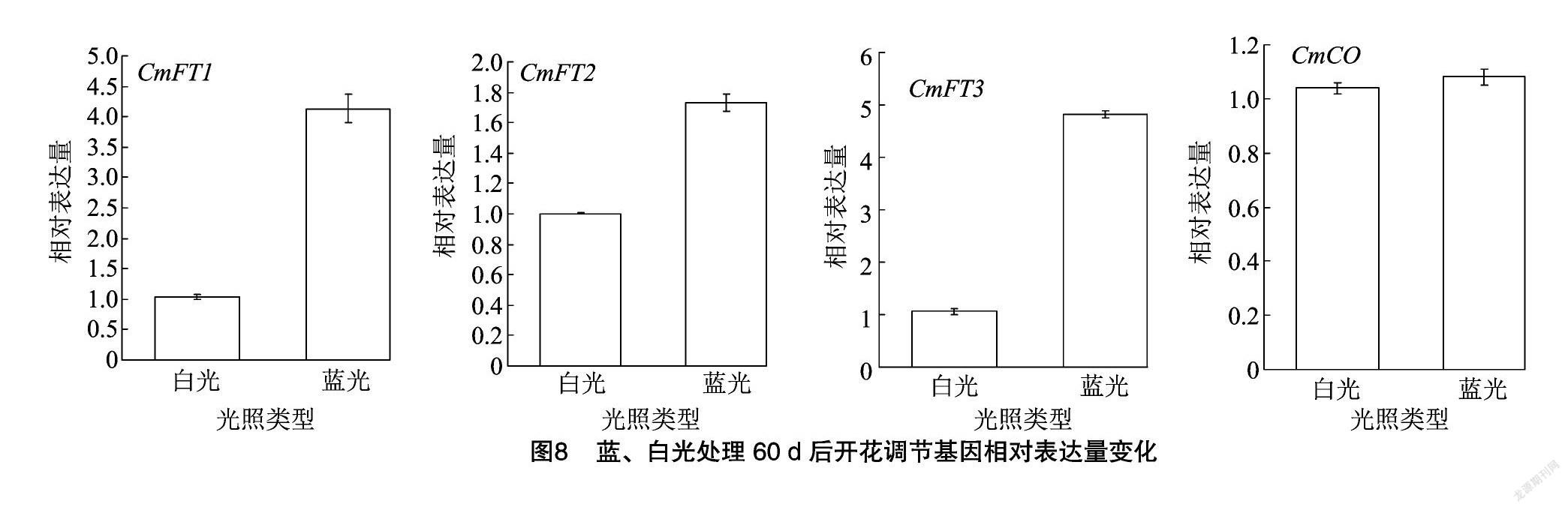
2.6 蓝、白光处理后开花调节基因相对表达量变化
取蓝、白光处理60 d的组培苗叶片反转录后的cDNA,利用实时荧光定量PCR对开花调节基因CmFT1、CmFT2、CmFT3、CmCO的相对表达量进行分析。经蓝光处理后,CmFT1、CmFT3的相对表达量都明显升高,为白光对照组的4倍左右;CmFT2相对表达量也有所升高, 但仅为白光对照组的2倍左右;而CmCO的相对表达量并没有因蓝光处理产生变化(图8)。
3 讨论与结论
不同光质对植物的生长发育会产生不同的影响,众所周知,对于绿色植物,绿色光照最不利于植物的生长,而红光、红蓝光等对大多数植物的生长有促进作用。相对于夏菊,不同光质对秋菊的影响已基本清晰。然而夏菊作为一种对光周期不敏感的特殊品种,其受光质的影响与秋菊是否一致还有待证实。秋菊的报道中显示,蓝光处理后秋菊31-12组培苗表现为植株变高,茎变粗,叶面积变大,生根数变多,根长度变长,叶绿素a、b、a+b含量均升高等[13]。本试验选用夏菊优香作为供试材料,蓝光处理后,夏菊优香表现为植株矮化,茎粗变细,叶片数不变,叶面积变小,生根总数基本不变,根长度变长,叶绿素a含量略微升高等。由此可见,对光周期不敏感的夏菊,其在表型上对不同光质的响应与秋菊是不同的。因此在选择夏菊组培及栽培的光质时,应与秋菊进行区分。另外,有研究表明,叶片中栅栏组织的光合效率较海绵组织更高[14]。本试验在进行石蜡切片制作时发现,蓝光处理后,夏菊叶面积明显变小,但叶平均厚度略微增加且叶片中栅栏组织厚度所占比重显著增加,以上结果可从侧面说明,植物为适应环境变化造成的伤害(叶面积变小),可能通过提高栅栏组织厚度来保证光合效率和保证生命代谢的有序进行。
有试验表明,光敏色素及隐花色素在植物的光信号接受及传递过程中扮演着重要的角色,广泛参与植物各种生长、代谢路径[15-16]。本试验为探究光质对夏菊生长发育的影响,对夏菊优香中光敏色素及隐花色素相关基因的表达量进行分析,除隐花色素CmCRY1.2的表达下降外,其他基因表达量均上升。这一结果显示,光质对植物的影响从光信号接收开始便已存在。
光敏色素基因及隐花色素基因表达量的变化,必然会影响其参与的信号调节路径,如开花路径[17]。对开花调节基因CmCO及开花整合因子CmFT1、CmFT2、CmFT3进行实时荧光定量PCR,发现经蓝光处理后CmCO表达量无明显变化,而CmFT1、CmFT2、CmFT3的表达量均明显升高。这一结果可在分子层面上解释关于秋菊白莲经蓝光照射开花提前的现象[18]。
有报道称,在拟南芥中PHYA能够诱导CO表达,进而通过上调FT促进开花;PHYB通过抑制pFT表达和CO的表达延迟开花[7,19];在小麦中的研究表明,PHYC能够通过诱导PPD1上调FT促進开花[20]。另外,在拟南芥中,隐花色素CRY1、CRY2作为蓝光受体[9],在响应蓝光信号诱导CO表达的同时,也能主动结合CIB 上调FT[19];而隐花色素CRY1.2由于是近年来刚从菊花中克隆得到,对其研究尚在进行,所以该基因的功能尚不明确。本研究中,蓝光照射作为一种光信号,直接导致光敏色素PHYA、PHYB、PHYC及隐花色素CRY1、CRY2的表达上调,有可能导致向光素PHOT、光敏色素PHYD、PHYE等其他感光基因表达量的变化,这些感光基因对CO的影响不同,有的促进,有的抑制,所以最终导致CO的表达量未发生变化的机制还不清楚;而对FT表达量的影响,虽然PHYB抑制FT的表达,但也存在CRY结合CIB1而上调FT的作用,且还有其他感光基因的调控,最终导致FT表达量升高的分子机制还有待进一步研究。
参考文献:
[1]潘才博,张启翔. 日中性菊花及其分子育种前景[J]. 分子植物育种,2010,8(2):350-358.
[2]Poudel P R,Kataoka I,Mochioka R. Effect of red- and blue-light-emitting diodes on growth and morphogenesis of grapes[J]. Plant Cell,Tissue and Organ Culture,2008,92(2):147-153.
[3]任桂萍,王小菁,朱根发. 不同光质的LED对蝴蝶兰组织培养增殖及生根的影响[J]. 植物学报,2016,51(1):81-88.
[4]王春昕. 光对切花菊‘神马’生长和开花的影响[D]. 南京:南京农业大学,2012.
[5]Kim S J,Hahn E J,Heo J W,et al. Effects of LEDs on net photosynthetic rate,growth and leaf stomata of chrysanthemum plantlets in vitro[J]. Scientia Horticulturae,2004,101(1/2):143-151.
[6]Jeong S W,Hogewoning S W,van Ieperen W.Responses of supplemental blue light on flowering and stem extension growth of cut chrysanthemum[J]. Scientia Horticulturae,2014,165:69-74.
[7]Cerdán P D,Chory J.Regulation of flowering time by light quality[J]. Nature,2003,423(6942):881-885.
[8]Mockler T,Yang H Y,Yu X H,et al. Regulation of photoperiodic flowering by Arabidopsis photoreceptors[J]. PNAS,2003,100(4):2140-2145.
[9]Wang Q,Barshop W D,Bian M D,et al. The blue light-dependent phosphorylation of the CCE domain determines the photosensitivity of Arabidopsis CRY2[J]. Molecular Plant,2015,8(4):631-643.
[10]Sun C Q,Chen F D,Teng N J,et al. Factors affecting seed set in the crosses between Dendranthema grandiflorum (Ramat.) Kitamura and its wild species[J]. Euphytica,2010,171(2):181-192.
[11]孙 静. 菊花FT-likes基因开花调控功能研究[D]. 南京:南京农业大学,2014.
[12]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the -ΔΔCT method[J]. Methods,200 5(4):402-408.
[13]张 欢,徐志刚,崔 瑾,等. 不同光谱能量分布对菊花试管苗增殖及生根的影响[J]. 园艺学报,2010,37(10):1629-1636.
[14]强 胜. 植物学[M]. 北京:高等教育出版社,2006:133-135.
[15]Pedmale U V,Huang S S C,Zander M,et al. Cryptochromes interact directly with PIFs to control plant growth in limiting blue light[J]. Cell,2016,164(1/2):233-245.
[16]Sullivan S,Hart J E,Rasch P,et al. Phytochrome a mediates blue-light enhancement of second-positive phototropism in Arabidopsis[J]. Frontiers in Plant Science,2016,7(775):290.
[17]Liu B B,Yang Z H,Gomez A,et al. Signaling mechanisms of plant cryptochromes in Arabidopsis thaliana[J]. Journal of Plant Research,2016,129(2):137-148.
[18]魏胜林,王家保,李春保. 蓝光和红光对菊花生长和开花的影响[J]. 园艺学报,1998,25(2):100-101.
[19]Fornara F,de Montaigu A,Coupland G.SnapShot:control of flowering in Arabidopsis[J]. Cell,2010,141(3):550-550.e2.
[20]Chen A,Li C X,Hu W,et al. PHYTOCHROME C plays a major role in the acceleration of wheat flowering under long-day photoperiod[J]. PNAS,2014,111(28):10037-10044.
