清香型大曲中产香细菌的分离筛选及鉴定
2022-06-23刘小改李洪媛周林艳李博艺王小伟
刘小改,李洪媛,周林艳,袁 媛,李博艺,王小伟,张 坤
(北京红星股份有限公司,北京 101400)
中国白酒特色为制曲酿酒,自古有“曲乃酒之骨”之说[1]。白酒大曲制曲历史悠久,《书经·说命篇》记载:“若作酒醴,尔惟曲蘖”,曲蘖就是我国最早的原始酒曲,可以说是酒曲的起源。大曲综合物系、酶系、菌系于一体,是重要的微生物群落载体[2]。白酒酿造过程中,以曲类、酒母为糖化发酵剂,不同大曲生产工艺不同,所包含的菌系、酶系不同,则酿造生产出的白酒风格各异。清香型大曲包含霉菌、酵母菌、细菌等各类微生物,在白酒酿造过程中起糖化、发酵、生香作用[3-5]。其中霉菌、酵母主要起糖化、发酵作用,细菌主要起产香作用。大曲清香型白酒具备典型果香和花香风味[6-8],具有“清香纯正,醇甜柔和,自然协调,余味爽净”的特点,这些风格特点与清香型大曲中微生物的应用密切相关[9-10]。
目前,对于清香型白酒发酵微生物的研究主要包括功能性微生物分离、应用研究及白酒发酵过程微生物分析研究两个方面[11],如王旭亮等[12]为了提高清香型白酒香气品质,以汾酒发酵酒醅为筛选对象,筛选出了优质酯化菌株;刘桂君等[13]从牛栏山清香大曲及酒醅中分离出23株芽孢杆菌,能够产生酱香物质,但酱香气味不典型;王萌萌等[14]从清香白酒酒醅中分离得到146株高产细菌素乳酸菌,对乳酸菌在酒醅中应用研究具有重要意义;刘雪婷等[15]从清香型白酒发酵酒醅中共分离得到13株乳酸菌,经高通量测序显示,酒醅中优势细菌属为乳酸杆菌属(Lactobacillus)、栖热嗜油菌属(Thermoleophilum)和假单胞菌属(Pseudomonas)。以红星二锅头为代表的麸曲清香型白酒具有清香纯正、甘冽净爽的风格特点,是中国白酒的重要组成部分,但是麸曲白酒存在风味物质组成较少、香味成分含量偏低的缺点,容易导致酒体口感寡淡。基于以上问题,本研究采用稀释平板涂布法从清香型白酒大曲中分离筛选具有产香功能的细菌,通过形态观察及分子生物学技术对其进行菌种鉴定,并将其应用于麸曲白酒酿造,以期在保持红星白酒清香型风格基础上丰富白酒风味物质组成,提升白酒香气,优化基础原酒品质。
1 材料与方法
1.1 材料与试剂
清香型大曲、乙醇(体积分数65%)、麸皮、酒尾:北京红星股份有限公司;蛋白胨、牛肉膏、琼脂粉(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠(分析纯):北京化工厂。
分离培养基及斜面保藏培养基[16]:蛋白胨1%,牛肉膏0.3%,氯化钠0.5%,琼脂粉2%,121 ℃高压蒸汽灭菌20 min。
种子培养基[17]:蛋白胨1%,牛肉膏0.3%,氯化钠0.5%,121 ℃高压蒸汽灭菌20 min。
发酵培养基[18]:葡萄糖1%,麸皮5%,121 ℃高压蒸汽灭菌20 min,接种前加入10%的酒尾。
麸皮培养基[19]:麸皮与水按照质量体积比1∶1混合,搅拌均匀,121 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
PAL RSI 85顶空固相微萃取(headspace solid phase microextraction,HS-SPME)进样装置:瑞士思特斯分析仪器有限公司;7000D三重四级杆气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦科技有限公司;BX51显微镜:奥林巴斯(中国)有限公司;LA230S电子天平:赛多利斯科学仪器有限公司;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司;CJ-2DFS净化工作台:天津市泰斯特仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;DHP-9272电热恒温培养箱:上海一恒科学仪器有限公司;HY60S生物摇床:武汉汇诚生物科技有限公司;JJ6000型电子天平:常熟市双杰测试仪器厂;Q10A电陶炉:广东新功电器有限公司。
1.3 方法
1.3.1 清香型大曲中细菌的分离纯化
清香型大曲块粉碎后,称取大曲粉2 g,加入装有48 mL生理盐水和少量玻璃珠的锥形瓶中,置于摇床振荡30 min,混匀制备成菌悬液,以无菌水对大曲菌悬液做10倍梯度稀释,分别吸取稀释度为10-3、10-4、10-5的稀释液各0.2 mL涂布于分离培养基[20-21],各做3个平行样。培养皿平板倒置于37 ℃培养箱中培养1~2 d,观察其生长情况,将形态不同的单菌落挑出并重新划线接种至分离培养基上,于37 ℃培养1~2 d,经多次分离纯化,直至分离纯化得到细菌单菌落[21],并进行显微镜镜检观察,确认获得不同细胞形态的微生物菌株,转接至斜面保藏培养基,于4 ℃冰箱保藏。
1.3.2 细菌种子液的制备
将分离纯化得到的菌株接种至种子培养基中,37 ℃、150 r/min振荡培养24 h。
1.3.3 产香细菌的筛选
以未接种的空白培养基为空白对照,将种子液以10%(V/V)的接种量接入发酵培养基中,于37 ℃静置培养3 d,每日摇瓶1~2次,培养完成后,按照文献[22]方法由10名具有品酒师资格人员对各菌株发酵液进行香气感官嗅闻评价,比较不同菌株培养液香气风格特征及大小强弱,以初步判断、筛选具有产香能力的细菌菌株,并采用HS-SPMEGC-MS法测定发酵液中的挥发性风味成分[23-25]。
1.3.4 产香细菌在麸曲清香型白酒中的应用
将种子液以10%的接种量接入麸皮培养基中,麸曲料层厚度1 cm,于37 ℃静置培养48 h[18]作为细菌麸曲。将细菌麸曲按照0.5%的添加量应用于麸曲清香型白酒酿造生产,生产工艺参照文献[26],同时以不添加细菌麸曲酿造白酒为对照组。采用HS-SPME-GC-MS法测定白酒中的挥发性风味成分[23-25];由10名具有品酒师资格的人员对各酒样进行感官品评,对比不同实验酒样香气及口感特点,对酒样整体品质做出评价;计算出酒率,其计算公式如下:

1.3.5 菌株的鉴定
形态观察:将筛选得到的产香菌株划线接种于分离培养基中,于37 ℃恒温培养箱中培养1~2 d后,观察菌落形态、色泽、质地等;挑取菌株进行革兰氏染色,采用10×100倍油镜,观察菌体细胞形态特征。
分子生物学鉴定:委托华大基因科技有限公司对筛选得到的菌株的16S rDNA基因序列测序,将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行序列比对,并使用MEGA7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.6 数据处理
试验结果采用Excel2016和SPSS22.0等软件对实验数据进行处理,每个处理组进行5次平行试验,结果用“平均值±标准差”表示。
2 结果与分析
2.1 清香型大曲产香细菌分离及筛选
采用稀释平板涂布法结合显微镜观察,最终从大曲粉菌悬液中分离、纯化获得13株不同菌体形态特征的细菌菌株,分别编号为HXX1~HXX13。以空白培养基为对照,各菌株发酵液香气的感官嗅闻评价结果见表1。
由表1可知,细菌菌株HXX7、HXX10、HXX12发酵液分别具有不同风格、不同程度的令人愉悦的香气,说明这些菌株可能具备合成某些典型香气成分的能力。其中菌株HXX7、HXX12发酵液香气明显,进一步对其挥发性香气成分进行检测分析。
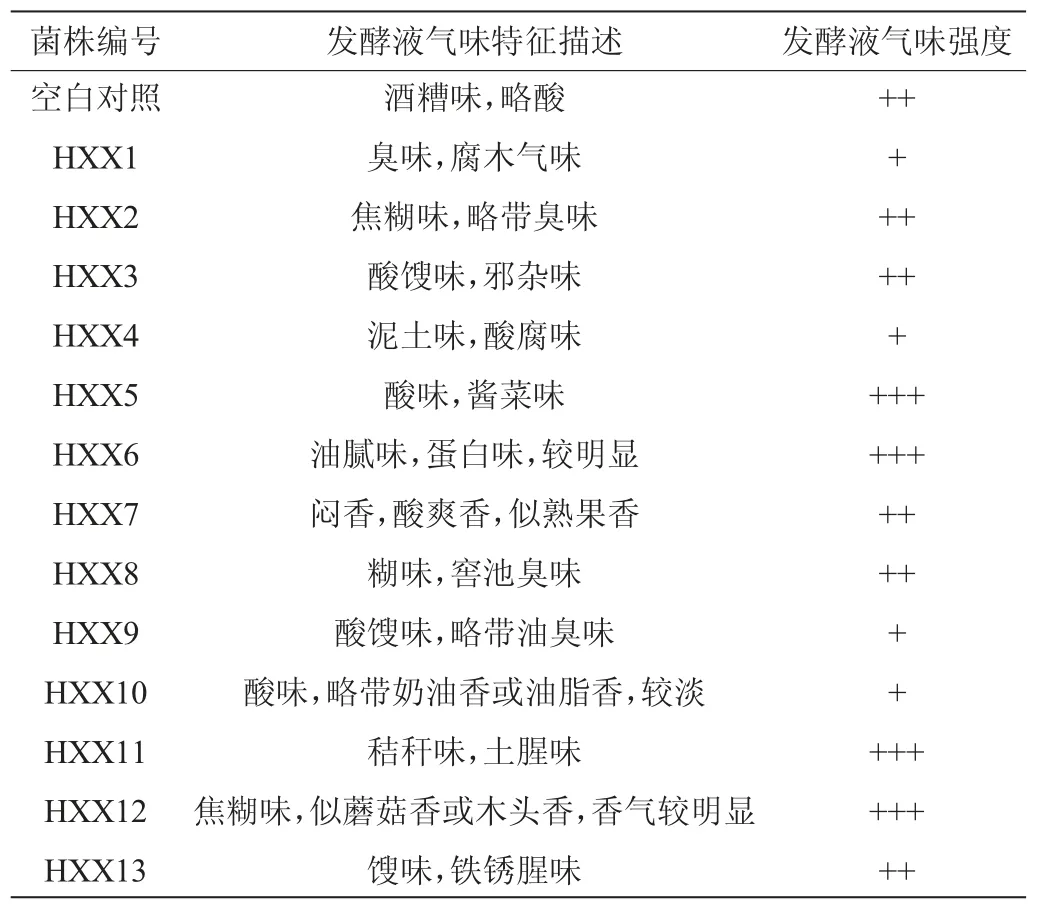
表1 分离菌株发酵液的感官评价结果Table 1 Sensory evaluation results of fermentation broth of isolated strains
2.2 分离菌株产香气成分分析
采用HS-SPME-GC-MS法检测菌株HXX7、HXX12发酵液的挥发性成分,GC-MS分析总离子流色谱图见图1,香气成分定性结果见表2。
图1 菌株HXX7(a)及HXX12(b)发酵液中香气成分GC-MS分析总离子流色谱图Fig. 1 Total ions chromatograms of aroma compounds in fermentation broth of strain HXX7 (a) and HXX12 (b)analyzed by GC-MS
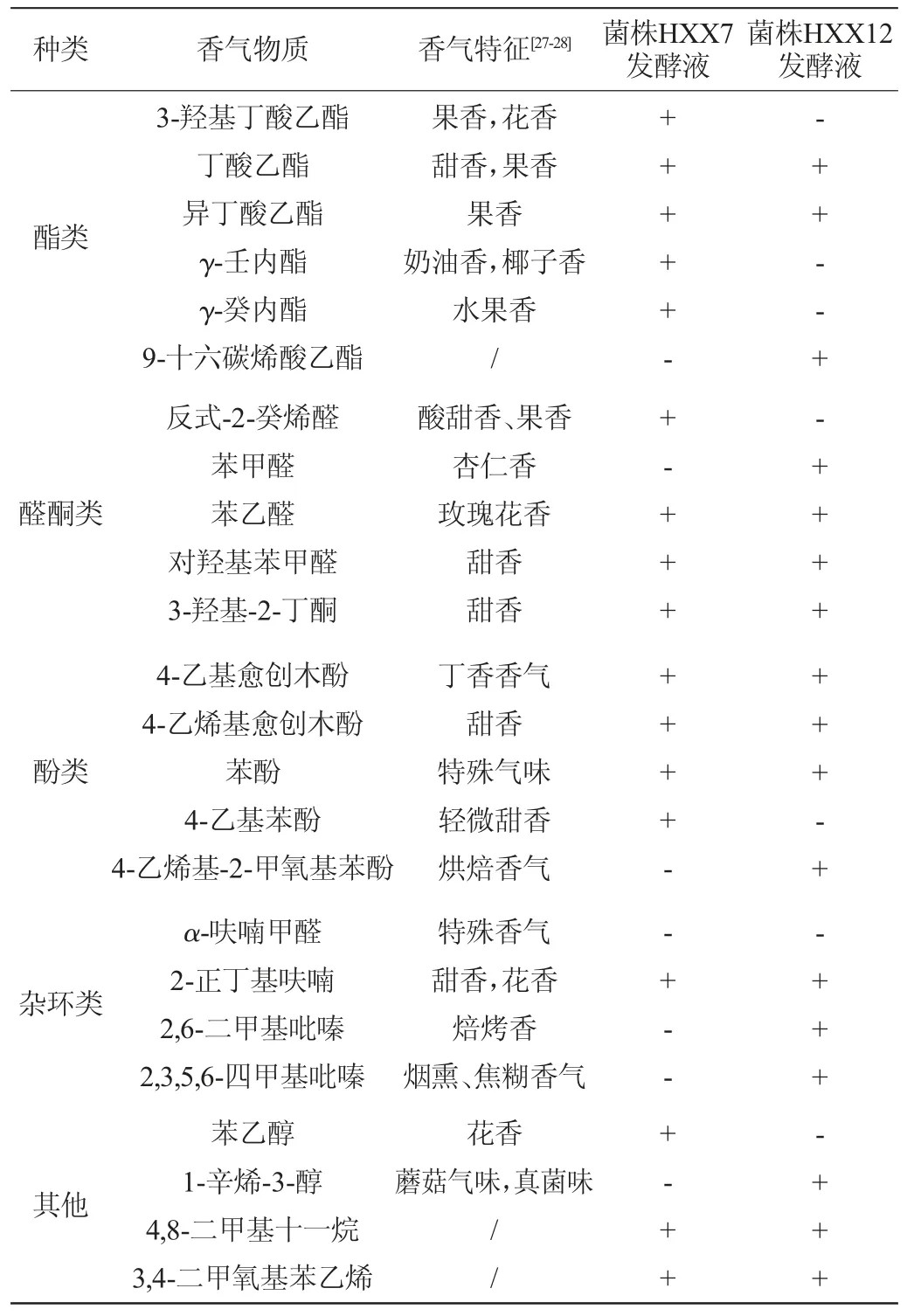
表2 菌株HXX7及HXX12发酵液中主要挥发性香气成分GC-MS分析结果Table 2 Results of main volatile aroma components in fermentation broth of strain HXX7 and HXX12 analyzed by GC-MS
由表2可知,细菌菌株HXX7、HXX12发酵液中挥发性香气成分种类丰富,包含酯类、醛酮类、酚类、杂环类化合物等多种物质。其中,菌株HXX7发酵液中酯类物质种类明显较菌株HXX12丰富,而后者发酵液中杂环类化合物种类较前者丰富。苯乙醛、对羟基苯甲醛、3-羟基-2-丁酮、4-乙基愈创木酚、4-乙烯基愈创木酚、苯酚等物质在两株细菌发酵液中均有检出。
2.3 分离菌株在麸曲清香型白酒中的应用
分别将细菌菌株HXX7、HXX12应用于麸曲白酒酿造生产,同时以不添加细菌麸曲酿造白酒为对照组,采用HS-SPME-GC-MS对所生产酒样成分进行检测分析,结果见表3;计算出酒率,并对酒样进行感官品评,结果见表4。
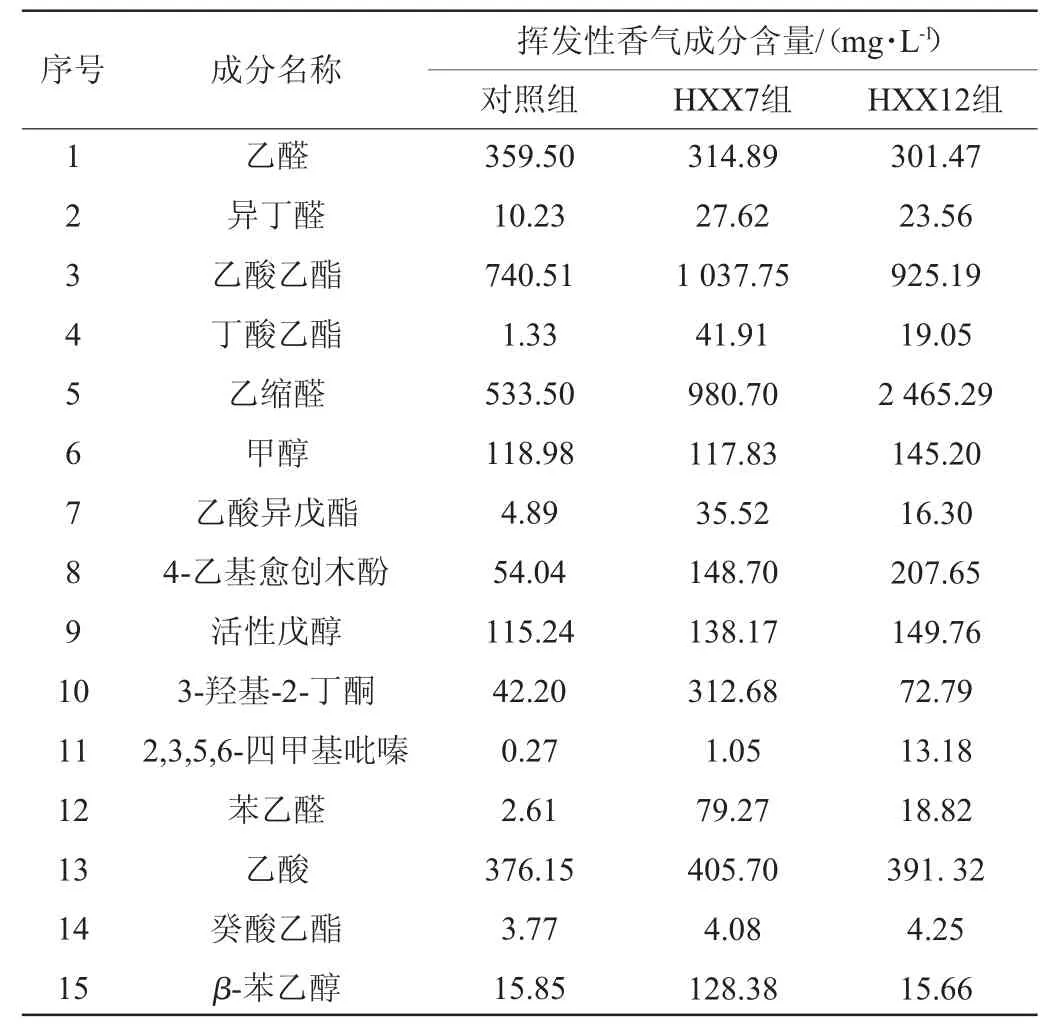
表3 酒样中挥发性香气成分GC-MS分析检测结果Table 3 Determination results of volatile aroma components in Baijiu samples analyzed by GC-MS

表4 酒样出酒率及感官品评结果Table 4 Results of liquor yield and sensory evaluation of Baijiu samples
由表3可知,与对照组酒样相比,HXX7组酒样中异丁醛(27.62 mg/L)、丁酸乙酯(41.91 mg/L)、乙缩醛(980.70 mg/L)、乙酸异戊酯(35.52 mg/L)、4-乙基愈创木酚(148.70 mg/L)、3-羟基-2-丁酮(312.68 mg/L)、苯乙醛(79.27 mg/L)、β-苯乙醇(128.38 mg/L)含量均有明显提升,其中丁酸乙酯、4-乙基愈创木酚、3-羟基-2-丁酮、苯乙醛、β-苯乙醇有助于提升白酒花香、果香、甜香香气;HXX12组酒样中异丁醛(23.56 mg/L)、丁酸乙酯(19.05 mg/L)、乙缩醛(2 465.29 mg/L)、乙酸异戊酯(16.30 mg/L)、4-乙基愈创木酚(207.65 mg/L)、2,3,5,6-四甲基吡嗪(13.18 mg/L)、苯乙醛(18.82 mg/L)含量均有明显提升,其中丁酸乙酯、4-乙基愈创木酚、苯乙醛可提升酒体花香、果香、甜香香气,2,3,5,6-四甲基吡嗪呈焦糊香气,可增加酒体绵厚感。HXX7组酒样与HXX12组酒样中成分含量主要区别在于,前者酯类、3-羟基-2-丁酮、苯乙醛、β-苯乙醇含量较后者丰富,而后者乙缩醛、2,3,5,6-四甲基吡嗪含量较高。
由表4可知,与对照组相比,接种细菌麸曲清香型白酒的出酒率均有所下降,HXX7组出酒率下降1.8%,菌株HXX12组出酒率下降2.7%。出酒率下降原因分析可能是与细菌代谢生成其他物质成分有关[29]。从酒样品尝结果来看,菌株HXX7组酒样与对照组酒样相比,增加了细腻、圆润感,花果香气突出,酒体更为醇厚悠长,具有明显改善麸曲酒品质口感的效果。HXX12组酒样与对照组酒样相比,在香气、酒体绵柔程度方面也有明显提升,但后味带苦,影响了白酒整体口感。
从出酒率及感官品评两方面综合考虑,细菌菌株HXX7具有良好的产香能力,能够有效提升白酒口感品质,具有推广应用价值。
2.4 产香菌株HXX7的鉴定
2.4.1 形态观察结果
细菌菌株HXX7的菌落形态及细胞形态特征见图2。由图2可知,菌株HXX7的菌落为白色,呈圆形,表面有褶皱、干燥,无光泽,菌落边缘整齐;菌体细胞为杆状,经革兰氏染色后菌体呈紫色,为革兰氏阳性细菌。参照《伯杰氏细菌鉴定手册》[30]的细菌形态学指标初步判定该菌株为革兰氏阳性杆状细菌。
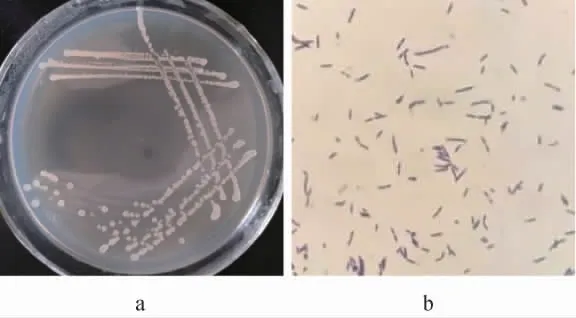
图2 菌株HXX7的菌落(a)及细胞形态(b)Fig. 2 Colony (a) and cell morphology (b) of strain HXX7
2.4.2 分子生物学鉴定结果
基于16S rDNA基因序列菌株HXX7的系统发育树见图3。由图3可知,菌株HXX7与地衣芽孢杆菌(Bacillus licheniformis)NBRC 12200聚于一支,亲缘关系最近,因此,将该菌株鉴定为地衣芽孢杆菌(Bacillus licheniformis)。

图3 基于16S rDNA基因序列菌株HXX7的系统发育树Fig. 3 Phylogenetic tree of strain HXX7 based on 16S rDNA gene sequences
3 结论
本研究从清香型白酒大曲中共分离得到13株细菌,通过感官嗅闻法从中筛选得到2株具有产香能力的菌株,编号分别为HXX7、HXX12;对两菌株发酵液进行GC-MS检测分析,其中均含有酯类、醛酮类、酚类、杂环类化合物等多种香气成分。将菌株HXX7、HXX12应用于麸曲清香型白酒生产酿造,对酒样进行检测并品评发现,菌株HXX7参与发酵的酒样中丁酸乙酯(41.91 mg/L)、4-乙基愈创木酚(148.70 mg/L)、3-羟基-2-丁酮(312.68 mg/L)、苯乙醛(79.27 mg/L)、β-苯乙醇(128.38 mg/L)含量升高,表明菌株HXX7可增加原酒香气,改善原酒风味,从而提升白酒品质。通过形态观察及分子生物学技术鉴定菌株HXX7为地衣芽孢杆菌(Bacillus licheniformis)。
