胸腺瘤切除术后预后因素研究
2022-06-23田文鑫孙耀光于瀚博李东航佟宏峰
马 超 田文鑫 孙耀光 于瀚博 李东航 黄 川 佟宏峰
(北京医院胸外科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730)
胸腺瘤是前纵隔最常见的恶性肿瘤,好发年龄40~60岁,男女发病比率相当。胸腺瘤总体发病率低,2015年美国医疗保险监督、流行病学和最终结果(Surveillance, Epidemiology, and End Results, SEER)数据库统计的胸腺瘤发病率为0.26/10万~0.29/10万[1],中国大陆地区为0.3/10万[2]。胸腺瘤的主要治疗手段为手术切除,文献报道胸腺瘤完整切除5年生存率可达90%以上,许多因素可能影响胸腺瘤患者手术后的远期生存预后[3,4]。本研究回顾性分析2011年1月~2018年12月我科行手术治疗的201例胸腺瘤患者资料,并进行随访,分析影响胸腺瘤远期预后(复发、死亡)的因素。
1 对象与方法
1.1 研究对象
2011年1月~2018年12月在我科行手术治疗的胸腺瘤患者,入组标准:①病理确诊胸腺瘤;②行胸腺切除手术。排除标准:①胸腺癌及胸腺其他类型肿瘤;②仅行肿瘤活检手术;③既往曾行胸腺瘤切除手术,此次因复发手术。
共201例符合入排标准,男106例,女95例。年龄(52.5±14.0)岁。合并重症肌无力(myasthenia gravis,MG)133例。肿瘤直径(4.4±2.2)cm。通过北京医院住院病历系统,收集基本资料、手术及病理信息,录入Excel表,建立数据库。MG的诊断主要依据2015版中国重症肌无力诊断和治疗指南[5]。
本研究经北京医院科学研究伦理委员会批准(2020BJYYEC-010-01),本研究为回顾性病例资料研究,免知情同意书。
1.2 方法
1.2.1 肿瘤直径的确定 选择术前最后一次胸部CT纵隔窗图像测量肿瘤最长径,以cm为单位,精确到0.1 cm。
1.2.2 手术方法及病理诊断 采用胸腔镜或正中劈开胸骨方式完成。手术方式的选择主要依据术前肿瘤特点以及术者操作习惯。手术均切除胸腺肿瘤及全胸腺,为了保证完整切除,可同时切除受侵的心包、肺、血管等邻近组织。
胸腺瘤病理分型依据2015版WHO胸腺瘤病理分型[6]。胸腺瘤分期采用第8版TNM分期系统[7]。所有病理结果均由2名病理医师确认。
肿瘤完整切除的定义:R0切除指完整切除肿瘤,且镜下切缘阴性;R1切除指肉眼肿瘤完整切除,但显微镜下肿瘤切缘阳性;R2切除指肉眼下有肿瘤残留。
1.2.3 术后治疗 术后病理考虑肿瘤侵透包膜及更晚分期者,以及R1、R2切除者,建议术后放疗。分期为Ⅳ期及R2切除者,建议全身化疗。
1.2.4 随访 术后电话和门诊随访。术后前2年每半年复查一次胸部CT,之后每年1次。主要随访内容包括肿瘤复发、患者生存状况,终点事件为患者死亡。复发包括局部复发、区域复发和远处复发,诊断符合国际胸腺肿瘤协作组(International Thymic Malignacy Interest Group, ITMIG)标准[8]。

2 结果
2.1 手术病理及随访结果
120例(59.7%)行胸腔镜手术,其中1例因肿瘤侵犯大血管中转开胸;81例(40.3%)行正中开胸手术。手术时间(123.7±47.2)cm。R0切除195例(97.0%),R1切除6例(3.0%)。病理WHO分型:A型10例(5.0%),AB型41例(20.4%),B1型43例(21.4%),B2型64例(31.8%),B3型12例(6.0%),混合B型26例(12.9%),伴淋巴样间质的微结节型胸腺瘤(MNT)4例(2.0%),不能确定类型1例(0.5%)。TNM分期:Ⅰ期154例(76.6%),Ⅱ期5例(2.5%),ⅢA期33例(16.4%),ⅢB期1例(0.5%),Ⅳ期8例(4.0%)。
术后1个月内死亡1例,死因为重症肌无力危象导致的肺炎。术后并发症13例,其中切口感染2例,出血需二次手术止血2例,心房颤动4例,心肌梗死1例,深静脉血栓3例,乳糜胸1例。
术后101例接受辅助治疗,包括放疗97例,化疗2例,放疗加化疗2例。
本组201例中,失访19例(9.5%),随访182例,随访时间2~104个月,中位数46个月,其中<3年70例(34.8%),3~5年43例(21.4%),>5年69例(34.3%)。复发11例,复发时间11~42个月,中位复发时间24个月。死亡15例,死亡时间2~85个月,中位死亡时间31个月,死因为胸腺瘤复发4例,重症肌无力6例,肺炎2例,直肠癌1例,心肌梗死1例,不详1例。全组5年总生存(overall survival,OS)率90.2%,5年无复发生存(recurrence free survival,RFS)率86.9%,见图1、2。有无死亡、有无复发患者资料比较见表1、2。

表1 胸腺瘤患者术后生存与死亡的资料比较
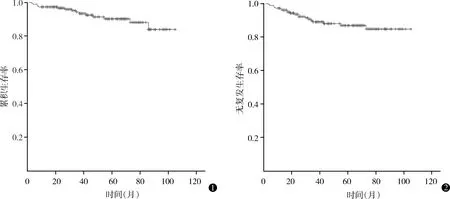
图1 201例胸腺瘤患者生存曲线 图2 201例胸腺瘤患者无复发生存曲线
2.2 胸腺瘤术后生存与复发的预后分析
将年龄、性别、有无MG、是否完整切除、手术方式、TNM分期、肿瘤直径、WHO分型、有无术后辅助治疗等可能影响预后的因素纳入单因素COX回归分析,结果显示,肿瘤直径越大(HR=1.212,95%CI:1.007~1.459,P=0.042)、非R0切除(HR=8.002,95%CI:2.221~28.835,P=0.001)、TNM分期Ⅲ+Ⅳ期(HR=8.225,95%CI:2.809~24.089,P=0.000)与5年总生存差相关;肿瘤直径越大(HR=1.274,95%CI:1.088~1.492,P=0.003)、非R0切除(HR=8.036,95%CI:2.682~24.081,P=0.000)、TNM分期Ⅲ+Ⅳ期(HR=13.632,95%CI:4.945~37.577,P=0.000)与5年无复发生存差相关。见表3、4。
*Fisher精确检验
#除外不能确定类型1例

表2 胸腺瘤患者术后有无复发的资料比较
*Fisher精确检验
#除外不能确定类型1例
将单因素分析P≤0.15的因素纳入多因素Cox回归模型进行分析,结果显示,仅TNM分期Ⅲ+Ⅳ期是胸腺瘤5年总生存(HR=5.956,95%CI:1.656~21.419,P=0.006)以及5年无复发生存(HR=10.381,95%CI:3.150~34.212,P=0.000)的独立预后因素,见表3、4。

表3 胸腺瘤术后5年总生存的单因素及多因素Cox回归分析

表4 胸腺瘤术后5年无复发生存的单因素及多因素Cox回归分析
3 讨论
胸腺瘤是一种相对惰性的肿瘤,恶性程度偏低,最常见的转移途径是区域胸膜腔种植转移,较少出现胸腔外远处转移,远期预后良好。本组5年生存率为90.2%,5年无复发生存率为86.9%,与文献报道相当[9,10]。Margaritora等[3]报道胸腺瘤切除术后10年、20年及30年生存率可达到84.1%、73%及58.6%。
许多因素可能影响胸腺瘤患者手术后的远期预后,其中肿瘤分期是最重要的因素之一。改良Masaoka分期系统是目前应用最广泛的胸腺瘤分期系统,研究证明改良Masaoka分期与胸腺瘤患者的生存预后有明显相关性[3,4,11]。不过,Masaoka分期系统着重于原发肿瘤局部侵犯情况,对局部淋巴结转移的情况不太关注。国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)和ITMIG提出第8版胸腺瘤TNM分期[7],与Masaoka分期系统相比有诸多变化,比如Masaoka分期Ⅱ期被重新分为Ⅰ期,而Ⅲ期和Ⅳ期变化不大[12,13]。新的TNM分期系统可能更能体现胸腺瘤分期与临床治疗及预后的相关性,有助于更好地开展临床研究。本研究采用新版TNM分期系统,Ⅲ、Ⅳ期共42例(20.9%),单因素及多因素Cox回归分析均显示,TNM分期Ⅲ、Ⅳ期是胸腺瘤远期预后差及复发的独立危险因素。
肿瘤是否完整切除亦是影响胸腺瘤远期预后的重要因素[3,4]。Regnard等[14]报道Ⅲ、Ⅳ期胸腺瘤完整切除、次全切除及未手术者5年生存率分别为93%、64%、36%。本研究中胸腺瘤R0切除率为97%(195/201),单因素分析显示非R0切除是胸腺瘤患者远期预后差及复发的危险因素,但是多因素Cox回归分析未见统计学意义。另外,有研究指出WHO分型B型胸腺瘤患者预后差于A型胸腺瘤,但是这方面有争议,似乎WHO病理分型对胸腺瘤预后的预测价值欠佳[15]。合并重症肌无力也可能对胸腺瘤患者的预后产生影响,重症肌无力的存在使患者的临床治疗更加复杂化,术后重症肌无力危象的发生可能增加死亡率;但也有学者指出,MG症状的出现可能有利于胸腺瘤的早期发现,提高手术完整切除率,从而改善预后[11,16,17]。本研究中单因素及多因素Cox回归分析均未显示WHO分型及合并MG是胸腺瘤患者远期预后的影响因素。
综上,胸腺瘤患者手术后远期预后较好,5年生存率可达90.2%。TNM分期是胸腺瘤患者术后5年生存及无复发生存的独立预后因素,本研究中有无重症肌无力及是否R0切除均未对术后远期生存产生显著影响。
