非酒精性脂肪肝病大鼠肠道菌群对肠促胰素效应的影响
2022-06-23王亚涛徐静远史海涛鲁晓岚
王亚涛 程 妍 徐静远 史海涛 王 凯 鲁晓岚,△
(1西安交通大学第二附属医院消化科 西安 710004;2复旦大学附属浦东医院消化科 上海 201399)
随着现代生活水平的提高,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率不断上升[1-2],有成为我国第一大肝病的趋势[3-4],其危害不容忽视。NAFLD 的发病机制复杂,研究发现接受NAFLD 肠道菌群移植的小鼠出现肝脏脂肪含量增加及胰岛素抵抗[5],提示肠道菌群在NAFLD 的发生发展中具有重要作用。
胰高血糖素样肽-1(glucagon-likepeptide1,GLP-1)是L 细胞分泌的一种十分重要的肠促胰岛素,其受体分布广泛,具有改善糖脂代谢紊乱等作用[6]。NAFLD 患者存在血清GLP-1 水平下降[7],但尚不清楚是否因为L 细胞合成分泌减少还是酶降解增加所造成。分泌GLP-1 的L 细胞主要存在于结肠[8],而结肠的细菌数量最多。研究发现,肠道菌群与肠促胰素存在密切关系,双歧杆菌可影响小鼠L细胞数量和GLP-1 分泌[9],降低小鼠肠促胰素效应,但NAFLD 肠道菌群改变能否直接影响肠促胰素效应尚不明确。本实验通过粪菌移植方式探讨NAFLD 大鼠肠道菌群对结肠L 细胞和GLP-1/GLP-1R 的影响,从肠促胰素效应角度研究NAFLD肠道菌群在NAFLD 发生发展中的作用。
材料和方法
主要试剂40 只6 周龄SPF 级雄性SD 大鼠,购自西安交通大学动物实验中心;StoolGen DNA kit试剂盒购自康为世纪生物科技有限公司;SYBR Premix Ex Taq II(Tli RNaseH Plus)购自TAKARA宝生物工程有限公司;大鼠GLP-1 和GLP-1R 酶联免 疫 测 定(enzyme linked immunosorbent assay,ELISA)试剂盒购自南京森贝伽有限公司;PCR 引物由北京奥科鼎盛生物科技有限公司合成;双歧杆菌、大肠埃希菌、肠球菌标准菌购自中国普通微生物菌种保藏管理中心,乳杆菌购自广东省微生物菌种保藏中心。
动物造模及饲养本研究经西安交通大学动物伦理委员会批准,实验起讫时间为2019 年5 月—2020 年5 月。20 只大鼠随机分为2 组,每组10 只,一组喂以高脂饲料(high-fat diet,HFD 组),一组喂以普通饲料(normal diet,ND 组),饲养16 周。另取20只大鼠,喂以混合口服非吸收性抗生素饮用水(庆大霉素100 μg/mL、磺卞青霉素2 500 μg/mL、头孢硫脒2 500 μg/mL、两性霉素B 30 µg/mL)2 周,建立伪肠道无菌大鼠模型,需氧和厌氧培养瓶粪便培养3 天和7 天验证模型是否成功,并随机分为两组,每组10 只。从第15 周末开始每天分别收集HFD 组和ND 组大鼠粪便,0.9%生理盐水(1 g∶5 mL)稀释过滤制备成粪菌液,并在30 min 内采用灌胃法分别移植到伪肠道无菌大鼠体内(2 mL/只),1 天/次,持续1 周,形成移植HFD 肠菌组(Trans HFD 组)和移植ND 肠菌组(Trans ND 组)。移植前3 天停用抗生素,移植前1 天腹腔注射奥美拉唑(9 mg/kg)。移植后继续高脂饲料喂养8 周后,将大鼠隔夜禁食,10%水合氯醛(4 mL/kg)腹腔麻醉,收集空腹血标本,然后50%葡萄糖溶液灌胃(5 mL/只),收集餐后1 h 门脉血、粪便、肝脏、结肠和胰腺组织标本。大鼠饲养于西安交通大学动物实验中心(SPF 级),12 h/12 h光暗循环,温度22 ℃~23 ℃,湿度40%~60%,自由饮水进食。自制高脂饲料:普通饲料50%,猪油10%,蔗糖7.5%,奶粉5%,蛋黄粉2.5%,豆粉15%,高温高压消毒。普通饲料由西安交通大学动物实验中心统一提供。
肝指数测定测量大鼠体质量和肝湿重,计算肝指数=肝质量(g)/体质量(g)×100%。
血生化指标测定空腹血3 000 r/min、4 ℃离心15 min(离心半径8.6 cm)后分离血清,日本岛津全自动生化分析仪检测空腹血糖(fasting plasma glucose,FPG)、甘油三酯(triglyceride,TG)、胆固醇(total cholesterol,TC)水平,免疫放射法测空腹胰岛素(fasting insulin,FINS)水平,计算胰岛素抵抗指 数(homeostasis model assessment of insulin resistance,HOMA-IR):FPG(mmol/L)×FIN(mIU/L)/22.5。
GLP-1/GLP-1R 测 定ELISA 检 测 餐 后1 h 门脉血和结肠组织匀浆GLP-1 水平、肝脏和胰腺组织匀浆GLP-1R 水平。按照ELISA 试剂盒说明说进行操作。
肝脏组织病理学观察取相同部位拇指大小肝组织。HE 染色:10%甲醛液固定,常规脱水,石蜡包埋,切片,HE 染色。油红染色:OCT 包埋后冰冻切片,10%中性甲醛固定,油红O 染色,60%异丙醇分色,苏木精复染,明胶封片。光镜下观察肝脏脂变程度,并从脂变范围、有无炎症病灶、有无气球样变及有无纤维化4 个方面对其进行肝脏活动性(NAFLD activity score,NAS)评分。病理组织评分由一位对实验不知情的病理学医师进行评估。
结肠L 细胞观察免疫组化计数L 细胞。距回盲瓣1 cm 处结肠取1 cm,10%甲醛液固定、包埋、切片、脱蜡、水化、消除内源性过氧化物酶的活性、封闭后,加入兔抗GLP-1 多克隆抗体,4 ℃孵育过夜,再依次滴加生物素化抗兔IgG 抗体、ABC 液,最后二氨基联苯氨显色,苏木精复染,梯度乙醇脱水、二甲苯透明、中性树胶封片。光镜下40 倍镜随机选取10 个不重叠视野计数平均每个视野L 细胞数量。
肠道细菌测定双歧杆菌(Bifidobacterium longumCGMCC1.2186),MRS 培养基+0.05%半胱氨酸盐酸盐,37 ℃厌氧培养,引物序列F:5’-GGGTGGTAATGCCGGATG-3’、R:5’-TAAGCGATGGACTTTCACACC-3’;乳杆菌(Lactobacillus salivariusGDMCC1.986),MRS 培养基,37 ℃厌氧培养,引物序列F:5’-AGCAGTAGGGAATCTTCCA-3’、R:5’-CACCGCTACACATGGAG-3’;大肠埃希菌(Escherichia coliCGMCC1.90),LB 培养基,37 ℃摇床培养,引物序列F:5’-GTTAATACCTTTGCTCATTGA-3’、R:5’-ACCAGGGTATCTAATCCTGTT-3’;肠球菌(Enterococcus faecalisCGMCC1.125),M17 培养基+1% 葡萄糖,37 ℃培养,引物序列F:5’-CCCTTATTGTTAGTTGCCATCATT-3’、R:5’-ACTCGTTGTACTTCCCATTGT-3’。收集培养的标准菌,使用DNA 提取试剂盒提取DNA,紫外分光光度计测定吸光度值(D260)并计算DNA 浓度,并根据每种肠菌基因组大小计算模板数。将标准菌DNA 以无菌TE 稀释10倍,制成标准品并进行荧光定量PCR 反应,制作以Ct 值为纵坐标、以不同稀释模板数的对数为横坐标的标准曲线。粪便基因组提取试剂盒提取大鼠粪便DNA,实时荧光定量PCR 法测定粪便中双歧杆菌、乳杆菌、大肠埃希菌、肠球菌的Ct 值并根据标准曲线计算粪便中各肠菌拷贝数的对数。Takara 荧光定量检测仪检验,Bio-rad IQ5System 分析软件分析数据。
统计学方法采用SPSS 23.0 处理,计量资料采用±s表示。方差齐时,样本均数比较采用独立样本t检验;若方差不齐时,样本均数比较采用t’检验。采用GraphPad Prism 6.0 软件制作柱状图,P<0.05 为差异有统计学意义。
结 果
高脂饮食促进NAFLD 大鼠模型形成,肠道菌群发生改变不同饲料饲养16 周后,HFD 组大鼠体质量明显高于ND 组(P=0.008),肝指数更高(P<0.001),TG、TC、FPG、FINS 水平及HOMAIR 也 明 显 更 高(P=0.002;P=0.002;P=0.004;P<0.001;P=0.002),出现糖脂代谢紊乱(表1)。在光镜下,HFD 组大鼠肝脏可见明显脂肪变性,肝细胞的体积增大,充满大小不一的脂肪空泡,而ND 组大鼠肝小叶结构完整,细胞大小形态菌正常,未见脂肪空泡,无炎症浸润(图1A)。提示NAFLD 造模成功。
表1 HFD 组和ND 组大鼠代谢指标Tab 1 Metabolic indexes of rats in HFD group and ND group (±s)
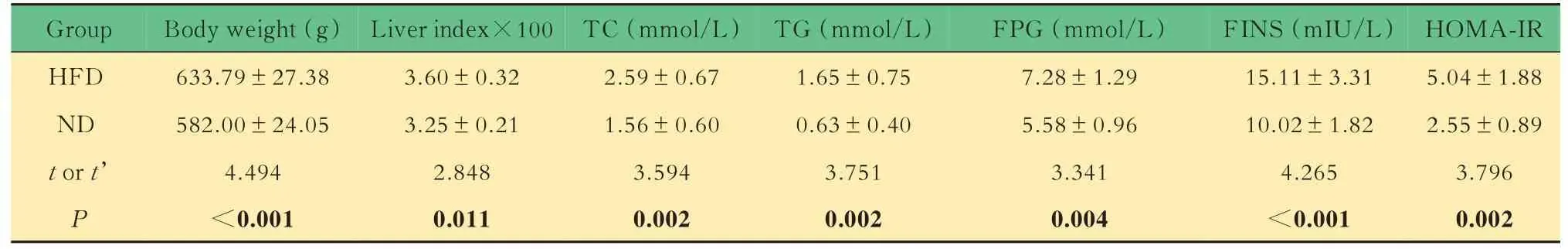
表1 HFD 组和ND 组大鼠代谢指标Tab 1 Metabolic indexes of rats in HFD group and ND group (±s)
TC:Total cholesterol;TG:Triglyceride;FPG:Fasting plasma glucose;FINS:Fasting insulin;HOMA-IR:Homeostasis model assessment of insulin resistance.
Group HFD ND t or t’P Body weight(g)633.79±27.38 582.00±24.05 4.494<0.001 Liver index×100 3.60±0.32 3.25±0.21 2.848 0.011 TC(mmol/L)2.59±0.67 1.56±0.60 3.594 0.002 TG(mmol/L)1.65±0.75 0.63±0.40 3.751 0.002 FPG(mmol/L)7.28±1.29 5.58±0.96 3.341 0.004 FINS(mIU/L)15.11±3.31 10.02±1.82 4.265<0.001 HOMA-IR 5.04±1.88 2.55±0.89 3.796 0.002
利用标准菌构建标准曲线,根据粪便中4 种肠菌的Ct 值,计算出每克粪便中该肠菌拷贝数的对数。结果显示,和ND 组相比,HFD 组大鼠粪便双歧杆菌、乳杆菌含量减少(6.57±0.31vs.7.12±0.23,t=-4.575,P<0.001;7.07±0.32vs. 7.75±0.38,t=-4.302,P<0.001),肠球菌、大肠埃希菌含量增加(7.28±0.36vs. 6.50±0.47,t=4.109,P<0.001;7.77±0.33vs.7.15±0.38,t=3.932,P<0.001),肠道菌群发生了改变(图1B)。

图1 HFD 组和ND 组大鼠肝脏病理及肠菌变化Fig 1 Histopathology of liver and variations of gut microbiotaof rats in HFD group and ND group
移植HFD 组肠道菌群的大鼠脂肪肝更严重,肠促胰素效应减低
体质量、肝指数、血生化指标 和Trans ND 组相比,Trans HFD 组大鼠体质量增加更多(P=0.006),肝 指 数 更 高(P=0.048),TG、TC、FPG、FINS 水 平 及HOMA-IR 都 更 高(P=0.046,P=0.002,P=0.048,P=0.007,P=0.011),表现出更为明显的糖脂代谢紊乱(表2)。
表2 Trans HFD 组和Trans ND 组大鼠代谢相关指标Tab 2 Metabolic indexes of rats in Trans HFD group and Trans ND group (±s)

表2 Trans HFD 组和Trans ND 组大鼠代谢相关指标Tab 2 Metabolic indexes of rats in Trans HFD group and Trans ND group (±s)
TC:Total cholesterol;TG:Triglyceride;FPG:Fasting plasma glucose;FINS:Fasting insulin;HOMA-IR:Homeostasis model assessment of insulin resistance.
Group Trans HFD Trans ND t or t’P Body weight(g)558.61±54.61 491.42±41.10 3.109 0.006 Liver index×100 3.54±0.13 3.41±0.14 2.120 0.048 TC(mmol/L)2.21±0.38 1.86±0.35 2.146 0.046 TG(mmol/L)1.28±0.21 0.96±0.18 3.558 0.002 FPG(mmol/L)6.94±0.52 6.48±0.46 2.117 0.048 FINS(mIU/L)13.68±1.90 11.54±0.92 3.197 0.007 HOMA-IR 4.25±0.90 3.34±0.50?2.827 0.011
肝脏组织病理学 光镜下,Trans HFD 组大鼠肝细胞体积增大,排列明显紊乱,可见明显脂肪变性,充满大小不一的脂肪空泡,炎症细胞浸润明显;Trans ND 组肝细胞排列稍紊乱,可见少量大小不一的脂肪空泡及炎症细胞浸润(图2)。NAS 评分显示Trans HFD 组 大 鼠 为3.8±1.68,比Trans ND 组 的2.5±0.97 得分更高(t=2.112,P=0.049)。
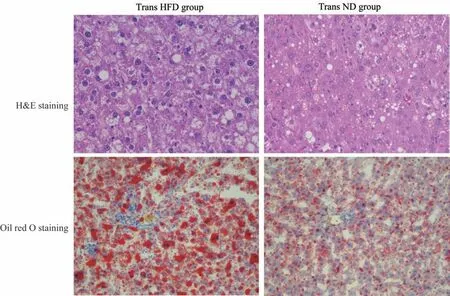
图2 Trans HFD 组和Trans ND 组大鼠肝脏HE 染色(400 倍镜)和油红染色(200 倍镜)Fig 2 Histopathology in liver of rats by H&E staining(400×)and oil red O staining(200×)in Trans HFD group and Trans ND group
肠促胰素效应 在40 倍镜下平均每视野里Trans HFD 组大鼠结肠L 细胞数量较Trans ND 组明显减少(P=0.037)(图3)。和Trans ND 组相比,Trans HFD 组大鼠门脉血和结肠GLP-1 含量更低(P<0.001,P<0.001),提 示Trans HFD 组 大 鼠GLP-1 合成和分泌都减少;同时Trans HFD 组大鼠肝脏和胰腺GLP-1R 含量也较Trans ND 组更低(P<0.001;P<0.001),提 示Trans HFD 组 大 鼠GLP-1 作用于靶器官的能力更低(表3)。

图3 Trans HFD 组和Trans ND 组大鼠结肠L 细胞(200 倍镜)Fig 3 Colonic L cells of rats in Trans HFD group and Trans ND group(200×)
表3 Trans HFD 组和Trans ND 组大鼠肠促胰素效应相关指标Tab 3 The related indexes of incretin effect of rats in Trans HFD group and Trans ND group (±s)
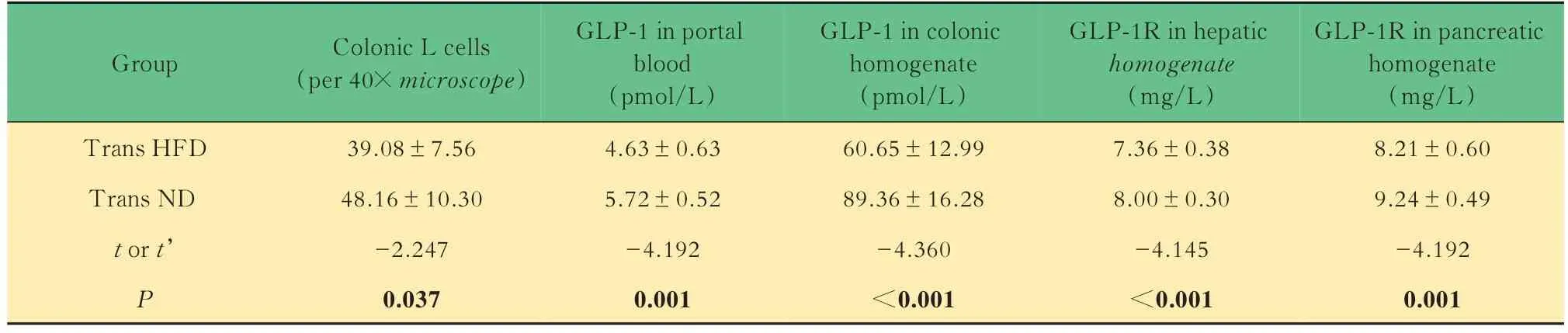
表3 Trans HFD 组和Trans ND 组大鼠肠促胰素效应相关指标Tab 3 The related indexes of incretin effect of rats in Trans HFD group and Trans ND group (±s)
GLP-1/GLP-1R:Glucagon-like peptide 1 and its’receptor.
Group Trans HFD Trans ND t or t’P Colonic L cells(per 40× microscope)39.08±7.56 48.16±10.30-2.247 0.037 GLP-1 in portal blood(pmol/L)4.63±0.63 5.72±0.52-4.192 0.001 GLP-1 in colonic homogenate(pmol/L)60.65±12.99 89.36±16.28-4.360<0.001 GLP-1R in hepatic homogenate(mg/L)7.36±0.38 8.00±0.30-4.145<0.001 GLP-1R in pancreatic homogenate(mg/L)8.21±0.60 9.24±0.49-4.192 0.001
肠道菌群差异 根据标准曲线和粪便中4 种肠菌的Ct 值,计算出每克粪便中该菌拷贝数的对数。结果显示,和Trans ND 组相比,Trans HFD 组大鼠粪便双歧杆菌、乳杆菌含量更低(6.33±0.25vs.6.69±0.30,t=-2.852,P=0.011;6.90±0.17vs.7.39±0.38,t=-3.742,P=0.001),肠球菌、大肠埃希菌含量则更高(7.46±0.10vs.7.04±0.36,t=3.473,P=0.006;7.96±0.20vs.7.58±0.37,t=2.858,P=0.013)(图4),且与HFD 组和ND 组大鼠的差异保持一致。
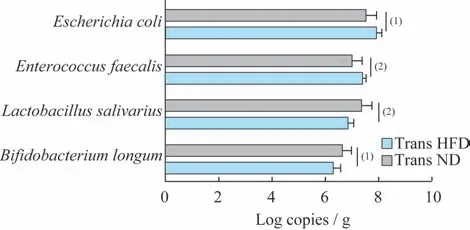
图4 Trans HFD 组和Trans ND 组大鼠粪便肠菌变化Fig 4 Variations of gut microbiota of rats in the Trans HFD group and the Trans ND group
讨 论
NAFLD 发病机制复杂,越来越多的证据支持肠道菌群在NAFLD 发生发展中的关键作用,而肠促胰素效应的减低可能是肠道菌群影响NAFLD 重要机制之一。我们的实验观察到,高脂饮食可以诱导NAFLD 和肠菌改变,分别移植高脂饮食大鼠和正常饮食大鼠的肠菌给两组普通大鼠后,继续给予高脂饮食干预,移植高脂饮食肠菌的大鼠更容易产生肥胖、糖脂代谢紊乱和肝脏脂肪沉积,说明这种代谢的改变可以通过肠道菌群传递,高脂饮食诱导的肠菌改变促进NAFLD 的发生发展。实验还发现高脂饮食诱导的肠菌改变不仅降低了GLP-1 的合成分泌水平,同时还降低了其作用于靶器官的能力,且GLP-1 合成分泌的减少是由L 细胞数量减少引起的。分泌GLP-1 的L 细胞位于结肠,与大量肠菌共存,深受肠道菌群的影响。在本实验中,高脂饮食诱导大鼠粪便双歧杆菌和乳杆菌降低,大肠埃希菌和肠球菌增加,且在移植后这种肠菌差异依然存在,提示这些肠菌的改变可能是影响肠促胰素效应和NAFLD 的重要因素。
双歧杆菌可以通过影响胆汁酸循环及抑制肝脏脂肪合成酶的活性降低血脂,将碳水化合物酵解成短链脂肪酸,促进L 细胞生成及GLP-1 分泌等[9]。乳杆菌可产乳酸盐,增加粪便丁酸含量,并增加肠上皮细胞对丁酸的摄取,促进GLP-1 分泌[10],同时还能促进双歧杆菌生长。已有实验证实,给小鼠喂食乳杆菌能够降低高脂饮食诱导的肝脏脂肪沉积[11-12]。大肠埃希菌过度生长可促进炎症反应,诱导 胰 岛 素 抵 抗 和NAFLD 形 成[13-14]。肠 球 菌 和NAFLD 的关系说法不一,有研究发现和高脂饮食的普通小鼠相比,胃酸缺乏小鼠表现出更为严重的肝脏脂肪变性和粪便肠球菌过度生长[15],提示肠球菌可能参与促进NAFLD 形成,这与本实验的结论一致,尽管在另一些研究中NAFLD 和肠球菌并不存在显著关联[16]。
我们的实验证实了高脂饮食可以诱导肠道菌群发生改变,进而通过减少L 细胞数量,降低GLP-1合成分泌水平和作用于靶器官的能力,导致肠促胰素效应减低,从而促进胰岛素抵抗和NAFLD 的发生发展。研究明确了肠道菌群在NAFLD 发病中的作用和部分机制,为从肠道菌群角度治疗NAFLD提供了一定依据。外源性的益生菌摄入能够修复失调的肠道微生态[17-18],摄入一定量的双歧杆菌和乳杆菌或许能够改善肠促胰素效应和胰岛素抵抗,从而对NAFLD 的治疗有一定的帮助作用。
本研究仍有不足之处:(1)考虑到饮食因素对NAFLD 影响较大,高脂饮食诱导的NAFLD 可在停止高脂饮食后明显缓解[19],我们并未在粪菌移植后设立普通饮食对照组,粪菌移植的实验结论是在继续高脂饮食条件下得到的。(2)本实验和临床期待的干预肠菌后改善NAFLD 的目标相反,主要从促进NAFLD 发病的肠道菌群角度开展,希望通过对发病机制的研究为NAFLD 治疗提供更多思路。
今后我们将进一步在属水平研究关键菌对NAFLD 的治疗作用,以找到更多的关键菌。
作者贡献声明王亚涛 实验设计和研究,论文撰写。程妍 实验设计,结果分析。徐静远,史海涛,王凯 实验资料分析。鲁晓岚 实验指导,论文修改。
利益冲突声明所有作者均声明不存在利益冲突。
