miRNA-18a和miRNA-4802通过自噬抑制淋巴瘤细胞耐药性的机制研究
2022-06-23周仕霞李晓明唐君玲
周仕霞 李晓明 唐君玲


关键词淋巴瘤细胞;耐药性;miRNA-18a;miRNA-4802;自噬;机制
淋巴瘤尤其非霍奇金淋巴瘤是危害人类健康的重大疾病[1]。淋巴瘤患者在临床上常使用环磷酰胺、阿霉素(adriamycin,ADR)、长春新碱(vincristine,VCR)和博来霉素等的联合化疗方案进行治疗;近年来,单克隆抗体靶向药物的发展也大大改善了淋巴瘤患者的临床治疗现状[2-3]。然而,在临床治疗过程中,淋巴瘤细胞的耐药性会严重威胁化疗效果和患者预后[4-6]。所以,阐明淋巴瘤细胞的耐药机制具有重要的临床应用价值。
自噬是细胞在环境压力条件下进行的一种非常重要的细胞代谢机制,呈现高度的进化保守性[7]。相关研究表明,在淋巴瘤中,自噬介导的细胞凋亡是多种化疗药物的重要作用机制[8-10];然而,也有研究表明,自噬可以显著增强淋巴瘤细胞对特定单一化疗药物或多种化疗药物的耐药性[11-14],但其具体分子机制尚不明确。
微小RNA(microRNA,miRNA)是一类非编码小分子RNA,其在基因表达调控领域中起着重要作用。本课题组前期研究发现,miRNA-18a、miRNA-4802 与细胞耐药性之间存在相关性。基于此,本研究以人Burkitt’s 淋巴瘤细胞和人套细胞淋巴瘤细胞为研究对象,使用ADR和VCR 进行处理,再以miRNA-18a、miRNA-4802 以及细胞自噬作为研究切入点,探讨2 个miRNA对淋巴瘤细胞耐药性的影响及调控机制,以期为淋巴瘤耐药性的机制阐明及淋巴瘤治疗药物开发提供参考,同时也为淋巴瘤的临床治疗提供新的潜在靶点。
1 材料
1.1 主要仪器
本研究所用主要仪器有HR40-ⅡA2 型生物安全柜(海尔集团公司),GX53 型倒置荧光显微镜、BX53M型正置荧光显微镜(日本Olympus 公司),SCO6AD-2 型二氧化碳培养箱、Milli-Q 型水纯化系统、ST 40R型低温离心机(美国Thermo Fisher Scientific 公司),TGL-16M型常温离心机、DK 8D型恒温水浴锅(湖南湘仪科教仪器有限公司),TriStar2LB942 型多功能微孔板酶标仪(北京科瑞恩特科技有限公司),12kV HT7800 型透射电镜[柜谷科技发展(上海)有限公司]。
1.2 主要药品与试剂
RPMI-1640 细胞培养基、胎牛血清(批号分别为11875-093、26010066)购于美国Thermo Fisher Scientific公司;细胞增殖检测试剂盒(批号CK04)购于北仁化学科技(北京)有限公司;细胞裂解液、Ad-mCherry-GFP-LC3 腺病毒(批号分别为20200407、CA100008M)均购于上海碧云天生物技术有限公司;兔抗人微管相关蛋白(microtubule-associated protein light chain 3,LC3)单克隆抗体、兔抗人p62 单克隆抗体、兔抗人β-肌动蛋白(β-actin)单克隆抗体(批号分别为14600-1-AP、KHC0058、23660-1-AP)均购于武汉三鹰生物技术有限公司;兔抗人unc-51 样激酶(ULK1)单克隆抗体、兔抗人自噬相关蛋白7(ATG7)单克隆抗体、兔抗人活化型胱天蛋白酶9(cleaved caspase-9)单克隆抗体、兔抗人cleaved caspase-6单克隆抗体(批号分别为A7481、A2856、SAB4503337、SAB4500330)均购于美国Sigma 公司;模拟生物体内源的miRNAs(miRNA mimics,批号AF04-20201004)购于上海生工生物工程有限公司。其余试剂为实验室常用规格,水为超纯水。
1.3 细胞
人Burkitt’s 淋巴瘤细胞Daudi 和人套细胞淋巴瘤细胞JeKo-1 均购于中国科学院典型培养物保藏委员会细胞库。
2 方法
2.1 细胞培养
Daudi 细胞培养于含10%胎牛血清的RPMI-1640 培养基中,JeKo-1 细胞培养于含20% 胎牛血清的RPMI-1640 培养基中。2 种细胞均置于37 ℃、5%CO2、95%湿度的培养箱中进行培养。细胞呈单个悬浮生长。
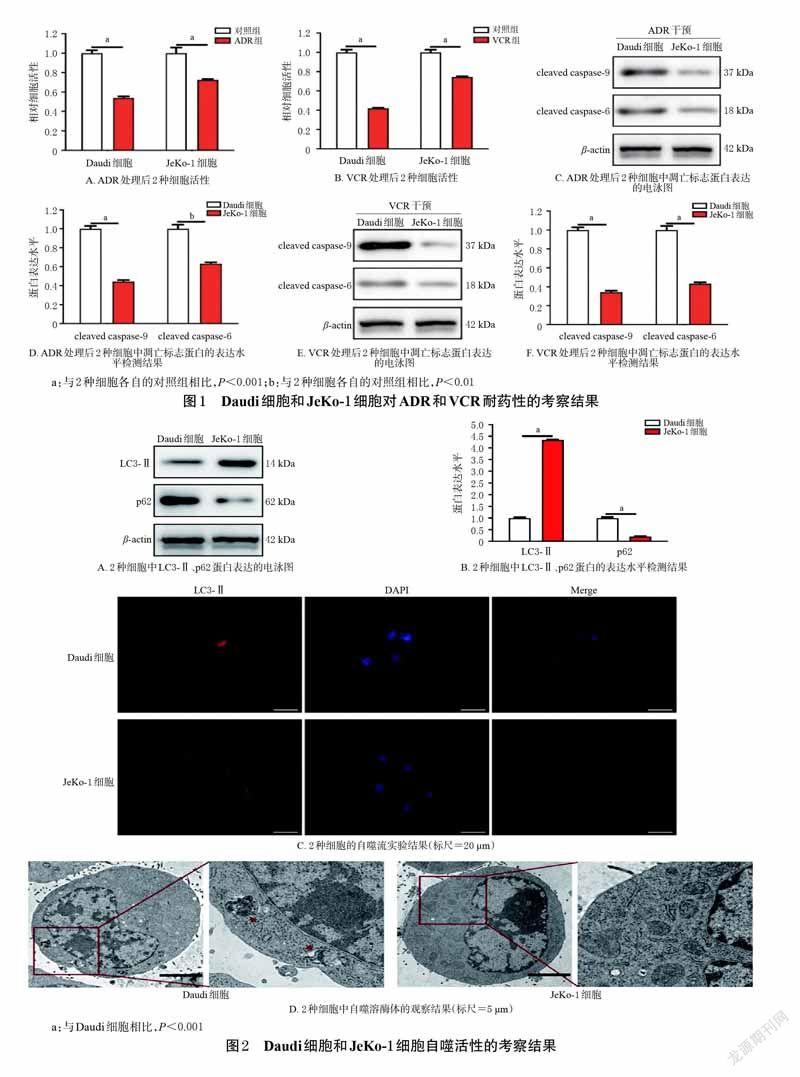
2.2 Daudi 细胞和JeKo-1 细胞对ADR和VCR耐药性的考察将Daudi 细胞和JeKo-1 细胞以2 000 个/孔接种于96孔板中,分别分为对照组、ADR组(1 μg/mL,质量浓度设置参考前期预实验结果)、VCR组(1 μg/mL,质量浓度设置参考前期预实验结果),另设不加细胞只加培养基的空白组,每组设10 个复孔。对照组加入磷酸盐缓冲液100 μL,其余各给药组加入相应药液100 μL,培养72 h后,各组加入CCK-8 试剂10 μL,继续培养1.5 h。采用酶标仪于450 nm波长处检测各组吸光度(OD)值,并计算细胞的相对活性[相对活性=(给药组OD-空白组OD)/(对照组OD-空白组OD)]。
相对活性检测结束后,采用Western blot 法进行2 种凋亡标志蛋白表达水平的检测。取ADR组、VCR组细胞适量,以细胞裂解液提取总蛋白,经变性后,进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳,然后进行封闭、孵育抗体、显影等操作,以检测2 种细胞中cleavedcaspase-9 和cleaved caspase-6 的表达水平(以β-actin 蛋白为内参)。
2.3 Daudi細胞和JeKo-1细胞自噬活性的考察
2.3.1 2 种自噬相关蛋白表达水平检测取Daudi 细胞和JeKo-1 细胞适量,以细胞裂解液提取总蛋白,按“2.2”
项下Western blot 法操作,检测2 种细胞中LC3-Ⅱ、p62蛋白的表达水平(以β-actin蛋白为内参)。
2.3.2 自噬流实验取Daudi 细胞和JeKo-1 细胞适量,接种于装有细胞爬片(已经多聚赖氨酸处理)的24 孔板内,待细胞融合度为60%~70%时,将培养基换成不含双抗的完全培养基,并根据预实验确定的最佳感染复数值加入适量Ad-mCherry-GFP-LC3腺病毒溶液,感染48 h后,取出细胞爬片,并以磷酸盐缓冲液清洗3 次;于载玻片上滴加适量防荧光猝灭剂,并将细胞爬片(有细胞的一面)覆于其之上,再采用荧光显微镜观察LC3-Ⅱ蛋白的分布和形态。
2.3.3 透射电镜观察取Daudi 细胞和JeKo-1 细胞适量,经消化、离心后收集细胞,以2.5%戊二醛溶液固定24 h,再以1%锇酸溶液固定3 h 后,于4 ℃条件下进行梯度脱水、包埋、固化、切片(厚度为70 nm);将切片以3%醋酸铀-枸橼酸铅溶液染色6 h 后,采用透射电镜观察2种细胞中的自噬溶酶体并计数。
2.4 Daudi 细胞和JeKo-1 细胞中miRNA-18a、miRNA-4802和ULK1、ATG7的表达差异考察
取Daudi 细胞和JeKo-1 细胞适量,使用试剂盒提取2种细胞的总RNA,再分别使用相应试剂盒进行miRNA-18a 和miRNA-4802、ULK1 和ATG7 的逆转录,合成相应cDNA;再以cDNA为模板,进行荧光定量聚合酶链式反应(qRT-PCR),具体引物序列见表1。PCR反应体系(共10 μL):TB Green® Premix Ex TaqTM Ⅱ 5 μL,上下游引物各0.4 μL,cDNA模板1 μL,水3.2 μL。反应条件:95 ℃预变性5 min;95 ℃变性15 s,58 ℃退火30 s,72 ℃延伸60 s,循环39 次。采用2-ΔΔCt法计算miRNA-18a、miRNA-4802 和ULK1、Atg7 mRNA的表達水平。另外,取Daudi细胞和JeKo-1 细胞适量,以细胞裂解液提取总蛋白,按“2.2”项下Western blot 法操作,检测2 种细胞中ULK1、ATG7蛋白的表达水平(以β-actin蛋白为内参)。
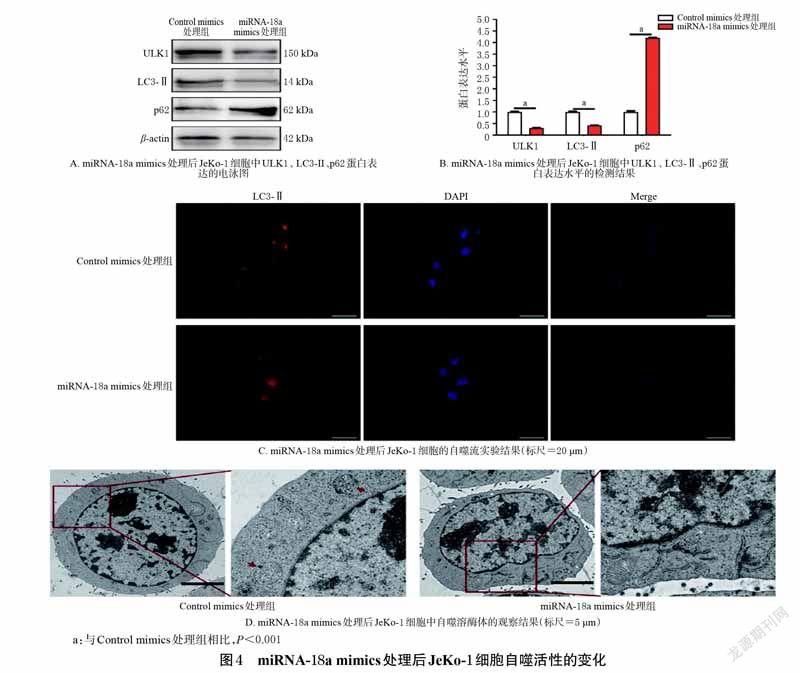
2.5 JeKo-1 细胞经miRNA-18a mimics 处理后自噬活性的变化考察
将JeKo-1细胞分为Control mimics处理组和miRNA-18a mimics 处理组,miRNA-18a mimics 处理组细胞加入miRNA-18a mimics 适量进行转染(Control mimics 处理组不作任何处理)。然后取2 组细胞适量,分别进行Western blot 实验(以检测各组细胞中ULK1、LC3-Ⅱ、p62 蛋白的表达水平)、自噬流实验(以检测各组细胞中LC3-Ⅱ蛋白的分布和形态)、透射电镜观察(以检测各组细胞中自噬溶酶体的数量)。
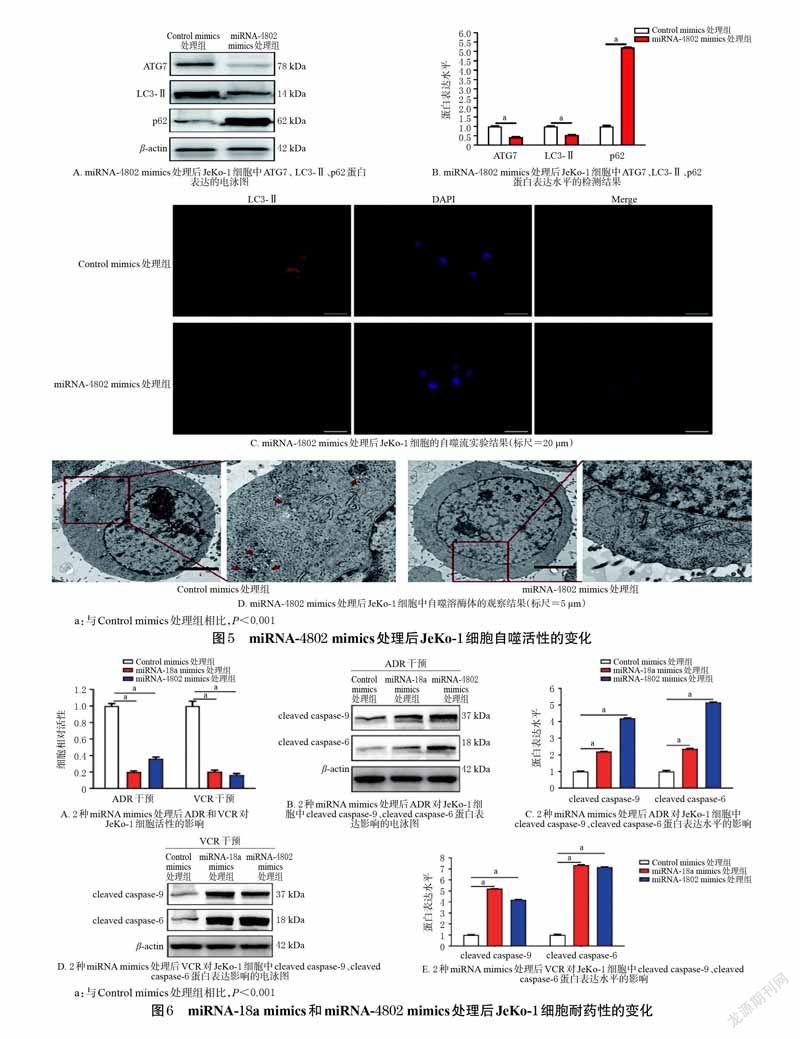
2.6 JeKo-1 细胞经miRNA-4802 mimics 处理后自噬活性的变化考察将JeKo-1细胞分为Control mimics处理组和miRNA-4802 mimics 处理组,同“2.5”项下方法处理并进行相应实验(其中Western blot 实验中检测ATG7、LC3-Ⅱ、p62蛋白的表达水平)。
2.7 JeKo-1 细胞经miRNA-18a mimics 和miRNA-4802mimics处理后耐药性的变化考察取JeKo-1 细胞适量,以ADR(1 μg/mL)干预后,分为Control mimics 处理组、miRNA-18a mimics 处理组、miRNA-4802 mimics 处理组。另取JeKo-1 细胞适量,以VCR(1 μg/mL)干预后,同样分为上述3 组。各组细胞按“2.5”项下方法处理后,再按“2.2”项下方法检测细胞相对活性和凋亡标志蛋白cleaved caspase-9、cleaved caspase-6 的表达水平。
2.8 统计学方法采用SPSS 19.0 统计软件进行分析,数据以x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 Daudi 细胞和JeKo-1 细胞对ADR和VCR的耐药性考察结果
经ADR处理后,Daudi 细胞和JeKo-1 细胞的相对活性与其各自的对照组相比分别降低至51%和70%(P<0.001);经VCR处理后,Daudi 细胞和JeKo-1 细胞的相对活性分别降低至41%和72%(P<0.001)。Western blot实验结果显示,经ADR、VCR处理后,Daudi 细胞中凋亡标志蛋白cleaved caspase-9、cleaved caspase-6 的表达水平均显著高于JeKo-1 细胞(P<0.01 或P<0.001)。结果见图1。这表明,与Daudi 细胞相比,JeKo-1 细胞对ADR和VCR具有更强的耐药性。
3.2 Daudi细胞和JeKo-1细胞自噬活性的考察结果Western blot 实验结果显示,与Daudi 细胞相比,JeKo-1 细胞中LC3-Ⅱ蛋白的表达水平显著升高,p62 蛋白的表达水平显著降低(P<0.001)。自噬流实验结果显示,JeKo-1 细胞中LC3-Ⅱ蛋白的荧光斑块明显,自噬活性较强;Daudi 细胞中LC3-Ⅱ蛋白荧光斑块不明显,自噬活性较弱。透射电镜观察结果显示,与Daudi 细胞[自噬溶酶体数量为(0.2±0.1)个]相比,JeKo-1细胞中自噬溶酶体数量[(2.4±0.1)个]显著增多(P<0.01)。结果见图2。这表明,JeKo-1细胞的自噬活性显著高于Daudi细胞。
3.3 Daudi 细胞和JeKo-1 细胞中miRNA-18a、miRNA-4802和ULK1、ATG7的表达差异考察结果qRT-PCR 实验结果显示,Daudi 细胞中miRNA-18a和miRNA-4802 的表达水平均显著高于JeKo-1 细胞,JeKo-1 细胞中ULK1、ATG7 mRNA 的表达水平均显著高于Daudi 细胞(P<0.001)。Western blot 实验结果显示,JeKo-1 细胞中ULK1、ATG7 蛋白的表达水平均显著高于Daudi 细胞(P<0.001)。结果见图3。这提示miRNA-18a、miRNA-4802 可能对自噬启动基因ULK1、ATG7 起负调控作用。
3.4 miRNA-18a mimics 处理JeKo-1 细胞后自噬活性的变化Western blot 实验结果显示,与Control mimics 处理组相比,miRNA-18a mimics 处理组JeKo-1 细胞中ULK1、LC3-Ⅱ蛋白表达水平均显著降低,p62 蛋白表达水平显著升高(P<0.001)。自噬流实验结果显示,与Control mimics 处理组相比,miRNA-18a mimics 处理组JeKo-1 细胞中无明显LC3-Ⅱ蛋白荧光斑块。透射电镜观察结果显示,与Control mimics 处理组[自噬溶酶体数量为(2.9 ± 0.1)个] 相比,miRNA-18a mimics 处理组JeKo-1 细胞中自噬溶酶体数量[(0.2±0.1)个]显著减少(P<0.01)。结果见图4。这表明,经miRNA-18a mimics处理后,JeKo-1 细胞的自噬活性降低。
3.5 miRNA-4802 mimics 处理JeKo-1 细胞后自噬活性的变化Western blot 实验结果显示,与Control mimics 处理组相比,miRNA-4802 mimics 处理组JeKo-1 细胞中ATG7、LC3-Ⅱ蛋白表达水平显著降低,p62 蛋白表达水平显著升高(P<0.001)。自噬流实验结果显示,与Controlmimics 处理组相比,miRNA-4802 mimics 处理组JeKo-1 细胞中无明显LC3-Ⅱ蛋白荧光斑块。透射电镜观察结果显示,与Control mimics处理组[自噬溶酶体数量为(3.6±0.1)个]相比,miRNA-4802 mimics处理组JeKo-1细胞自噬溶酶体数量[(0.3 ± 0.1)个] 显著减少(P<0.01)。结果见图5。這表明,经miRNA-4802 mimics 处理后,JeKo-1 细胞的自噬活性降低。
3.6 JeKo-1 细胞经miRNA-18a mimics 和miRNA-4802mimics处理后耐药性的变化细胞相对活性实验结果显示,使用miRNA-18amimics 和miRNA-4802 mimics 处理后,JeKo-1 细胞对ADR、VCR 的耐药性均显著降低(P<0.001)。Westernblot 实验结果显示,经miRNA-18a mimics 和miRNA-4802 mimics 处理后,ADR、VCR均可显著升高JeKo-1 细胞中cleaved caspase-9、cleaved caspase-6 的表达水平(P<0.001)。结果见图6。这表明,miRNA-18a mimics和miRNA-4802 mimics 很可能通过抑制淋巴瘤细胞的自噬活性来抑制其对ADR和VCR的耐药性。
4 讨论
淋巴瘤细胞的耐药性一直是淋巴瘤基础研究和临床诊疗的重要关注点[15]。淋巴瘤细胞的耐药性是指淋巴瘤细胞通过多种途径实现减少或者阻止化疗药物的杀伤力,从而实现促进自身生存的目的。一般情况下,淋巴瘤细胞常通过以下途径实现耐药性:减少化疗药物进入细胞内;增加化疗药物排出细胞外;改变细胞代谢途径;增强化疗药物致DNA损伤的修复;抑制化疗药物引起的细胞凋亡[16-18]。相关研究发现,上述多种途径均有细胞自噬过程的参与,尤其在增强DNA修复和抑制细胞凋亡过程中,自噬发挥着重要作用[19-22]。
自噬在细胞内受多种途径的分子调控,其核心调控机制主要包括雷帕霉素信号通路和腺苷酸活化蛋白激酶通路[23 - 25]。值得注意的是,某些非编码RNA,如miRNA 已被证实广泛参与细胞自噬的调节过程[26-27]。
基于此,本研究聚焦miRNA 对淋巴瘤细胞自噬的调控过程。自噬小体的触发和延展是成熟的分子调控过程,该过程中涉及3 个关键的自噬小体起始蛋白复合物,其中ULK1 基因编码的蛋白质与ATG13 蛋白、200 kDa 的黏着斑激酶家族相互作用蛋白(focal adhesion kinasefamily interacting protein of 200 kDa,FIP200)形成的蛋白复合物则是其中之一[28-29]。ULK1 不仅是自噬小体起始蛋白复合物的关键组成部分,还对Beclin1、ATG14L和VPS34 复合物等自噬关键起始因子具有磷酸化作用,也对自噬小体的顺利延展起到不可替代的作用[30]。相关研究发现,自噬的激活和自噬小体的延展需要依靠细胞内多种自噬相关蛋白参与的类泛素化调控系统,其中,ATG7 蛋白可以发挥类泛素化激活酶E1 的作用,与ATG12 蛋白结合后转运至ATG5 蛋白;另外,ATG10 蛋白可以发挥类泛素化结合酶E2 的作用,促进ATG12-ATG5 蛋白复合物的形成,进而发挥类泛素化连接酶E3 的作用,最终完成ATG8 蛋白的酯化作用,形成ATG8-PE 蛋白复合物。ATG8-PE 蛋白复合物对招募自噬小体延展成分和自噬底物具有重要作用[31-32]。由此可见,ULK1 和ATG7 基因均为自噬进程的关键调控因子,其表达水平与细胞自噬活性直接相关。
本研究以人Burkitt’s 淋巴瘤细胞Daudi 和人套细胞淋巴瘤细胞JeKo-1 为研究对象,从ADR和VCR这2 种具有代表性的化疗药物入手,探索上述2 种细胞的耐药性。经ADR和VCR处理后,与Daudi 细胞相比,JeKo-1细胞活性更高、凋亡水平更低。JeKo-1 细胞比Daudi 细胞具有更强的自噬活性,并且JeKo-1 细胞中miRNA-18a和miRNA-4802 的表达水平更低,ULK1、Atg7 mRNA表达水平更高;进一步使用miRNA-18a mimics 和miRNA-4802 mimics 处理JeKo-1 细胞后发现,细胞自噬水平受到显著抑制,且对ADR和VCR的耐药性显著降低。由此推测,miRNA-18a 和miRNA-4802 很可能是通过靶向负调控ULK1、ATG7 mRNA的表达水平,进而抑制淋巴瘤细胞的自噬和耐药性。
综上所述,miRNA-18a 和miRNA-4802 分别通过降低自噬启动基因ULK1 和Atg7 的表达,抑制淋巴瘤细胞的自噬活性,从而降低淋巴瘤细胞对ADR和VCR的耐药性。
