药品管理准入协议应用的国际经验及对我国的启示
2022-06-23王颖香陈磊徐怀伏
王颖香 陈磊 徐怀伏


关键词药品管理;管理准入协议;创新支付协议;可及性;可负担性
随着新药上市速度的不断加快以及医保目录动态调整机制的建立,我国药品医保准入周期缩短,但是某些药品的高值性和疗效不确定性使得医保基金压力陡然增加[1]。在2020 年全国两会上,医药卫生界代表委员提出可以在我国应用国际药品管理准入协议(ManagedEntry Agreement,MEA),以平衡医保控费和国产创新药发展[2]。药品MEA又称为药品创新支付协议、药品风险分担协议等,是医保支付方与药品生产企业间签订的、通过附加具体的准入条件使药品获得支付方报销的协议。药品MEA使医保支付方和药企共同承担财政或治疗的不确定性风险,并通过相应的准入条件进一步解决药品的不确定性,来达到优化使用或限制预算的目的[3]。本文拟探究国际及我国药品MEA的应用现状,分析我国药品MEA应用中存在的问题并提出建议,旨在助力药品医保准入、提高药品可及性和可负担性。
1 国际药品MEA应用现状
1.1 国际药品MEA应用现状概述
由于英国、澳大利亚和意大利应用药品MEA经验较丰富且运作管理机制完善,所以后文重点以这3 个国家为例具体阐述国际药品MEA 的应用现状。英国自2002 年引入药品MEA后,逐步实现了从最初的单一类型协议到后期协议类型多元化。英国多年应用药品MEA的效果表明,MEA确实增加了创新药品的可及性和可负担性[4]。澳大利亚应用药品MEA的时间较早,且运作管理机制较为完善。药品MEA在澳大利亚的应用经验表明,MEA在降低药价、控制药费支出、提高药品可及性等方面具有重大作用[5]。2006 年意大利针对高值药品应用MEA,有效提高了重(特)大疾病患者的药品可及性和可负担性,同时降低了政府的财政负担[6]。
1.2 国际药品MEA纳入药品的范畴
意大利药品管理局把符合以下标准的药品纳入MEA的范畴:(1)治疗严重、危及生命的疾病所需要的药品;(2)用药需求尚未得到满足的药品;(3)费用高、对医保预算影响较大的药品;(4)政策支持或患者急需的药品;(5)治疗效果客观、可衡量的药品;(6)预期风险及收益存在不确定性的创新治疗方法相关的药品[7]。澳大利亚在界定协议药品范畴时主要考虑以下2 点:(1)该药品临床需求大;(2)随着临床证据的增多,该药品的临床结果或价值的不确定性问题可以得到解决[8]。澳大利亚协议药品最常见的为抗肿瘤药品和免疫调节剂[5]。
1.3 国际药品MEA的常见类型及举例
一般来说,药品MEA 可以分为基于财务的协议(finance-based agreements,FBA)、基于績效的协议(performance-based agreements,PBA)和基于服务的协议(service-based agreements,SBA)。FBA 主要用于控制支付方的总体预算、解决药品的可负担性,通常不涉及药品所带来的治疗效果与健康产出;PBA重点关注药品带来的健康产出或治疗效果,且直接与药品的报销水平挂钩;SBA通常是在FBA、PBA之后应用的,通过提供医疗服务来优化药品的健康产出和降低药品疗效的不确定性[3]。FBA和PBA的具体分类及定义详见表1。
1.3.1 国际常见FBA举例国际上常见的FBA以量价协议为主。澳大利亚规定,药品销售额超过协议的规定数额时,药企要向卫生部退还一定比例的费用。例如有协议规定,当药品年销售额超过2 000 万澳元时,药企需要退还药费的30%[9]。英国规定,药企的目标销售利润为6%,上限为目标销售利润的150%;一旦药企的销售利润率超过了上限,就需要降低1 种或者几种药品的价格,或者选择保持现有价格,但要将超额利润退还给卫生部[10]。
1.3.2 国际常见PBA举例强生制药与英国国家医疗服务体系(National Health Service,NHS)针对治疗复发性多发性骨髓瘤的药品硼替佐米(万珂®)签订了一项P4P。协议约定,最多4 个疗程后,如果患者血清中M蛋白降低少于50%,则药企全额退款[4]。澳大利亚针对治疗肺动脉高压的药品波生坦片(全可利®)签订了一项为期3 年的CED。协议约定,支付方在协议期内给予报销,药企在期限内开展持续研究进行证据收集;协议到期时,如果患者的病死率高于签订协议时约定的病死率,双方将确定新的报销决策,即药企调低药品的价格[11]。2007 年意大利药品管理局与多个药企针对治疗阿尔茨海默病的药物签订了CTC。协议约定,治疗的前3 个月药企免费提供药品并对患者进行短期效果评估;若3 个月后达到治疗目标,则该治疗将最长持续2 年,并由国家健康服务机构报销[12]。
1.3.3 国际常见SBA举例SBA通常作为FBA 和PBA的补充,一般针对慢性病,旨在改善和促进患者管理。例如诺华制药对慢性阻塞性肺疾病等慢性疾病建立的综合健康管理平台旨在通过跟踪患者,对其提供营养、健康、运动、锻炼和咨询服务,以降低患者的住院率并提高患者的依从性。各国对于SBA的应用目前较少,但是有专家认为SBA是有效且可操作的,能够为利益相关者带来即时价值,有快速发展的趋势[3]。
2 我国药品MEA应用现状
2.1 我国药品MEA的数据检索方式及应用现状概述
近年来,我国逐渐引入了药品MEA,但尚未普及。本文以“管理准入协议”“药品创新支付”“创新支付协议”等为主题,分别在中国知网、万方、维普、Google 及百度进行检索,在相关文献和报道中追溯有用信息后,检索得出4 个我国在药品MEA领域较为先进的平台,分别为“镁信健康”“诺惠医疗”“健易宝”“水滴好药付”。笔者以上述4 个平台为着手点,分别在其官网及公众号进行检索,提取协议药品、治疗领域、药品生产企业、协议内容等相关信息,并对信息进行筛选整理,从而建立我国常见的药品MEA数据库;并通过检索太平洋保险、华泰保险、长安保险、中国人寿保险等保险公司官网,对数据库进行补充。截至2021 年11 月,笔者共收集到54 条药品MEA,涉及14个治疗领域、28家药企。
2.2 我国药品MEA涉及药品的治疗领域
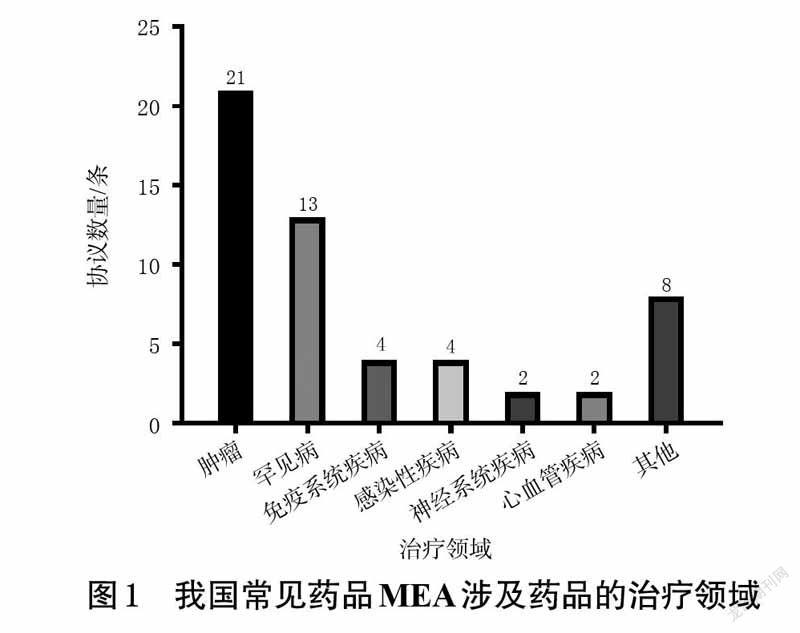
参照《国际疾病分类第十一次修订本(ICD-11)》和我国《罕见病药品目录》对药品MEA涉及药品的治疗领域进行分析后发现,我国常见的药品MEA共涉及14 个治疗领域,包括肿瘤、罕见病、免疫系统疾病等。其中,肿瘤治疗领域的药品MEA数量最多,有21 条,占比为39%;其次为罕见病治疗领域,有13 条,占比为24%。我国常见药品MEA涉及药品的治疗领域见图1。
2.3 我国药品MEA常见类型及举例
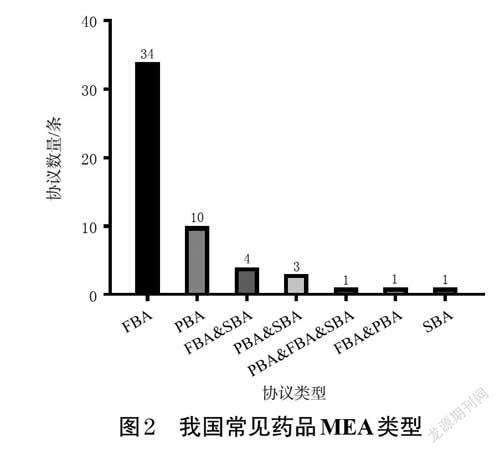
本文共收集到54 条药品MEA。其中34 条为FBA,占比高达63%;10 条为PBA,占比为18%;1 条为SBA,占比为2%;另外9 条药品MEA以FBA、PBA、SBA组合的形式呈现。我国现有的PBA 均为P4P,并未涉及到CED和CTC。我国常见药品MEA类型见图2。
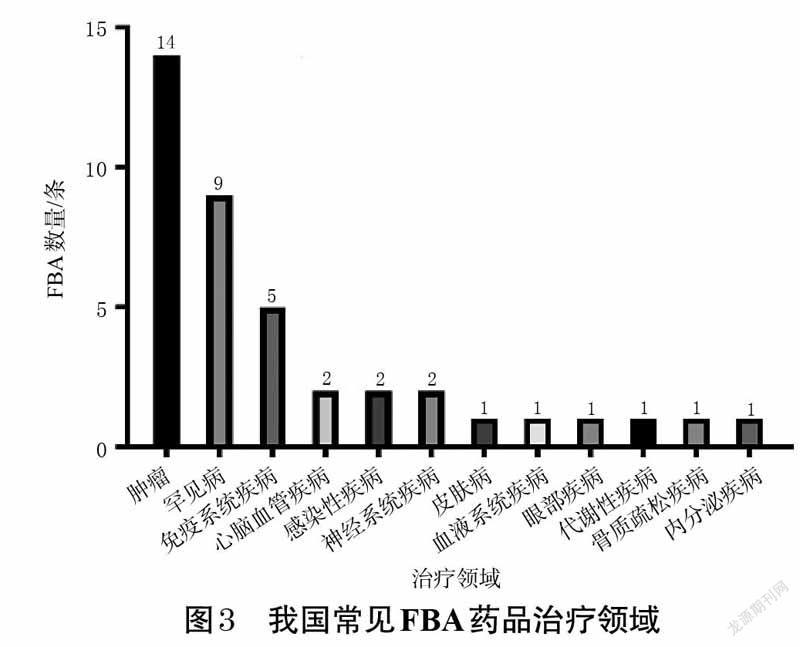
2.3.1 我国常见FBA药品治疗领域及举例54 条药品MEA 中有40 条包含FBA,涵盖了12 个治疗领域的药品,且FBA在肿瘤、罕见病及免疫系统疾病领域的药品中应用较广。我国常见FBA药品治疗领域见图3。
我国FBA均为个体层面,在具体应用中主要表现为以下2 种形式:(1)直接折扣,即患者在购药时可直接享受优惠。(2)费用补偿,即患者购买药品超过一定剂量或者疗程后申请理赔,或者药企为需要继续治疗的患者提供免费药品。我国FBA的表现形式及举例详见表2。
2.3.2 我国常见PBA药品治疗领域及举例54 条药品MEA中有15 条包含PBA,涵盖了肿瘤、罕见病、感染病、胃肠道疾病和神经系统疾病的药品,其中抗肿瘤药约占所有药品的60%。
我国常见的PBA 均为P4P。如2019 年辉瑞公司与中国人寿保险上海分公司、上海镁信健康科技有限公司共同推出了“博爱新安——乳腺癌患者医疗费用补偿项目”,符合项目限定条件的乳腺癌患者在申请并通过审核成功加入项目的4 个月内,如果在帕博西尼(爱博新®)和芳香酶抑制剂治疗后的126 d 内出现疾病进展或转移,辉瑞公司将向保险公司返还部分费用,并且患者可获得33.5%的爱博新®治疗费用报销。
2.3.3 我国常见SBA药品治疗领域及协议举例我国SBA 主要与其他类型的协议(FBA、PBA)一同签订,很少有单独签订的SBA。54 条药品MEA中共有9 条包含SBA,涵盖了肿瘤、罕见病、神经系统疾病、眼部疾病治疗的药品,并以肿瘤、罕见病治疗领域的药品为主。
我国SBA主要体现在患者入组后可以接受健康專员随访、用药指导服务、专家在线问诊、健康管理服务等。以罗替高汀(优普洛®)为例,该协议包含PBA 和SBA 两部分。协议约定:优普洛®的用药剂量为每24 h2 mg的患者,经过预约可以接受一对一健康专员的随访服务;如果在用药的1 个月内,患者根据医师诊断,需要增加剂量到每24 h 4 mg的,可以同时开始享受PBA;坚持用药的患者将在用药的1、3、6 个月内各获得1 次免费的帕金森病专家在线问诊服务;如果在用药的6 个月内,根据医师诊断需要增加优普洛®的用药剂量,患者可以申请保险赔付,持续使用优普洛®可以连续赔付6 个月。
3 我国药品MEA应用存在的问题及对策建议
3.1 药品MEA纳入药品品种较少,建议增加协议药品的品种
目前我国常见的药品MEA主要应用于肿瘤药品和罕见病药品,在其他治疗领域应用较少。国际上的药品MEA 则不仅限于肿瘤治疗领域和罕见病治疗领域药品,如内分泌疾病治疗领域、代谢性疾病治疗领域的药品也多有涉及。建议利益相关方可以考虑参照国际经验,增加药品MEA纳入药品的品种,将药品MEA的应用扩展到更多治疗领域,惠及更多患者。
3.2 药品MEA类型较单一,建议将协议类型多元化
我国常见的药品MEA类型较为单一,且以个体层面的FBA为主。根据英国的经验,因药品具有多样化的特性,单一的药品MEA并不能满足其准入的需求[13]。虽然FBA的实施容易操作、执行和管理,但是其并未解决临床结果的不确定性。另外,我国的PBA 均为P4P,但是P4P 未能持续评价药品的疗效。建议我国更多地应用量价协议、CED和CTC,实现协议类型多元化,减少药品疗效不确定性带来的风险,最大化地体现药品的价值。
3.3 证据收集平台不完善,建议提高证据收集的准确性和持续性
应用PBA需要建立药品临床和真实世界数据收集系统,以保证证据收集的准确性和持续性[13]。2018 年,我国医学界在国家层面启动了罕见病患者登记系统,作为国家医疗保障局(National Healthcare SecurityAdministration,NHSA)试点PBA的数据收集平台,主要收集患者特征、并发症、病史、治疗史、详细诊断、治疗和结果等数据[14]。但是该平台仅能满足罕见病药品治疗的证据收集需求,无法保证所有药品MEA证据收集的准确性和持续性。英国系统性抗癌治疗(the SystemicAnti-Cancer Therapy,SACT)数据库在全国范围内收集所有癌症患者的SACT信息,包括患者特征、疾病特征与分期、治疗方案、治疗周期、用药信息、临床产出等,这些SACT 数据主要来源于NHS 的二级和三级医院。医院每月定期通过NHS网站上传医疗数据至SACT数据库,与NHSA其他临床数据中心的数据共同组成英国国家癌症注册和分析服务数据中心(National Cancer Registrationand Analysis Service,NCRAS)的数据;NHSA 也会将汇总后的数据定期反馈给医院,以优化医院数据收集质量[15]。建议我国一方面可以考虑依托医药企业进行药品上市后的临床研究数据收集,选择易于衡量的替代终点指标进行监测;另一方面可以考虑在多领域建立国家层面的数据收集中心,选择疾病临床终点指标进行监测,提高证据收集的准确性和持续性[16]。
3.4 药品MEA应用尚未有标准化流程,建议建立协议标准化流程
我国药品MEA在应用过程中没有较为标准化的流程,而有经验的国家一般都有标准流程。以澳大利亚针对伊匹单抗注射液(YERVOY®)的协议管理为例分析如下[17]:YERVOY®于2013 年8 月在澳大利亚上市,被批准用于转移性黑色素瘤的治疗。YERVOY®的随机对照试验结果显示,对照组患者的2 年总生存率为13.7%,而YERVOY®可将患者的2 年总生存率提高至23.5%;但是YERVOY®的真实世界疗效存在不确定性。2013 年8月,百时美施贵宝(Bristol-Myers Squibb,BMS)公司与澳大利亚药品福利咨询委员会(the Pharmaceutical BenefitsAdvisory Committee,PBAC)签订了P4P,对比在真实世界与临床试验中使用YERVOY®后患者的2 年总生存率,如果真实世界疗效比临床试验疗效差,则BMS公司需向PBAC 返还费用。该协议纳入了2013 年8 月-2014 年7 月使用YERVOY®治疗的患者,并在患者首次用药后对其进行2 年的随访,由医师收集患者2 年的生存情况。在2 年随访期间,BMS、PBAC与医师都可以通过在线系统查看患者的医疗记录(患者个人信息进行脱敏处理)。数据收集截止日(2 年后),医师将收集到的患者生存情况提交给PBAC。BMS公司会跟踪数据收集情况,若医师在随访期结束后的2 周内没有提供数据,则发送邮件询问;若4 周后仍没有提供数据,则通过电话或当面进行询问。医师提交数据后60 个工作日内,BMS公司向PBAC提供最终报告[17]。建议我国可以尝试制定一套标准化药品MEA应用流程,且整个流程应事先明确适用条件、实施标准、评估流程及监测机制,以减少不必要的行政负担、费用支出,并保障药品MEA的可持续性[13]。
4 结语
本文梳理了国际及我国药品MEA的应用现状,发现英国、澳大利亚和意大利应用药品MEA的经验较为丰富,且运作管理机制较完善、协议药品范畴较为宽泛、协议类型相对多元化。而我国药品MEA纳入药品品种较少,协议类型较为单一,證据收集平台不完善且缺乏药品MEA标准化流程。对此,笔者建议利益相关方增加协议药品的品种、将协议类型多元化、提高证据收集准确性和持续性、建立协议标准化流程等,对完善药品MEA流程具有一定的参考价值。但本文也存在一定的局限性,有待后续研究进行完善:第一,由于我国没有专门的药品MEA查询平台,且药品MEA别名较多,笔者只能尽量获取足够多的协议,但无法保证药品MEA数据库的完整性;第二,由于药品MEA的保密性,许多药品MEA并未展示出全部信息,因此笔者也无法获取到非常详细的协议内容。
