斑节对虾PP2C基因的克隆及其在急性低盐和氨氮胁迫下表达模式的相关研究
2022-06-22司梦茹李运东杨其彬杨丽诗黄建华江世贵周发林
司梦茹,李运东,杨其彬,姜 松,杨丽诗,黄建华,江世贵,周发林
1. 上海海洋大学 水产与生命学院 201306
2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300
3. 中国水产科学研究院南海水产研究所热带水产研究开发中心,海南 三亚 572018
PP2C蛋白磷酸酶,又称金属依赖性蛋白磷酸酶 (Metal-dependent protein phosphatases, PPMs),可以对磷酸化的丝/苏氨酸残基特异性脱磷酸[1]。目前已鉴定出PP2Cα,PP2Cβ,PP2Cγ,PP2CCδ/Wip1等16个PP2C基因[2-3]。不同的PP2C亚型在细胞应激、细胞周期、细胞凋亡、新陈代谢、RNA剪接及线粒体功能等调控过程中发挥重要作用[4-6]。迄今为止,已在古细菌、细菌、真菌、动物、植物等多种生物中发现PP2C家族的存在[7-11]。研究表明,PP2C主要通过ABA和MAPK信号通路或某些离子通道参与生物的抗逆境胁迫反应[12]。MAPK通路可以通过MKKK、MKK和MAPK 3种激酶的依次激活调节生物对环境的应激适应[13]。在生理性和外界应激条件下,PP2Cα通过对MAPK亚家族JNK上游调节因子MKK4和MKK7脱磷酸参与调节应激活化的MAPK信号通路,负调节MAPK信号通路从细胞膜到细胞核或其他的亚细胞靶点的刺激传递[9,14]。其中,PP2C是参与MAPK磷酸化调节的关键基因,尤其在外界应激过程中,机体通过调节PP2C的表达来维持正常生命活动,在环境适应及外源免疫过程中发挥重要作用[9]。例如,Bollmann 等[15]发现,PP2C在小鼠 (Mus musculus)心肌细胞中表达,在油酸应激过程中诱导细胞凋亡。但有关PP2C在甲壳动物中的研究十分缺乏,尚未见PP2C在斑节对虾 (Penaeus monodon) 中急性应激应答的相关报道。
多数水生甲壳动物对急性低盐和氨氮变化比较敏感[16]。有研究报道,急性盐度变化影响斑节对虾的免疫和代谢反应,会增强其对病原菌的易感性[17]。毒理学研究发现,氨对多种对虾有强烈的负面影响,氨氮升高会降低其生长速度,增加蜕皮频率并损害器官 (肝胰腺和鳃) 等[18]。有关低盐和氨氮应激相关基因的研究已经在多种甲壳动物中展开,但目前对斑节对虾急性低盐和氨氮应答的研究尚不够深入,对渗透调节和氨氮解毒代谢途径中起到调控作用的关键酶及其基因的研究仍有不足[19]。因此,本研究通过RACE技术克隆得到了斑节对虾PP2C基因 (PmPP2C) cDNA全长,分析了PP2C在斑节对虾各个组织中的表达情况,并对其在96 h急性低盐胁迫和氨氮胁迫过程中的表达变化规律进行了分析,以期为深入探究斑节对虾PP2C基因的抗逆机制提供理论基础。
1 材料与方法
1.1 实验动物
实验所用斑节对虾取自中国水产科学研究院南海水产研究所深圳试验基地。实验前选取体长为(12.37±0.57) cm、质量为 (15.08±1.20) g 的对虾,暂养于 4.7 m×4.1 m×1.7 m 的自然海水 (盐度 30) 水泥池中3 d,养殖水体积4.8 m3,水体充分曝气,温度25~28 ℃。暂养结束后,随机选取健康完整的雌、雄对虾数尾,分别取其表皮、肝胰腺、鳃、胃、心脏、肌肉、眼柄神经、脑神经、胸神经、卵巢、精巢等组织样品,置于 RNAlater Solution (Ambion,上海) 4 ℃ 过夜后于−80 ℃ 冰箱中保存。
1.2 总 RNA 的提取及 cDNA 的制备
按照 HiPure Universal RNA Mini Kit (Magen,广州) 试剂盒说明书提取上述样品的总RNA。1.2%琼脂糖凝胶电泳检测其完整性,NanoDrop 2000 (Thermo Fisher,美国) 检测其浓度和纯度后备用。进行荧光定量的样品按照PrimeScriptTM Reverse Transcriptase Kit (TaKaRa,上海) 试剂盒说明书进行cDNA合成,产物经EF-1α检测后于−80 ℃冰箱中储存备用。
1.3 PmPP2C 的 cDNA 克隆
从转录组数据库获得PmPP2C基因的EST序列,利用Primer Premier 5设计特异性引物PmPP2CF1/R1、PmPP2C-F2/R2 (表1) 以验证序列的正确性。按照 SMARTer RACE 5'/3' Kit User Manual(TaKaRa,上海) 试剂盒说明书制作cDNA末端快速扩增模板,扩增PmPP2CcDNA的5'和3'末端。

表1 实验中所用引物序列Table 1 Oligonucleotide primers used in experiment
1.4 PmPP2C 的生物信息学分析
通过克隆获得PmPP2CcDNA全长。利用软件DNAMAN对测序序列进行拼接。利用NCBI中的 ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder)工具预测开放阅读框。利用EMBOSS(https://www.bioinformatics.nl/emboss-explorer/) 翻译其氨基酸序列。利用NCBI中的BLAST (https://blast.ncbi.nlm.nih.gov/Blast) 工具对预测的氨基酸序列与蛋白质数据库进行相似性比对。利用软件Clustal X 进行多重序列比对。利用 ExPASy Prot-Param (https://web.expasy.org/protparam/) 预测各种氨基酸含量、理论等电点及理论分子质量。利用SMART 4.0 (http://smart.embl-heidelberg.de/) 分析蛋白质结构域。利用 NetNGlyc 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/) 预测糖基化位点。利用 NetPhos 2.0 Server (http://www.cbs.dtu.dk/services/NetPhos/) 预测磷酸化位点。利用SOPAM (https://npsa-prabi. ibcp.fr/cgi-bin/npsa_automat.pl−page=npsa_sopma.html) 预测蛋白质二级结构。利用SWISS MODEL (https://swissmodel.expasy.org/) 预测蛋白质三级结构。利用软件Clustal X和MEGA 6.06构建系统进化树。
1.5 96 h 急性低盐胁迫实验
通过预实验确定斑节对虾96 h急性盐度胁迫的半致死浓度 (LC50) 以及安全浓度 (SC)。预实验期间不投喂饲料,每隔2 h记录死亡情况并捞取死虾至96 h实验结束。实验结束以盐浓度为x轴,死亡率为y轴,建立直线回归方程:y=a+bx,直线内插法计算出LC50和SC分别为盐度3和17。
正式实验分为3组,分别为对照组 (盐度30)、中浓度胁迫组 (SC=盐度17)、低浓度胁迫组(LC50=盐度3)。每组设置3个桶,每桶放置30尾虾。用正常海水调节各桶水体盐度到实验盐度。养殖温度为25~28 ℃,pH为7.0~7.5。实验期间每隔3 h捞取死虾并做好记录,每隔24 h更换全部海水以保证水质和盐度基本不变。分别于胁迫后的第0、第3、第6、第12、第24、第48、第72和第96小时取样。每个时间点选取3尾活力较好的虾,取其肝胰腺和鳃组织样品置于RNAlater Solution (Ambion,上海) 4 ℃ 过夜后于−80 ℃ 冰箱中保存。
1.6 96 h 急性氨氮胁迫实验
通过预实验确定斑节对虾96 h急性氨氮胁迫的LC50以及SC。预实验期间不投喂饲料,每隔2 h记录死亡情况并捞取死虾至96 h实验结束。实验结束以氨氮浓度为x轴,死亡率为y轴,建立直线回归方程:y=a+bx,直线内插法计算出LC50和SC 分别为 29.47 和 2.95 mg·L−1。
正式实验分为3组,分别为对照组 (正常海水)、低氨氮胁迫组 (SC=2.95 mg·L−1)、高氨氮胁迫组 (LC50=29.47 mg·L−1)。每组设置 3 个桶,每桶放置30尾虾。水体氨氮浓度通过添加氯化铵(NH4Cl) 调节。养殖温度为 25~28 ℃,pH为7.0~7.5。实验期间每隔3 h捞取死虾并做好记录,每隔24 h更换全部海水以保证水质和氨氮浓度基本不变。分别于胁迫后的第0、第3、第6、第12、第24、第48、第72和第96小时取样。每个时间点选取3尾活力较好的虾,取其肝胰腺和鳃组织样品置于 RNAlater Solution (Ambion,上海) 4 ℃过夜后于−80 ℃冰箱中保存。
1.7 实时荧光定量 PCR
用于PmPP2C基因表达分析的荧光定量引物PmPP2C-qF/qR 利用 Primer Premier 5 设计 (表1)。内参基因使用EF-1α-qF/qR (Elongation factor 1α),以斑节对虾各组织以及96 h盐度胁迫和氨氮胁迫组织 cDNA 为模板,使用 Roche LightCycler®480Ⅱ(Roche) 对斑节对虾PP2C进行RT-PCR扩增。RTPCR 的反应体系为 12.5 μL,包括 SYBR Green Premix Pro Taq HS qPCR Kit (瑞真,广州) 6.25 μL,PmPP2C-qF 和PmPP2C-qR 各 0.5 μL, cDNA 模板(约 60 ng·μL−1) 1 μL,ddH2O 4.25 μL。每个样品设置3个平行和内参对照,同时设置阴性和阳性对照。RT-PCR 程序设置为 95 ℃ 30 s;95 ℃ 5 s,60 ℃30 s,40 个循环;95 ℃ 5 s,60 ℃ 1 min;50 ℃ 30 s。定量结果分析使用相对CT法 (2−△△Ct),利用统计分析软件IBM SPSS 20.0对实验结果进行单因素方差 (One Way ANOVA) 分析,并进行 Turkey's 检验,P<0.05表示差异显著。
2 结果
2.1 PmPP2C 序列分析
通过克隆获得了PmPP2CcDNA全长,共2 151 bp,GenBank 登录号为 MZ802856,包括 5'非编码区 (UTR) 31 bp,3' UTR 41 bp,包括 26 个碱基的 poly (A) 尾,开放阅读框 (ORF) 2 079 bp,可编码 692 个氨基酸 (图1)。ExPASy ProtParam 计算分析表明,PmPP2C的相对分子量为74.83 kD,理论等电点 (pI) 为5.48,其中包括89个强酸性氨基酸 (Asp+Glu) 和 70 个强碱性氨基酸 (Arg+Lys)。预测其不稳定指数 (Ⅱ)、脂肪指数和亲水性平均值(GRAVY) 分别为 46.88、77.01 和−0.54。磷酸化位点预测其上具有34个丝氨酸 (S) 位点,16个苏氨酸 (T) 位点和 2 个酪氨酸 (Y) 位点。糖基化位点预测其上具有6个主要的糖基化位点。

图1 PmPP2C 核酸序列及氨基酸序列展示Fig. 1 Nucleotide and deduced amino acid sequence of PmPP2C
2.2 PmPP2C 氨基酸同源性分析及系统进化树构建
利用Blast对PmPP2C氨基酸序列和其他物种的PP2C氨基酸序列进行同源性比对,结果显示PmPP2C 与凡纳滨对虾 (Litopenaeus vannamei) 的同源性较高,相似度高达96.77%,而与三疣梭子蟹(Portunus trituberculatus) 的相似度为 63.6% (图2)。NCBI下载16个不同物种的PP2C序列,利用Clustal X和MEGA 6.0软件比对斑节对虾与其他物种PP2C的氨基酸序列构建系统进化树 (图3)。结果显示斑节对虾与凡纳滨对虾 (ROT72201.1) 亲缘关系最近并聚为一支。

图2 PmPP2C c亚型与其他物种氨基酸序列比对Fig. 2 Multiple alignment of PmPP2C c subtype amino acid sequences from P. monodon and other species
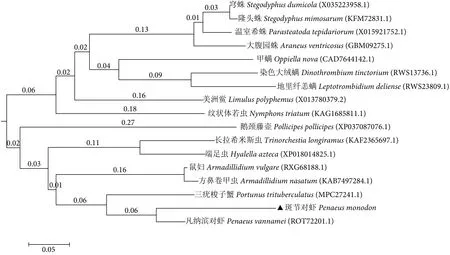
图3 运用Clustal和MEGA 6.06软件基于NJ法构建PmPP2C c亚型与其他物种的系统进化树Fig. 3 NJ phylogenetic tree of PmPP2C c subtype with other species by Clustal and MEGA 6.06
2.3 PmPP2C 的结构域和蛋白质三维结构分析
通过SOPMA软件对PmPP2C的氨基酸序列的二级结构进行预测,结果显示其有203个α-螺旋,约占29.34%;38个β-转角,约占5.49%;359个无规则卷曲,约占51.88%;92个延伸链,约占13.29% (图4)。CD-search在线预测表明PmPP2C具有PP2C c型结构域,位于167—351个氨基酸之间。三维结构分析表明,PmPP2C具有钙离子(Ca2+) 结合位点,但不具有保守性 (图5)。

图4 SOPMA软件对PmPP2C蛋白二级结构预测结果Fig. 4 Secondary structure of PmPP2C protein predicted by SOPMA

图5 斑节对虾PP2C三维结构空间示意图Fig. 5 Three-dimensional ribbon structure of PmPP2C
2.4 PmPP2C 在不同组织中的表达
利用实时定量PCR技术检测PmPP2C基因在斑节对虾11种组织中的转录表达水平 (图6)。结果显示,PmPP2C在斑节对虾各个组织均有表达,在肝组织中表达量最高,其次是鳃、胸神经、精巢、肌肉、心脏,在表皮、脑神经、眼柄神经、胃、肠道、卵巢等组织中表达量很低。

图6 PmPP2C在各组织的相对表达量Fig. 6 Expression of PmPP2C in different tissues
2.5 PmPP2C 在低盐胁迫下的表达
96 h急性低盐胁迫检测结果显示,在肝胰腺中(图7-a),中浓度组和低浓度组与对照组相比,除胁迫后第3小时外,整体变化趋势为先下调再上调,最后趋于平稳。其中低浓度组较中浓度组变化趋势比较不平稳,在胁迫后第3小时出现了显著上调,为对照组的4.46倍。在鳃中 (图7-b),中浓度组和低浓度组与对照组相比,除胁迫后第12和第24小时,其他时间点都有不同程度下调。
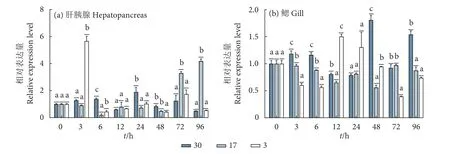
图7 急性低盐胁迫下斑节对虾PmPP2C在肝胰腺和鳃组织中的相对表达水平Fig. 7 mRNA relative expression of PmPP2C in hepatopancreas and gill under acute low salt stress
2.6 PmPP2C 在氨氮胁迫下的表达
96 h急性氨氮胁迫检测结果显示,在肝胰腺中(图8-a),高浓度组和低浓度组较对照组表达水平显著上调,均在第12小时达到上调高峰点,分别为对照组的3.22和6.32倍。鳃组织中 (图8-b),低浓度组较对照组表达水平显著上调,其中第3、第12、第24、第48、第72小时是上调的高峰点,表达量分别约为对照组的2.56、3.32、2.13、3.15、2.59倍。高浓度组较对照组表达水平整体呈现下调-上调-下调趋势,并在第24小时表达水平最高,约为对照组的2.75倍,第96小时为对照组的0.88倍。

图8 急性氨氮胁迫下斑节对虾PmPP2C在肝胰腺和鳃组织中的相对表达水平Fig. 8 mRNA relative expression of PmPP2C in hepatopancreas and gill under acute ammonia nitrogen stress
3 讨论
3.1 PmPP2C 序列分析
有研究表明,细胞内DNA损伤可通过蛋白的磷酸化进行调节[20-22]。细胞内约30%的蛋白都被磷酸化,其中有超过98%的修饰都发生在丝氨酸/苏氨酸位点上[23]。本文从本项目组斑节对虾转录组数据库中PP2C部分序列,设计RACE引物,成功从斑节对虾体内克隆了PP2C基因全长cDNA序列。通过成熟肽的同源性比较发现,该基因与凡纳滨对虾PP2C-like同源性最高,由此可确定扩增的基因为斑节对虾的PP2C基因。结构预测分析,PmPP2C成熟肽氨基酸序列包含一个典型的丝氨酸/苏氨酸蛋白磷酸酶c型结构域,具多个丝氨酸、苏氨酸蛋白酶磷酸化位点,可能对许多反应起着生物“开/关”作用[13]。NetNGlyc糖基化位点预测可能存在5个糖基化位点,可能在信号转导、分子识别和免疫应激等过程中发挥作用[24]。经多重比对发现,PmPP2C与凡纳滨对虾的PP2C氨基酸序列同源性较高,说明PP2C在这两种物种中较为保守。
3.2 PmPP2C 的组织表达
PP2C基因在斑节对虾中的组织分布研究发现其在所有检测组织中均有表达,但组织间表达量差异较大。PmPP2C基因在对虾肝胰腺和鳃中表达量最高,其次为胸神经和精巢,在其他组织中表达量较低。PmPP2C的这种组织特异性表明肝胰腺和鳃可能是其发挥作用的重要组织。Davie等[25]研究发现,PP2C在哺乳动物肝细胞氨氮应激调节中发挥重要作用。本研究中PP2C在斑节对虾肝胰腺中高表达,肝胰腺是水生甲壳动物的主要氨氮解毒代谢和排泄器官,推测其可能参与斑节对虾氨氮解毒代谢或排泄调节过程[26]。此外,已有研究报道PP2C在植物根系、叶片等渗透调节器官中具有重要作用。例如Liu等[27]研究发现玉米根中分离的ZmPP2C在调节拟南芥 (Arabidopsis thaliana) 对盐和干旱的耐受性中具有重要作用。植物叶片PP2C还可通过负调节ABA信号通路增强植物对干旱和高盐等胁迫的适应性[28]。本研究中PmPP2C在鳃中高表达,鳃作为甲壳动物主要的渗透调节器官,推测PmPP2C可能在斑节对虾的渗透调节中具有重要作用[29]。
3.3 PmPP2C 的 96 h 急性应激应答
水产养殖用水水质很容易受到外部因素的影响,进而影响养殖对象的细胞凋亡和免疫应答应激机制,导致生长迟缓和成活率降低[30-31]。已有研究表明,PP2C在调节细胞应激过程中具有重要作用[4]。在哺乳动物细胞中,PP2Cα和PP2Cβ通过对丝裂原活化的蛋白激酶脱磷酸抑制JNK和P38信号的传导,参与调节应激活化的MAPK信号通路[14]。Fan等[32]通过研究MAPK分支通路MAPKK在斑节对虾96 h急性低盐胁迫中的表达模式发现,斑节对虾可通过调节肝胰腺和鳃组织中的PmMAPKK的表达来应对外界应激。此外,MAPK通路多基因MKK7、MKK3、p38MAPK等也已被证实参与水生甲壳动物肝胰腺和鳃组织的先天性免疫应激和调节过程[13,33-34]。PP2C是MAPK信号通路的重要基因[9,35],因此,本研究推断PmPP2C可能参与了斑节对虾的急性应激过程。
研究表明,盐度改变会导致对虾体内各种非特异性免疫及渗透相关酶活性改变,致使对虾免疫力下降。随着养殖水体盐度降低,病原菌对斑节对虾的感染力增加,斑节对虾对病原菌的耐受性不断减弱[17]。本研究中96 h急性低盐胁迫实验结果显示,在两种低盐胁迫下,肝胰腺和鳃组织PmPP2C的表达量均下调,其中鳃组织中PmPP2C表达量在48 h后逐渐上调并趋于稳定,肝胰腺中的表达量 (除低浓度组第12和第24小时) 始终被抑制。研究表明斑节对虾PmPP2C可能具有和哺乳动物相似的调节,参与调节应激活化的MAPK信号通路,从而使斑节对虾能够耐受低盐等极端环境因子的胁迫[14]。而水中氨氮浓度过高,可导致甲壳动物耗氧率增加、体内渗透压及免疫力下降、代谢紊乱和生长缓慢,严重时可导致死亡。Luo等[36]研究表明,AMPK作为能量代谢调节的关键因子,可通过AMPK-MAPK级联参与渗透应激和氧化应激等激活的能量代谢过程,在外源急性应激过程中具有重要作用。Davie等[25]研究哺乳动物肝癌细胞在氮应激中的机制发现,AMPKαSsp2激活可能是通过抑制某种AMPK磷酸激酶来实现的,而PP2C可能作为AMPKαSsp2活性负调节因子被抑制。本研究表明,斑节对虾在96 h急性氨氮胁迫初期PmPP2C表达量普遍显著低于对照组,可能是受到了激活的AMPK抑制。Davie等[25]研究指出,激活的AMPK诱导细胞生长停滞,可通过PP2C脱磷酸使细胞恢复生长,这也可能是本研究中斑节对虾急性应激中后期PmPP2C表达量升高的原因。
