海水入侵区含水层中原核微生物多样性和群落结构特征及其意义
2022-06-22桑石磊黄柏强王永智刘华雪许莉佳
桑石磊,黄柏强,王永智,刘华雪,许莉佳,张 晋
1. 生态环境部华南环境科学研究所,广东 广州 510535
2. 河海大学长江保护与绿色发展研究院,水文水资源与水利工程科学国家重点实验室,江苏 南京 210098
3. 中国科学院新疆生态与地理研究所,新疆 乌鲁木齐 830011
地下水是一种宝贵的饮用水资源,为我国近70%的人口提供饮用,95%以上的农村人口主要饮用地下水,40%的农田主要用地下水来灌溉[1]. 改革开放40 多年来,社会经济的快速发展和各种污染物的排放引起了地下淡水资源的缺乏[2]. 海水入侵再加上地下水需求的激增以及全球气候变化、海平面上升等自然因素,进一步加剧了地下淡水资源的短缺[3].特别是许多沿海地下含水层正面临着人为污染[4]、地下卤水[5]或过量抽取地下水[6]所导致的海水入侵作用等因素,严重威胁着地下水的安全. 虽然地下含水层大多是寡营养的,但微生物几乎是地下水环境中唯一的栖息者[7]. 研究表明,含水层是受微生物群落活动影响的特殊的生态系统[8],与营养物质运移、元素的生物地球化学循环和污染物降解作用密切相关[9].
研究[10-12]表明,微生物群落是地下水生态系统的重要组成部分. 近年来,多种微生物参数,包括微生物群落、多样性与理化特性的相互作用等,已被用来作为水质评价的指标. 例如,为了寻找监测地下水水质的生物参数,Unno 等[13]分析了微生物类群与水文化学之间的关系,发现微生物组分析是监测地下水健康的有效工具. Ye 等[14]比较了海底地下水不同采样位置的微生物指纹图谱,并选择了一些潜在的细菌类群(如共生单胞菌等)进行生物修复. 为有效了解和保护淡水地下水,研究地下含水层微生物群落的组成和功能是十分必要的. 然而,在海水入侵地区,地下水中微生物群落的多样性和结构组成还未得到深入刻画,且其群落结构与水文环境的相互作用关系仍不明确.
珠江三角洲地区供应将近5 000 万人口的用水需求,但几乎一半的含水层中地下水含盐度超过1 g/L[15-16]. 尽管水资源丰富,但由于土壤和水污染[17]以及珠江口严重的咸水入侵问题[18],导致珠江三角洲一些地区地下水中总溶解固体含量甚至超过10 g/L[19]. 研究表明,地下水盐度的来源是由全新世海侵作用遗留的古海水[20-21]. 为了提高对地下水的管理水平,学者对珠江三角洲含水层水文地球化学特征进行了大量研究[21-22],但对该地区地下水盐度梯度下微生物群落结构的研究较少. 事实上,在世界上大多数国家的水质监测中,对地下生态系统中微生物群落的研究一直都未得到充分重视[23]. 研究[24]表明,微生物是地下水生态系统的重要组成部分,是评价地下水水质不可缺少的参数. 为有效地了解和保护地下淡水,对含水层微生物群落的组成和功能进行调查研究很有必要.
对地下水微生物多样性的研究技术包括常规的培养技术和基于DNA 的分子生物学研究方法[25]. 由于环境生态系统中绝大多数微生物无法在人工培养基中轻易培养,而基于DNA 的高通量测序方法在探索复杂环境中的微生物群落方面具有更强的优势. 为研究珠江三角洲地下水中微生物群落的多样性和分类组成,采用下一代测序(next generation sequencing,NGS)技术,从水文生态学的角度描述微生物群落结构与环境变量之间的关系;通过对珠江三角洲地下水水质空间变化和微生物群落结构的研究,分析地下水微生物群落对盐度变化的响应,以期为地下咸水中微生物群落结构及其环境相互作用提供参考.
1 材料与方法
1.1 采样地点、样品采集
珠江三角洲属亚热带季风气候,气候温暖湿润,年均气温22 °C 左右,年均降水量1 600~2 000 mm,主要集中在4—10 月. 2017 年5 月,在广州市中部和南部地区选择22 个监测井,包括5 个重度咸水监测井(S)(TDS 浓度>10 g/L,TDS 表示溶解性总固体)、5个中度咸水监测井(M1)(3 g/L<TDS 浓度<10 g/L)、3个微咸水监测井(M2)(1 g/L<TDS 浓度<3 g/L)和9 个淡水监测井(TDS 浓度<1 g/L).
为保证取得的地下水样可以表征含水层中地下水的性质,采样之前均对监测井进行洗井工作,采用专业的地下水抽水泵并以小流量抽水洗井. 根据监测井井管尺寸等信息计算管内水体积,保证洗井过程抽水量大于管内水体积的3 倍,以除去残留在监测井中的“死水”,待水体各项理化指标(温度、盐度和pH)稳定后再采集样品. 现场测试的理化指标主要包括温度(temperature,T)、pH、电导率(electrical conductivity,EC)、溶解性总固体(total dissolved solids, TDS)、溶解氧 (dissolved oxygen, DO)和氧化还原电位(oxidation-reduction potential, ORP),测量仪器为电导率仪(Orion 320C-01A, Thermo Scientific, USA). 地下水样本都收集在无菌的10 L 塑料容器中,用于过滤收集微生物样本,通过抽滤法在0.22 μm 的纤维滤膜上富集微生物,将滤膜保存于无菌离心管,封口膜密封后即刻存放在—80 ℃冰箱中备用;每个样本再过滤500 mL,一式三份,用于理化分析. 所有样品在运输过程中均保存在4 ℃的冰柜中,运送回实验室立即处理.
1.2 理化性质分析
理化分析参考Greenberg 等[26]的方法,为了减少水样杂质的干扰,在测试前,将水样用0.45 μm 的滤膜过滤. 阳离子(K+、Ca2+、Na+和Mg2+)浓度采用电感耦合等离子体发射光谱仪(ICAP 7600 ICP-OES,Thermo Scientific, USA)测试,阴离子(NO3—、Cl—和SO42—)浓度使用离子色谱仪(883 chromatograph,Metrohm, Switzerland)测定. HCO3—和CO32—浓度采用化学滴定法(DZ/T 0064.49—1993《地下水质检测方法》)检测.
1.3 DNA 提取和PCR 扩增及测序
将水样按照试剂盒MOBIO PowerSoil® DNA Isolation Kit (Qiagen/MO BIO Laboratories Inc., Carlsbad,CA, USA)操作步骤进行DNA 提取. 用1%的琼脂糖凝胶检测基因组DNA 的提取效果,用NanoDrop 2000(Isogen Life Science, the Netherlands)光度仪检测DNA的纯度和浓度. 利用原核微生物16S rRNA V4 区引物515FmodF(5′-GTGCCAGCMGCCGCGGTAA-3′)、806RmodR (5′-GGACTACHVGGGTWTCTAAT-3′)进行目标基因的PCR 扩增[27]. 扩增程序:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃下保存(PCR 仪,ABI GeneAmp® 9700 型). PCR 反应体系:5×TransStart FastPfu 缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L) 0.8 μL,下游引物(5 μmol/L ) 0.8 μL, TransStart FastPfu DNA 聚合酶0.4 μL,模板DNA 10 ng,ddH2O 补足至20 μL. 每个样本设3个重复. 按照NEBNext®Ultra™ DNA Library Prep Kit for Illumina®(New England Biolabs, Ipswich,MA, USA)标准流程建库操作,将样品送到上海美吉生物科技有限公司,采用Illumina HiSeq 2500 PE250 测序平台进行扩增子文库的测序.
利用Trimmomatic 软件(V0.33)对测序数据过滤后,通过FLASH(V1.2.11)软件对数据进行拼接,再利用Mothur 软件对拼接后的序列进行质量控制及过滤[28],得到有效的拼接片段. 过滤reads 尾部质量值在20 以下的碱基,设置50 bp 的窗口,如果窗口内的平均质量值低于20,则从窗口开始截去后端碱基,过滤质控后50 bp 以下的reads,去除含N 碱基的reads;根据PE reads 之间的overlap 关系,将成对reads 拼接(merge)成一条序列,最小overlap 长度为10 bp;拼接序列的overlap 区允许的最大错配比率为0.2,筛选不符合序列;根据序列首尾两端的barcode 和引物区分样品,并调整序列方向,barcode 允许的错配数为0,最大引物错配数为2.
采用 RDP Classifier algorithm 方法和 Silva 16S rRNA 数据库对物种进行注释分类(设置阈值为70%),将相似度高于97%的定义为一个OTU(operational taxonomic unit,OTU). α-多样性计算:包括群落的多样性指数(Shannon-Wiener)、丰富度指数(Chao1)、均匀度指数(Heip)和序列的覆盖度(Good's coverage),使用Mothur 软件完成计算[28]. β-多样性的计算:比较样本之间的相似性,在OTU 水平上利用Bray-Curtis 算法做PCoA 分析,用R 语言进行统计分析和制图[29]. 通过Cytoscape v2.8.3 对不同样本间的物种丰度信息进行共现性网络分析[30],相关性热图用R 语言制图[29],采用VIF(Variance inflation factor,VIF)分析去掉共线性环境因子,并进一步使用Canoco 4.5 软件进行典范对应分析(CCA). 该文涉及的所有原始序列已上传至NCBI 数据库,其登录号为SRP118856.
2 结果与分析
2.1 微生物群落的丰富度和多样性
该研究中,从22 个地下水样品中共获得814 701条基因序列,对所有样品进行抽平,共获得1 427 个OTUs (97%的置信度),OTUs 的数目为415~804 个,表明观测到的微生物丰度在不同水体中存在差异. 微生物群落的Chao1 丰富度指数为650~1 047,Shannon-Wiener 多样性指数为0.32~0.60. 一般来说,重度咸水监测井(S)样品包含的微生物群落的丰富度和均匀度指数高于淡水监测井(F)样品. 然而,微生物群落的丰富度和均匀度指数的最低值出现在微咸水(M2)样品中.
Shannon-Wiener 多样性指数表明,含水层中微生物群落多样性随盐度梯度发生显著变化. 然而,微生物群落多样性指数最高值出现在重度咸水(S)样品中,而最低值出现在微咸水(M2)样品中,多样性指数的变化并不完全与盐度梯度一致. 微生物序列的覆盖度都在99%以上,表现出了较好的序列完整性.
2.2 微生物群落的组成
经过数据库的比对,该研究中基因序列可以分为细菌和古菌两大类,大多数的序列鉴定为细菌(见图1). 具体来说,共分属于47 个原核微生物门类,大多数序列从属于变形菌门(Proteobacteria, 占比为50%~94%)、厚壁菌门(Firmicutes, 占比为3%~45%)、奇古菌门(Thaumarchaeota, 占比为0~29%)、放线菌门(Actinobacteria, 占 比 为 0~14%)、 广 古 菌 门(Euryarchaeota, 占 比 为 0~13%)和 拟 杆 菌 门(Bacteroidetes, 占比为0~10%),还有一些序列占比在1%~10%之 间, 包 括 Acidobacteria、 Chloroflexi、Gemmatimonadetes 和Ignavibacteriae. 从结果来看,古菌在咸水中占比更高,广古菌群(Euryarchaeota)在重度咸水(S)样品中占比更高,而奇古菌门(Thaumarchaeota)在高浓度咸水样品中占比更高.
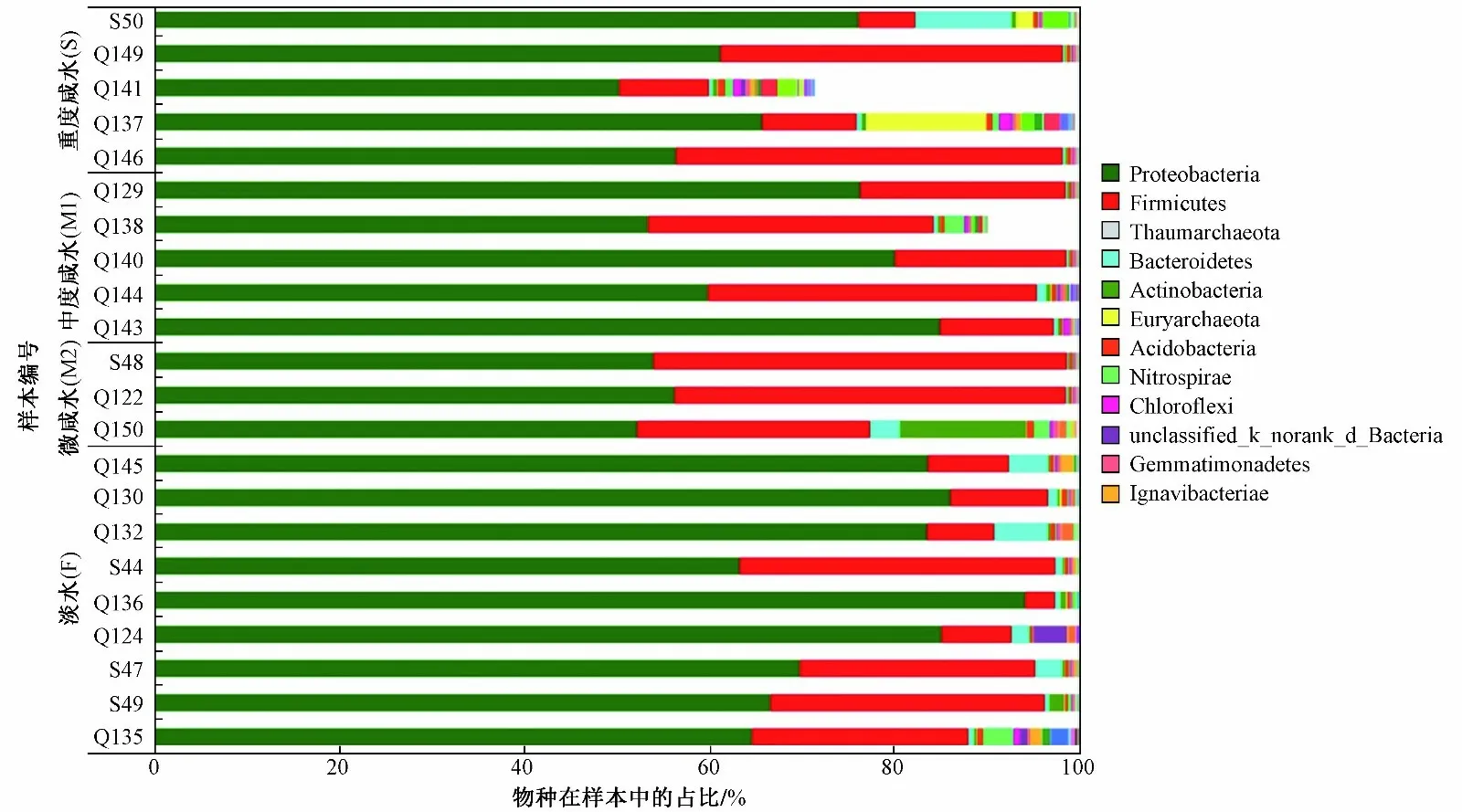
图 1 微生物群落在门水平上的分布Fig.1 Microbial composition analysis based on taxonomic classification at the phylum level
占比最高的变形菌门在纲水平上主要为γ-变形菌纲(Gammaproteobacteria),在重度咸水(S)、中度咸水(M1)、微咸水(M2)和淡水(F)监测井样品中分别为45%、30%、46%和38% (见图1). 淡水微生物群落中β-变形菌纲在总序列中的占比高达34%,而在重度咸水样品中其占比不超过2%. 与其他样品相比,Epsilonproteobacteria 仅在中度咸水(M1)样品中发现. 此外,Deltaproteobacteria 在重度咸水(S)样品中的丰度高于其他样品,而Zetaproteobacteria 在所有样品中的丰度都很低.
2.3 微生物群落在不同盐度梯度上的变化
利用群落隶属关系对含水层微生物群落进行比较,探讨微生物群落分布沿含水层盐度梯度的空间变化(见图2). 样本间OTUs 网络分析表明,相对于其他盐度的含水层样品,中度咸水(M1)和微咸水(M2)地下水样品微生物群落结构更相似. 因此,为了更加清晰地显示微生物群落在盐度梯度上的分布,把中度咸水(M1)和微咸水(M2)地下水样品合并起来共称为咸水样品(M). 维恩图展示了共有和独有的OTUs 数量在3 个盐度梯度上的分布(见图2). 从22 个地下水样品中产生的1 427 个OTUs 中可以看出,3 个盐度差异的微生物群落之间共有的OTUs 占比高达59%(837 个OTUs). 此外,两个样品的微生物群落之间共有的OTUs 约占18% (257 个OTUs). 维恩图结果显示,不同盐度的样品之间有很多共同的OTUs,在一定程度上也说明含水层中淡水和咸水之间存在流通和交换作用.
特别是γ-变形菌纲(Gammaproteobacteria)在所有盐度水体中占比都很高,微生物群落的相似性反映在属水平的高丰度类群中,如假单胞菌属(Pseudomonas)、不动杆菌属 (Acinetobacter)和Unclassified Enterobacteriaceae(见图3). 重度咸水(S)中的高丰度类群是甲烷球菌属(Methanococcus)、Candidatus Nitrosoarchaeum和海洋杆菌属(Marinobacter),分别隶属于奇古菌门(Thaumarchaeota)、 广古菌门(Euryarchaeota)和γ-变形菌纲(Gammaproteobacteria).然而,在淡水样品中占优势的类群是β-变形菌纲(Betaproteobacteria),包括Norank Hydrogenophilaceae、Unclassified Methylophilaceae、 Denitratisoma 和Unclassified Rhodocyclaceae.
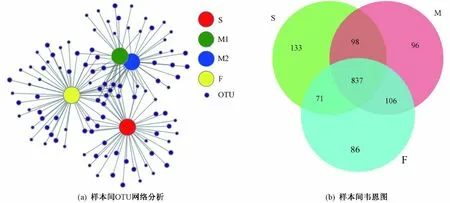
图 2 样本之间OTUs 网络分析和维恩图Fig.2 Network analysis of OTUs between samples obtained Venn diagram
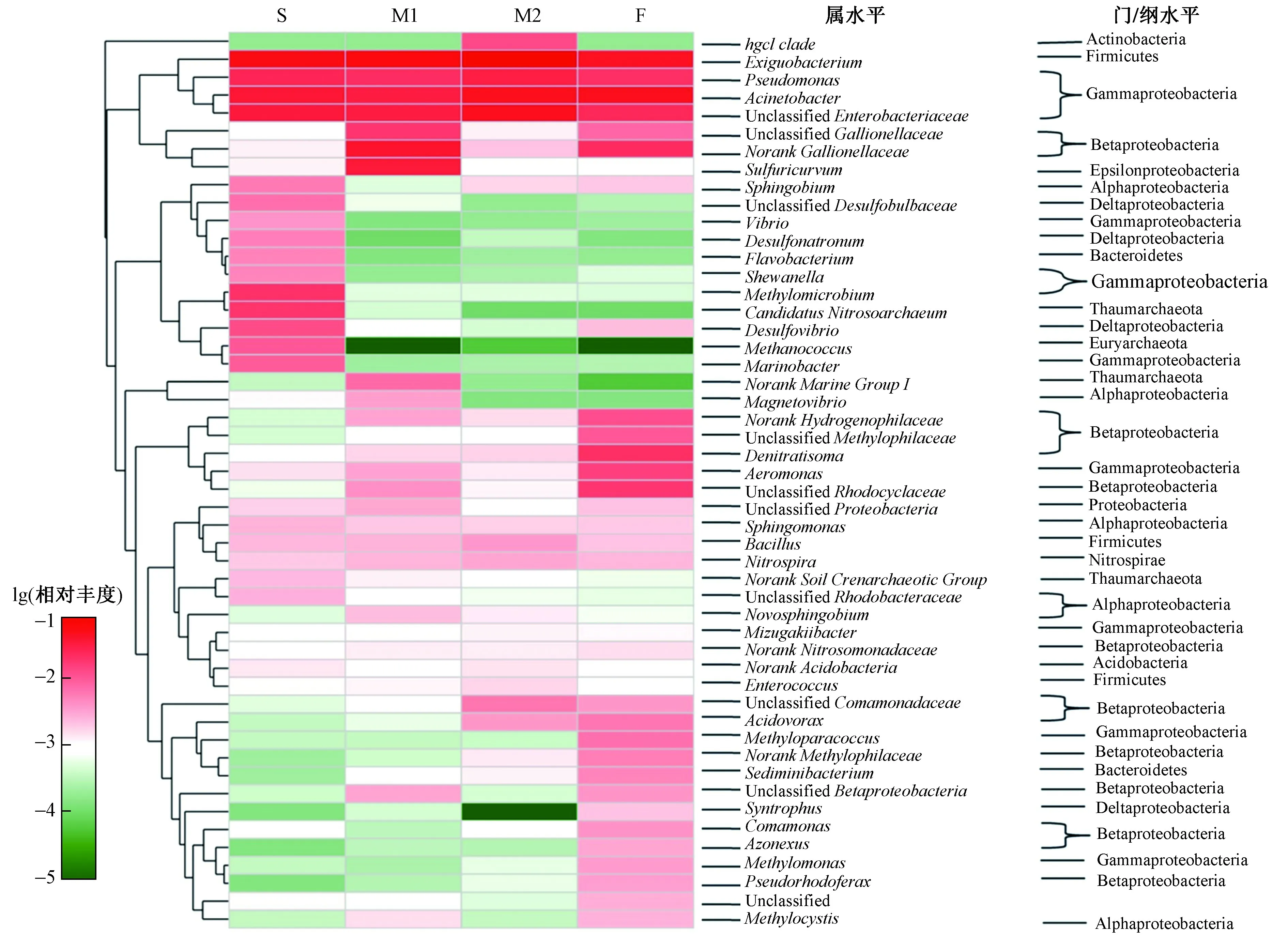
图 3 不同盐度梯度下微生物群落(属水平)的相对丰度Fig.3 The relative abundance of microbial taxa (genus level) along the salinity gradient
2.4 微生物群落结构及其与环境因子的相互关系
对微生物群落与主要环境因子进行典型相关分析. 结果显示,前两个CCA 轴中的环境参数共同解释了微生物群落组成差异的23.7% (见图4),TDS 浓度(r2=0.63,P=0.001)和TN 浓度(r2=0.8,P=0.001)对微生物分布的影响最强,而温度是最弱的环境变量. Spearman 相关分析(见表1)表明,厚壁菌相对丰 度与ORP 及HCO3—、DO 浓度均呈显著负相关(P<0.05). 拟杆菌相对丰度与ORP、pH 均呈显著正相关,与Fe2+浓度呈显著负相关,而α-变形杆菌相对丰度与TP 浓度呈显著正相关(P<0.05). β-杆菌相对丰度与HCO3—浓度呈显著正相关,与Cl—、TDS 浓度均呈显著负相关(P<0.05). γ-变形菌纲相对丰度与TN浓度呈显著正相关(P<0.01). 在属水平上,短小杆菌属相对丰度与HCO3—、DO 浓度均呈负相关,不动杆菌属相对丰度与HCO3—浓度呈负相关,假单胞菌属相对丰度与ORP 及HCO3—、DO 浓度均呈负相 关(P<0.05).
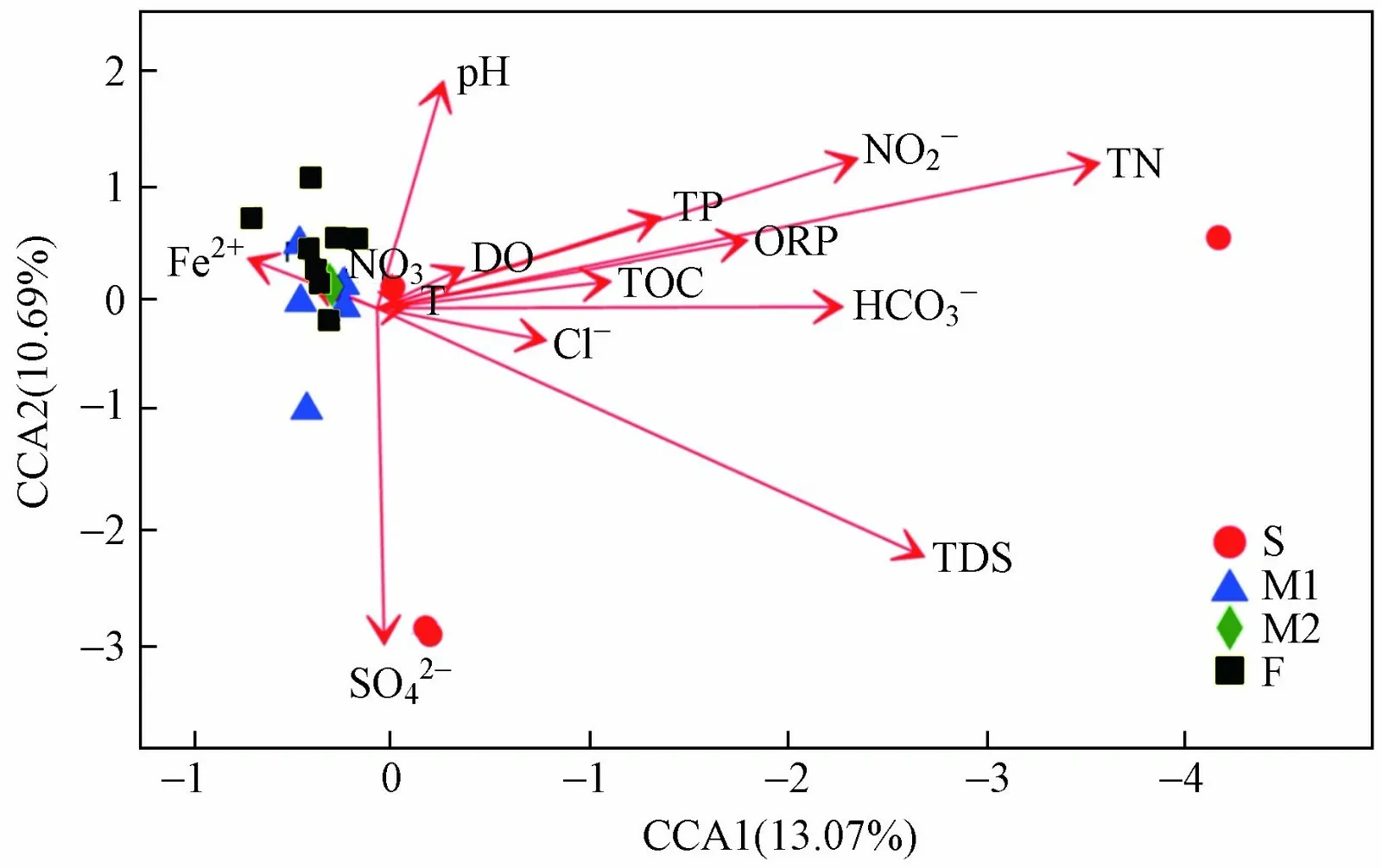
图 4 微生物群落结构与环境因子的典范对应分析Fig.4 CCA analysis between microbial community structure and environmental fact
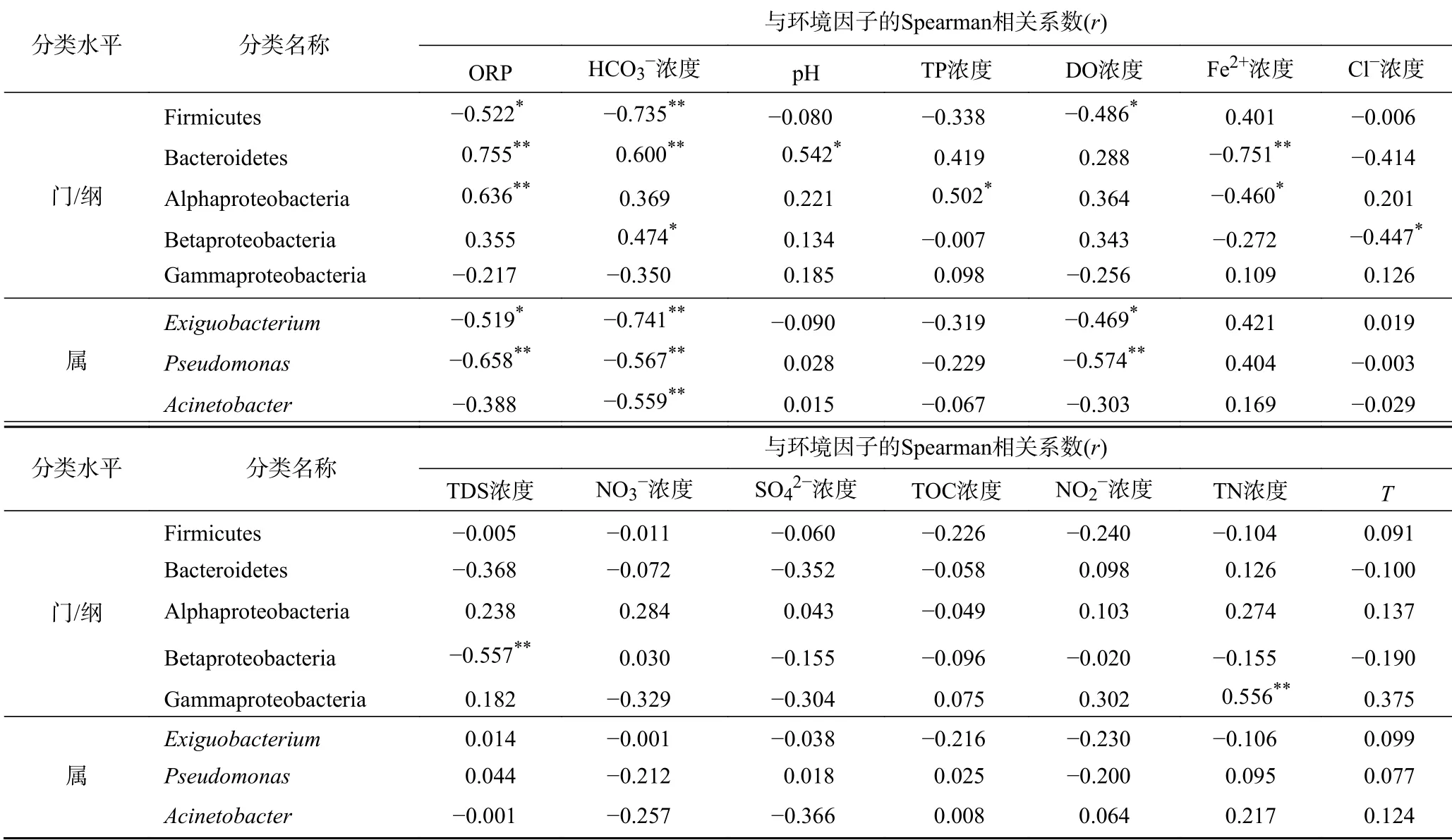
表 1 水体样品在不同分类水平上的微生物群落相对丰度与环境因子之间的Spearman 相关性分析Table 1 Environmental factors associated with variations of the microbial communities at the phylum/class or genus level in the four water samples
3 讨论
3.1 微生物的丰富度和多样性
长期以来,对水体盐度梯度下微生物多样性的研究主要集中在地表水系统[31-32]. 该研究揭示了地下水中原核微生物群落的丰富度和多样性,这些原核微生物所在的地下环境具有复杂的地球化学性质,可能发生了剧烈的生物地球化学过程. 由Chao1 和Shannon-Wiener 多样性指数反映的微生物群落丰富度和均匀度沿盐度梯度发生了变化,但变化并不明显. 总体而言,在重度咸水(TDS 浓度>10 g/L)中观察到的微生物群落丰富度和多样性最高,其次是淡水. 该研究结果与在海湾河口[33]和原始含水层[34]中观察到的结果相反,他们认为盐度的增加会导致细菌多样性的减少,而在相对稳定的波罗的海河口[35], Shannon-Wiener多样性指数沿盐度梯度的变化不明显. 在微咸水(1 g/L<TDS 浓度<3 g/L)样品中发现微生物群落的丰富度和均匀度最低,也就是说,虽然微生物多样性并没有完全遵循盐度梯度变化规律,但在TDS 浓度>1 g/L 的咸水中,微生物群落多样性随着盐度的增加而增加[23,36-37]. 因此,微生物群落的α-多样性与其所处的环境条件关系非常密切. 在环境波动较大的水体环境中[33-34],地下水中微生物的Shannon-Wiener 多样性指数由秋冬季的3.22±0.28显著变化为春夏季的1.31±0.35,这是由于营养盐、有机碳的输入以及地下水位的强烈波动,引起微生物群落多样性在不同季节具有显著性差异. 而在该研究中,地下环境条件相对比较稳定,微生物的多样性的变化并不明显.
3.2 微生物的群落结构
结果显示,地下水中的优势菌群是变形菌门、厚壁菌门、放线菌门和拟杆菌门,与其他研究结果[38-39]相似,而古菌的群落结构主要是奇古菌门和广古菌门. 值得注意的是,γ-变形菌纲丰富度在所有样本中都比较高(见图1). 一般来说,海水中的优势细菌是α-或γ-变形菌纲,β-变形细菌在淡水中占优势[40-41]. 该研究中,与咸水样品相比,淡水样品中的β-变形菌纲占比相对较高. 在咸水中检测到丰度较高的类群主要包括脱硫弧菌属、甲烷球菌属和海洋杆菌属,在其他样品中几乎未检出(见图3). 脱硫弧菌属和产甲烷球菌属中存在丰富的异养厌氧微生物,表明样品的氧化还原电位较低. 先前的地质调查中就发现地层中有大量的甲烷气体和臭鸡蛋味的硫化氢气体,表明含水层中存在微生物硫酸盐还原和产甲烷作用[20]. 该研究中一些高浓度咸水样品中检测到的脱硫弧菌属和甲烷球菌厌氧微生物,可能是地层中二氧化硫和甲烷气体生成的微生物类群. 在咸水样品中有丰度较高的海洋杆菌属,是嗜盐或者耐盐性的物种,一般生存在海洋环境中[42],而这些海洋物种序列很可能是在海水入侵的作用下被带入海滨含水层. 在其他海滨土壤的研究中也发现了海洋物种序列[43],研究者认为很可能是由于海水入侵作用被带入海滨土壤. 这也表明了海滨含水层是海洋与内陆物种交换的重要场所,对微生物的地理分布起到一定作用[44].
较长的水体停留时间和相对稳定的环境有助于建立稳定的土著微生物群落生态系统[39]. 咸水与淡水微生物群落组成差异较大(见图3),然而维恩图结果(见图2)显示,不同盐度水体之间存在大量共有的OTUs,表明咸水与淡水之间可能存在着紧密的流动和交换联系[20].
3.3 微生物群落与环境的关系
一般认为,水生微生物群落结构的时空变化和分布是环境因素综合作用的结果. 该研究中,微生物群落与主要环境因子的典型相关分析表明,前两个CCA 轴中的环境参数共同解释了微生物群落组成差异的23.7% (见图4),TDS 浓度(r2=0.63,P=0.001)和TN 浓度(r2=0.8,P=0.001)对微生物分布的影响最强,而温度的影响最弱. 根据对不同生态环境的全球调查结果,盐度被视为是微生物群落变异的主要环境影响因子[45-46]. 该研究结果表明,TDS 和TN 是微生物群落最有力的驱动因素(见图3). 盐度是一个至关重要的环境变量,它与β-变形菌纲丰度呈负相关,这与在黄海沿岸海底地下水中的研究结果[14]一致. 有研究[21]表明,珠江三角洲地下水体中存在高达8.6×109kg 的氨氮污染物,并且这些数量巨大的氨氮有机物从地下弱透水层不断释放,可以解释TN 对微生物群落的重要影响. 根据广东省水文地质调查结果,珠江三角洲地下水中氨浓度高达560 mg/L,主要源于上覆的全新世-更新世中富含有机质的含水层,通过地下水输送扩散进入含水层[21],可能会逐渐迁移到河水和沿岸海水中,破坏生态平衡,需引起高度重视.
4 结论
a) 珠三角地区海水入侵区含水层中原核微生物群落中细菌以变形菌门、厚壁菌门、放线菌门和拟杆菌门为主,而古菌以奇古菌门和广古菌门为主,且古菌在咸水中丰富度更高.
b) 环境条件相对比较稳定的含水层中,微生物多样性变化并不明显.
c) 该研究中对地下水微生物群落影响最大的环境因子是溶解性总固体(TDS)和总氮(TN)浓度,含水层中大量的氨氮可能会对生态平衡造成一定影响,需引起高度重视.
