PET/CT在不可手术的早期肺癌立体定向放疗中的应用
2022-06-22陈奎妃陈梦侯利桥孟胤男王微周苏娜杨海华
陈奎妃 陈梦 侯利桥 孟胤男 王微 周苏娜 杨海华
[摘要] 肺癌是世界范围内最常见的癌症之一,也是目前癌症死亡的主要原因。近年来随着低剂量CT筛查的普及,早期肺癌的发现率逐步提高。随着放疗设备及技术的不断发展,特别是体部立体定向放射治疗(SBRT)在早期不能手术的肺癌患者治疗中的地位愈加重要,已成为不可手术的早期肺癌的标准治疗方式。正电子发射计算机断层显像(PET/CT)通过对肿瘤病灶进行定性和定量分析,可以明确肺癌诊断分期,指导放射治疗中的靶区勾画,同时也提供更丰富的后期生物学评估的方法。该文就PET/CT在不可手术的早期肺癌SBRT前、中、后的应用进行概述。
[关键词] 肺癌;SBRT;PET/CT;直线加速器
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2022)12-0192-05
[Abstract] Lung cancer is one of the most common cancers in the world and the leading cause of cancer death. In recent years, with the popularization of low-dose CT screening, the detection rate of early-staged LC has gradually increased. With the continuous development of radiotherapy equipment and technology, especially stereotactic body radiation therapy (SBRT) has been increasingly important in the treatment of patients with medically inoperable LC at early stage, and has become the standard treatment for medically inoperable LC at early stage. Positron emission tomography/computed tomography (PET/CT) can clarify the diagnosis and staging of LC through qualitative and quantitative analysis of tumor lesions, guide the target delineation in radiotherapy, and provide more abundant methods for later biological evaluation. This article summarizes the application of PET/CT before, during and after SBRT for treating inoperable LC at early stage.
[Key words] Lung cancer; SBRT; PET/CT; Linear accelerator
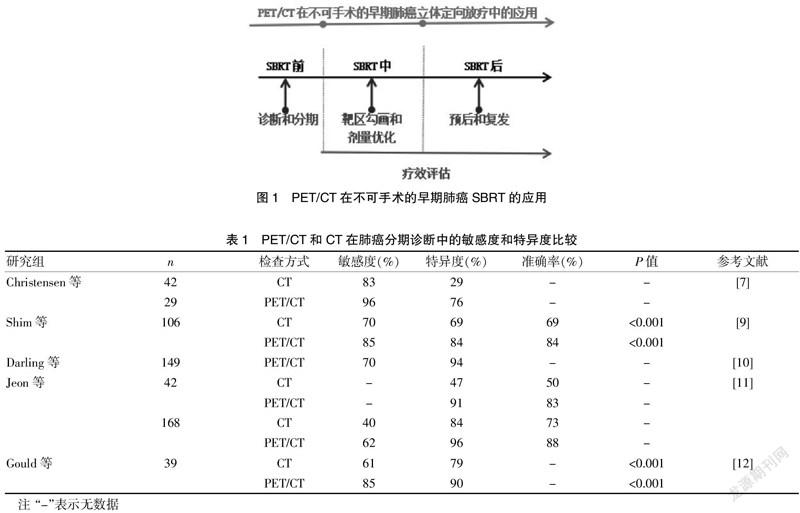
据近年对全球癌症发生的统计显示,肺癌是世界范围内最常见的癌症之一(约占11.6%),也是目前癌症死亡的主要原因(约占18.4%)[1]。在高危人群中开展肺癌筛查,是有效降低肺癌发病率和死亡率的重要策略。目前,低剂量螺旋CT检查已成为肺癌筛查和早期诊断最常用的临床工具。有研究证明,低剂量螺旋CT的筛查阳性率为X线的3倍,检出肺癌的能力为X线的4倍,检出Ⅰ期肺癌的能力为X线的6倍[2]。在早期肺癌患者的治疗中,对于那些存在心脏或肺部基础疾病而无法忍受手术的患者而言,放疗是重要的治疗方式之一。近年来随着放疗设备及技术的不断发展,体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)目前已在早期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗中得到很好的应用。一项多中心研究表明,接受SBRT的肿瘤患者3年生存率为55.8%,不仅局部肿瘤控制率高,而且与治疗相关的不良反应也较小[3]。作为目前临床上常用的影像学检查技术之一,正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)是将PET和CT影像同机融合的设备,具有早期、安全、准确、快速、性价比高的特点,在肿瘤的检查和治疗中发挥着重要作用。PET/CT通过提供肿瘤病变的生物学特征,如代谢、缺氧和增殖的信息,来判断肿瘤的诊断分期、改善靶区体积的勾画、识别耐辐射区域、指导制定个体患者的治疗方案[4]。见图1。该文将就PET/CT在不可手术的早期肺癌立体定向放疗前、中、后的应用进行概述。
1 PET/CT在不可手术的早期肺癌SBRT前的应用
1.1 PET/CT与肺癌病理诊断
肺内病灶定性的金标准是通过侵入性检查获取病理学诊断依据,这些检查主要包括纤维支气管镜活检、CT引导肺穿刺活检等,但只能确诊85%的肺部病变[5-6]。PET/CT功能代谢显像的特点决定其往往在病灶尚未发生形态学改变的早期,通过非侵入性检查便可发现组织器官的异常代谢,并能根据原发肿瘤中氟脱氧葡萄糖(fluorodeoxyglucose,FDG)的攝取情况,以最大标准化摄取值(maximum standardized uptake value,SUVmax)的量化实现对肺内孤立性结节良恶性的鉴别。Christensen等[7]曾用PET/CT对性质不明的肺内孤立性结节进行诊断,发现PET/CT的敏感度、特异度、阳性预测值、阴性预测值分别为96%、76%、86%、93%。在部分肺不张合并肺癌的患者中,PET/CT也可对病变组织进行较好的鉴别,Gerbaudo等[8]对21例肺不张合并肺癌的患者行PET/CT检查,发现肺不张的SUVmax总体低于肿瘤组织的SUVmax,但始终高于正常肺组织的SUVmax,这表明通过比较SUVmax的大小可区别不张的肺组织与肿瘤组织。与侵入性的病理检查相比,PET/CT在通过无创操作实现对肿瘤病灶的良恶性鉴别方面具有一定的优势。5C60DB5C-EB6C-4E49-9A10-ECCEABAB363E
1.2 PET/CT与肺癌分期诊断
确定肺癌的分期通常需要借助影像学检查及侵入性手术,而PET/CT可通过非侵入性操作对全身进行检查,以明确原发病灶及远处转移病灶的位置与性质。Shim[9]的研究表明,PET/CT在肺癌的诊断分期方面优势较CT明显。在Darling等[10]的研究中,PET/CT可广泛用于NSCLC分期,其敏感度、特异度、阳性预测值、阴性预测值分别为70%、94%、64%和95%。此外,Jeon等[11]的研究结果还证实在诊断淋巴结转移方面,PET/CT的敏感度及特异度也均优于CT。Gould等[12]的研究也表明PET/CT对纵隔淋巴结分期比CT更准确。在Groen等[13]的研究中,对102例可切除的NSCLC患者进行CT分期和PET分期,结果显示,CT检测到纵隔转移的敏感度和特异度分别为75%和66%,而PET的对应值为91%和86%,PET还发现了11例CT分期未发现的远处转移,这表明PET可提高NSCLC患者局部和远处转移的检出率。因此认为,与CT检查相比,PET/CT在判断肺癌原发病灶和远处转移病灶方面具有较高的敏感度和特异度。见表1。
2 PET/CT在不可手术的早期肺癌SBRT中的应用
2.1 PET/CT指导靶区勾画
放疗需要对肿瘤进行精准的靶向定位,传统上依赖于CT等解剖成像方法,但CT在识别肺癌合并肺不张、阻塞性肺疾病及判断纵隔淋巴结转移时存在局限性,因此PET/CT等联合成像的方法更有吸引力。Spratt[14]通过对11例NSCLC患者利用PET/CT进行的初始分期和放疗计划回顾性分析,发现PET/CT通过鉴别肺不张和阻塞性肺炎与肿瘤,使得患者原发肿瘤大体肿瘤体积(gross tumor volume,GTV)降低36%,结合另外检查到的额外肿瘤负荷,患者GTV升高27%,研究显示在原发肿瘤负荷、淋巴结累及、远处转移的情况下,PET/CT可改变GTV,扩大肿瘤放疗靶区。Bradley等[15]比较PET联合CT和单纯CT模拟治疗对放疗靶区体积的影响,发现PET联合CT的模拟治疗提高了30%~60%患者GTV的覆盖精度。Faria等[16]对32例NSCLC患者的术前胸部CT和PET/CT进行研究,评估PET/CT与CT对靶区体积勾画的影响,与单纯CT相比,PET/CT改变了18例(56%)例患者的GTV。
2.2 PET/CT特殊放射性摄取物指导生物学靶区及剂量应用进展
生物靶区是一系列肿瘤生物学因素决定的治疗靶区内放射敏感度不同的区域,PET/CT乏氧显像可以利用乏氧示踪剂的探测为放疗靶区的划定提供生物学信息,结合调强放疗技术优化剂量分布,以改善对局部肿瘤的控制。目前应用最广泛的PET/CT乏氧显像剂是18F-硝基咪唑丙醇(18F-fluoromisonidazole,18F-FMISO),18F-FMISO易被还原成氧自由基,与细胞大分子结合后滞留在缺氧的肿瘤细胞中,较高的亲脂性和较慢的血浆清除率导致其靶/本底比值低,在一定程度上限制了在临床上的应用[17]。除此以外,一种新型硝基咪唑类显像剂被开发出来,即18F-氟偶氮霉素阿拉伯糖苷(18F-Fluoroazatiomycin arabinoside,18F-FAZA),其具有稳定的酶活性,在大多数解剖区域显示出比18F-FMISO更有利的靶/本底比值,成为临床研究中非常具有前景的肿瘤乏氧放射性示踪剂[18]。
2.3 PET/CT直线加速器的研发进展
直线加速器是目前国内外用于肿瘤放疗的主流设备,通过磁场加速电子形成高能射线,对体内的肿瘤病灶进行照射,达到缩小或消灭肿瘤的目的。有研究者提出了一种辐射引导放射治疗(emission guided radiation therapy,EGRT),由快速旋转的闭环龙门上的直线加速器和PET探测器共同完成,PET探测器从肿瘤摄取部位收集响应线,直线加速器沿PET发射路径的相同轨迹传递治疗性辐射束,建立一个类似于PET重建图像的剂量分布,使生物适应性治疗成为可能[19]。目前,一种结合PET探测器的生物引导放射疗法(biology-guided radiation therapy,BGRT)也在开发中,其为首个在单一系统中融合PET/CT和放射治疗的方法,将PET探测器与高速环形直线加速器结合,使用放射性示踪剂作为肿瘤跟踪的生物基准,通过直接成像肿瘤来补偿设置的不确定性和内部运动,克服传统解剖成像方式对肿瘤敏感度和特异度的限制,指导放疗的实施[20]。这种BGRT的肿瘤追踪方法不同于EGRT,后者是直接针对放射示踪剂发射的同步伽马射线,严重依赖于一致的和特定的放射性示踪剂摄取,以剂量分布来勾画靶区和避免正常组织的[21]。未來PET/CT直线加速器在肿瘤治疗方面的作用将得到更深入的研究。
3 PET/CT在不可手术的早期肺癌SBRT后的应用
3.1 PET/CT的疗效评估:生物影像学疗效评估
SBRT治疗后肺癌患者的疗效、预后及复发均需定期评估,PET/CT在疗效评估中有着重要的作用。Van等[22]通过反复测量放疗第二周原发肿瘤中18F-FDG摄取,得出在治疗早期18F-FDG摄取的大量减少与总体生存率的提高相关的结论。Kohutek等[23]对211名明确接受SBRT治疗的Ⅰ期NSCLC患者进行研究,发现总体生存率与SUVmax、GTV和Karnofsky功能状态相关,疾病特异度生存仅与SUVmax相关(P=0.04),局部复发(P=0.02)和远处转移(P=0.006)也与较高的SUVmax相关。综上可见,18F-FDG摄取的大量减少和较低的SUVmax与早期NSCLC患者生存率的提高有关。
3.2 PET/CT的预后预测:影像组学疗效预测
PET/CT影像组学是通过计算机软件对PET和CT图像提取大量描述影像表型的定量特征,挖掘肉眼无法观察的数据信息,判断肿瘤对治疗的反应及进行预后分析。Ahn等[24]使用机器学习方法对93例NSCLC患者的影像组学特征与疾病复发之间的相关性进行分析,从PET图像中提取了35个独特的定量放射特征,发现邻近灰度差异矩阵的对比度和繁忙度是预测疾病复发的两个最佳预测因子。放射性反应的发生和疾病的远处转移对患者的预后有很大的影响,早发现、早治疗可提高早期肺癌SBRT的安全性和治疗后的生存率。Cunliffe等[25]对106例接受放疗患者的影像组学特征进行分析,发现放射组学具有能够提供定量的、个性化的衡量放疗疗效及评估放射性肺炎的能力。Coroller等[26]通过对肺腺癌CT图像的635个影像组学特征研究,发现35个影像组学特征与远处转移的预后有关,12个影像组学特征与生存率有关。5C60DB5C-EB6C-4E49-9A10-ECCEABAB363E
3.3 PET/CT的復发评估:复发或者纤维化的鉴别
早期肺癌患者在SBRT治疗后会出现急性放射性改变,且大剂量放疗后的晚期纤维化过程可能出现动态变化并持续多年,而CT很难区分SBRT后的纤维化与肿瘤复发。Takeda等[27]的研究证实CT扫描对诊断局部复发的能力有限,而18F-FDG PET/CT的SUVmax可以帮助SBRT治疗后的NSCLC患者早期发现局部复发。Hayashi等[28]的研究表示当PET/CT检查出现肿块样纤维化不透明、最大直径增大、SUVmax>5三种情况时,可考虑是SBRT后局部复发。Clarke等[29]对早期无法手术的NSCLC患者在SBRT前和SBRT后3个月的SUVmax进行比较,通过多因素分析得出SUVmax≥4.75与较高的远处转移(P=0.012)和较差的无复发生存(P=0.04)相关,SBRT后SUVmax≥2和SUVmax下降<2.55的患者远处转移明显更高,认为SUVmax与局部复发相关性最强,尤其是远处转移。
综上所述,SBRT是目前不可手术的早期肺癌患者的主要治疗方式之一,PET/CT在不可手术的早期肺癌SBRT前、中、后起着重要的作用。PET/CT可以帮助识别微小病灶的良恶性和淋巴结转移,明确诊断分期,排除放疗过程中肺癌合并肺不张、阻塞性肺炎等的影响,精确勾画靶区,以制定个体化的治疗方案,能够有效预防或降低对正常组织的损伤,且可在SBRT治疗后发现残留或复发的肿瘤,及时给予挽救性的治疗,提高患者的总体生存率。近年随着新型显像剂的出现,对肿瘤特征如增殖和缺氧更有特异度的示踪剂在临床逐渐得到推广应用,而最新PET/CT直线加速器的诞生,将更加直接的提供了生物影像学下的放射治疗,PET/CT在未来具有很好的应用前景。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2] Henschke CI,McCauley DI,Yankelevitz DF,et al. Early lung cancer action project: Overall design and findings from baseline screening[J].Lancet,1999,354(9173):99-105.
[3] Timmerman R,Paulus R,Galvin J,et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J].JAMA,2010,303(11):1070-1076.
[4] Fonti R,Conson M,Del Vecchio S. PET/CT in radiation oncology[J].Semin Oncol,2019,46(3):202-209.
[5] Schrevens L,Lorent N,Dooms C,et al. The role of PET scan in diagnosis,staging,and management of non-small cell lung cancer[J].Oncologist,2004,9(6):633-643.
[6] Gould MK,Maclean CC,Kuschner WG,et al. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions: A meta-analysis[J].JAMA,2001,285(7):914-924.
[7] Christensen JA,Nathan MA,Mullan BP,et al. Characterization of the solitary pulmonary nodule: 18F-FDG PET versus nodule-enhancement CT[J].AJR Am J Roentgenol,2006,187(5):1361-1367.
[8] Gerbaudo VH,Julius B. Anatomo-metabolic characteristics of atelectasis in F-18 FDG-PET/CT imaging[J].Eur J Radiol,2007,64(3):401-405.
[9] Shim SS,Lee KS,Kim BT,et al. Non-small cell lung cancer: Prospective comparison of integrated FDG PET/CT and CT alone for preoperative staging[J].Radiology,2005,236(3):1101-1109.
[10] Darling GE,Maziak DE,Inculet RI,et al. Positron emission tomography-computed tomography compared with invasive mediastinal staging in non-small cell lung cancer: Results of mediastinal staging in the early lung positron emission tomography trial[J].J Thorac Oncol,2011, 6(8):1367-1372.5C60DB5C-EB6C-4E49-9A10-ECCEABAB363E
[11] Jeon TY,Lee KS,Yi CA,et al. Incremental value of PET/CT Over CT for mediastinal nodal staging of non-small cell lung cancer: Comparison between patients with and without idiopathic pulmonary fibrosis[J].AJR Am J,2010,195(2):370-376.
[12] Gould MK,Kuschner WG,Rydzak CE,et al. Test performance of positron emission tomography and computed tomography for mediastinal staging in patients with non-small-cell lung cancer: A meta-analysis[J].Ann Intern Med,2003,139(11):879-892.
[13] Groen H,Houte JV,Pruim RJ,et al. Preoperative staging of non-small-cell lung cancer with positron-emission tomography[J].New England Journal of Medicine,2000,343(4):254.
[14] Spratt DE,Diaz R,McElmurray J,et al. Impact of FDG PET/CT on delineation of the gross tumor volume for radiation planning in non-small-cell lung cancer[J].Clin Nucl Med,2010,35(4)237-243.
[15] Bradley J,Thorstad WL,Mutic S,et al. Impact of FDG-PET on radiation therapy volume delineation in non-small-cell lung cancer[J].Int J Radiat Oncol Biol Phys,2004,59(1):78-86.
[16] Faria SL,Menard S,Devic S,et al. Impact of FDG-PET/CT on radiotherapy volume delineation in non-small-cell lung cancer and correlation of imaging stage with pathologic findings[J].Int J Radiat Oncol Biol Phys,2008,70(4):1035-1038.
[17] Lee N,Nehmeh S,Schder H,et al. Prospective trial incorporating pre-/mid-treatment18F-misonidazole positron emission tomography for head-and-neck cancer patients undergoing concurrent chemoradiotherapy[J].Int J Radiat Oncol Biol Phys,2009,75(1):101-108.
[18] Di Perri D,Lee JA,Bol A,et al. Correlation analysis of 18F-fluorodeoxyglucose and 18F-fluoroazomycin arabinoside uptake distributions in lung tumours during radiation therapy[J].Acta Oncol,2017,56(9):1181-1188.
[19] Mazin SR,Nanduri AS. Emission-guided radiation therapy: Biologic targeting and adaptive treatment[J].J Am Coll Radiol,2010,7(12):989-990.
[20] Shirvani SM,Huntzinger CJ,Melcher T,et al. Biology-guided radiotherapy: Redefining the role of radiotherapy in metastatic cancer[J].Br J Radiol,2021,94(1117):20 200 873.
[21] Fan Q,Nanduri A,Mazin S,et al. Emission guided radiation therapy for lung and prostate cancers: A feasibility study on a digital patient[J].Med Phys,2012,39(11):7140-7152.
[22] Van Elmpt W,Ollers M,Dingemans AM,et al. Response Assessment Using 18F-FDG PET Early in the Course of Radiotherapy Correlates with Survival in Advanced-Stage Non-Small Cell Lung Cancer[J].J Nucl Med,2012,53(10):1514-1520.5C60DB5C-EB6C-4E49-9A10-ECCEABAB363E
[23] Kohutek ZA,Wu AJ,Zhang Z,et al. FDG-PET maximum standardized uptake value is prognostic for recurrence and survival after stereotactic body radiotherapy for non-small cell lung cancer[J].Lung Cancer,2015,89(2):115-120.
[24] Ahn HK,Lee H,Kim SG,et al. Pre-treatment 18F-FDG PET-based radiomics predict survival in resected non-small cell lung cancer[J].Clin Radiol,2019,74(6):467-473.
[25] Cunliffe A,Armato SG 3rd,Castillo R,et al. Lung texture in serial thoracic computed tomography scans: Correlation of radiomics-based features with radiation therapy dose and radiation pneumonitis development[J].Int J Radiat Oncol Biol Phys,2015,91(5):1048-1056.
[26] Coroller TP,Grossmann P,Hou Y,et al. CT-based radiomic signature predicts distant metastasis in lung adenocarcinoma[J].Radiother Oncol,2015,114(3):345-350.
[27] Takeda A,Kunieda E,Fujii H,et al. Evaluation for local failure by 18F-FDG PET/CT in comparison with CT findings after stereotactic body radiotherapy (SBRT) for localized non-small-cell lung cancer[J].Lung Cancer,2013,79(3):248-253.
[28] Hayashi S,Tanaka H,Hoshi H. Imaging characteristics of local recurrences after stereotactic body radiation therapy for stage Ⅰ non-small cell lung cancer: Evaluation of mass-like fibrosis[J].Thorac Cancer,2015,6(2):186-193.
[29] Clarke K,Taremi M,Dahele M,et al. Stereotactic body radiotherapy(SBRT) for non-small cell lung cancer (NSCLC): Is FDG-PET a predictor of outcome?[J].Radiother Oncol,2012,104(1)62-66.
(收稿日期:2021-04-14)5C60DB5C-EB6C-4E49-9A10-ECCEABAB363E
