槲皮素对马铃薯酪氨酸酶 活性的影响以及机理研究
2022-06-22王露逸

槲皮素是一种五羟基黄酮,来源广泛,具有多种生物学活性和很高的药用价值。实验证明,黄酮类化合物对自由基、超氧阴离子均有良好的清除作用,除了抗炎作用,槲皮素还具有抗菌、抗病毒、抗糖尿病、免疫调节和心血管保护等作用,并有新的药理作用,比如抗抑郁、抗衰老等。
酪氨酸酶(EC1.14.18.1,Tyrosinase)普遍存在于微生物、动植物和人体中,具有双重催化作用,在生物体内是黑色素合成的关键酶,同时与人的衰老、昆虫的发育及伤口愈合、果蔬的褐变都有着密切关系。本文以L-多巴为底物,采用酶抑制动力学法研究了槲皮素对酪氨酸酶的抑制特性及类型,结果表明,槲皮素对马铃薯酪氨酸酶的抑制常数KI为2.23mg/mL,属于竞争性抑制剂,这对于开发槲皮素为抗氧化剂并研究其对马铃薯酪氨酸酶活性的影响具有指导性意义。
一、材料与仪器
1.实验材料。马铃薯、槲皮素、L-DOPA、磷酸氢二钠、磷酸二氢钠。
2.实验仪器。FA2004型分析电子天平、HH-6型数显恒温水浴锅、XW-80A漩涡混合仪、MK3酶标仪、KQ5200DB型数控超声波清洗器、冷冻干燥离心机以及超低温离心机。
二、实验与方法
1.酪氨酸酶提取液的制备。称取去皮切碎马铃薯(-20℃冷冻过夜),按1:5(m/V)的比例加入磷酸盐缓冲液2mL,用震荡机震荡1min后离心处理,倒出上清液。
2.酶活力的测定方法。配置浓度为25Mm、pH为6.8的磷酸盐缓冲溶液,将底物L-多巴溶解在上述磷酸盐溶液中,配置成浓度为0.8mg/mL的L-多巴溶液。取一个96孔板,先加入40μL上述L-多巴溶液,再加入80μL磷酸缓冲液(浓度25mM,pH6.8),立即放在震荡器上震荡,使其混合均匀。加入40μL马铃薯酪氨酸酶的磷酸缓冲溶液(25mg/mL,25mM,pH6.8)开始反应,在波长492nm下测定温孵前后每孔的吸光度。然后将96孔板在30℃条件下温孵20min,并在波长492nm下测定温孵后每孔的吸光度。
3.探究酶活力测定的最适条件。选取底物浓度、pH、马铃薯酪氨酸酶液提取时间、酶液加入量、反应温度这5个与酶活力相关的因素,探究酶活力测定的最适条件。分别配置浓度为0.40mg/mL、0.80mg/mL、1.20mg/mL、1.40mg/mL、2.0mg/mL的L-多巴溶液,测定酶活力;分别在试管中加入pH值为5.8、6.2、6.8、7.2、7.6、8.0的磷酸盐缓冲液,测定酶活力;分别设定0h、0.5h、1.0h、2.0h、3.0h的马铃薯酪氨酸酶提取时间,按照上述方法测定酶活力;取0.5g液氮冷冻后的马铃薯粉末,加入1.0mL磷酸盐缓冲溶液(25mM,pH6.8),等梯度稀释,酶液浓度分别为0.5g/mL、0.25g/mL、0.125g/mL、0.0625g/mL、0.03125g/mL,测定酶活力;加入酪氨酸酶提取液后,分别在20℃、30℃、40℃、50℃、60℃的不同温度水浴条件下测定酶活力。
4.槲皮素对马铃薯酪氨酸酶活力影响的测定及抑制率的计算。在96孔板中加入L-多巴(6mmol/L)及磷酸盐缓冲液(pH6.8),充分混匀,在30℃水浴中温育10min后加入40μL不同质量浓度(0mg/mL、0.125mg/mL、0.25mg/mL、0.5mg/mL、1mg/mL、2mg/mL)的槲皮素溶液,然后加入30μL酶提取液,立即充分混匀,测定OD492nm。具体操作如表1所示。
抑制率公式为:抑制率(%)=[(A-B)-(C-D)]/(A-B)x100
在上式中,A表示温孵后空白孔在波长492nm下的吸光度,B表示温孵前空白孔在波长492nm下的吸光度,C表示温孵后样品孔在波长492nm下的吸光度,D表示温孵前样品孔在波长492nm下的吸光度。
三、结果与分析
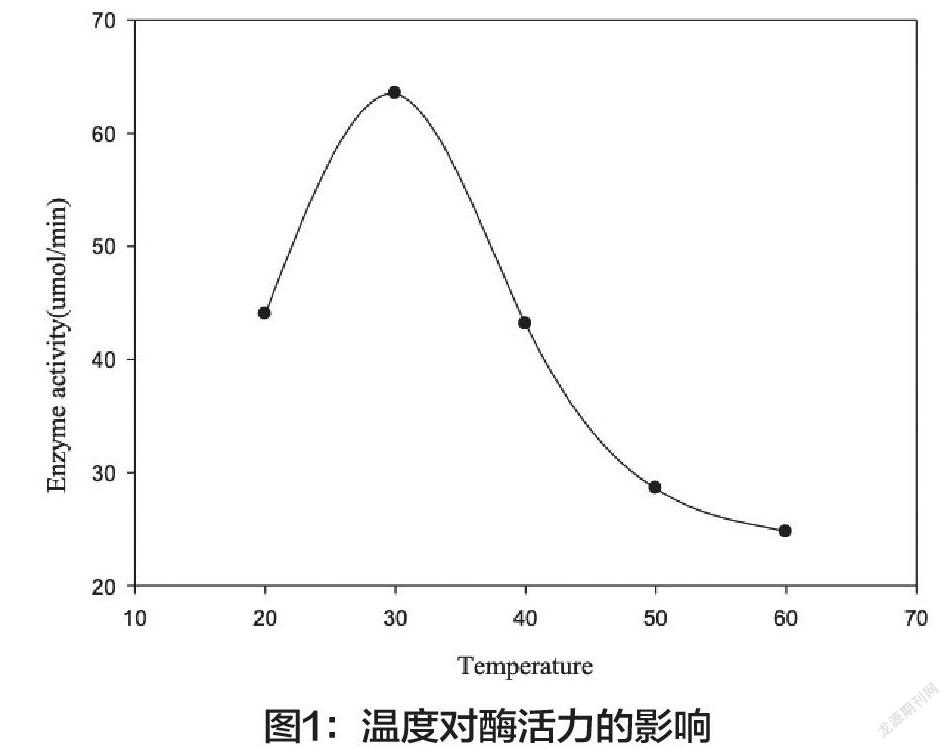
1.酶活力测定的最适条件。选取底物浓度、pH、酪氨酸酶液提取时间、酪氨酸酶液加入量、反应温度这5个酪氨酸酶活性的影响因素,探究酶活力测定的适宜条件。(1)当底物浓度为0.4mg/mL-2.0mg/mL时,酶活力随着底物浓度的增大而增加,达到1.2mg/mL后,随着底物浓度的增加,酶活力增加较为缓慢,故选择1.2mg/mL为最适底物浓度。(2)当pH为5.8-6.8时,酶活力随着pH的增大而增加;当pH小于6.8时,酶活力相对降低,故选择pH6.8为最适条件。但当pH大于7.6时,酶活力有一定的回升,需要考虑同工酶因素,并根据实验确定具体酶的类型。(3)马铃薯酪氨酸酶液储存在4℃冰箱中,2.0h内酶活力变化不大,但在2.0h后酶活力降低。因此,酶提取液应在2h内用完,在此时间内使用酶提取液,酶活力变化对实验结果造成的影响较小。(4)当酪氨酸酶提取液浓度小于0.25g/mL时,酶活力与酶液浓度基本呈线性关系。当酶液浓度大于0.25g/mL时,酶活力增长缓慢,说明酶提取液已近饱和,故选择0.25g/mL匀浆为最佳浓度。(5)酪氨酸酶在30℃时活力最高,温度升高或降低,酶活力均下降(图1)。
底物浓度、pH、酪氨酸酶液提取时间、酪氨酸酶液加入量、反应温度这5因素对酪氨酸酶的活性均有一定影响。当底物浓度为1.2mg/mL,酪氨酸酶液提取后2h内,酪氨酸酶液浓度为0.25g/mL,温孵温度为30℃,pH为6.8时,为酶活力测定的适宜条件。由于酪氨酸酶是从马铃薯中自提的,所以得到的最适条件会存在不同。因此本实验选用同一批马铃薯提取出的酪氨酸酶,并在較短时间内用完,尽可能减小实验误差。
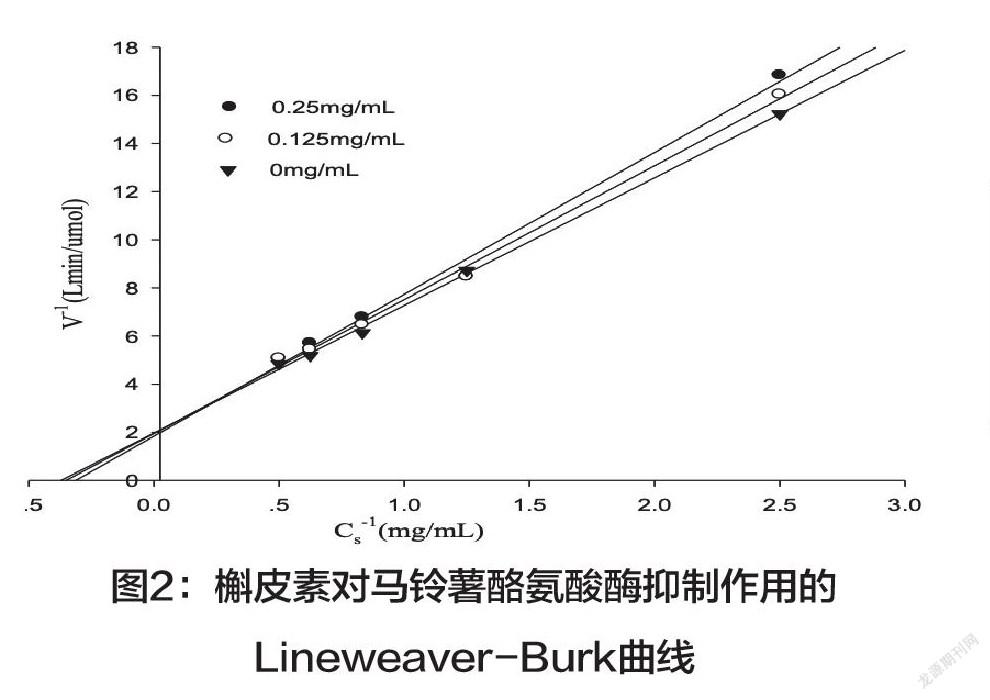
2.槲皮素对马铃薯酪氨酸酶的抑制动力学分析。在测酶活体系中,固定加入酶量,改变底物L-多巴的浓度,测定酶在不同浓度抑制剂下的催化活力。以酶反应的初速度的倒数对底物浓度Cs作图,为一组双曲线,说明酶促反应遵循米氏动力学方程(表2)。以Lineweaver-Burk双倒数作图,可以判断槲皮素对该酶的抑制作用类型,结果如图2所示,Lineweaver-Burk双倒数作图在一组现行坐标点相交,直线横轴截距随槲皮素质量浓度的改变而发生改变,而纵轴截距保持不变,表现为竞争型抑制。二次作图,以斜率对槲皮素质量浓度作回归直线(图3),可以求出槲皮素对马铃薯酪氨酸酶的抑制常数(KI)为2.23mg/mL。
四、讨论与结论
本研究分析了酶液加入量、底物浓度、温度等单个因素对马铃薯酪氨酸酶活力的影响,结果发现每个因素对酪氨酸酶的活性均存在不同程度的影响。酶活力测定的适宜条件为:底物浓度1.2mg/mL、酪氨酸酶液浓度0.25g/mL、反应温度30℃、pH6.8。本研究显示,槲皮素对马铃薯酪氨酸酶的抑制作用类型为竞争型抑制,槲皮素因为结构与底物L-多巴相似,能够与酪氨酸酶的活性中心结合,通过与底物竞争,导致酶活力下降,其对马铃薯酪氨酸酶的抑制常数为2.23mg/mL。
槲皮素是酪氨酸酶抑制剂,马铃薯内的酪氨酸酶同样受到槲皮素的抑制影响。管骁等采用的酪氨酸酶是纯品,本实验使用的酪氨酸酶是马铃薯提取物,纯酶和粗酶的酶活力不同,对相同底物的影响也不同。同时,马铃薯内酪氨酸酶的提取过程受到多种因素影响,比如温度、pH等,最终导致的结果是,与槲皮素对酪氨酸酶纯品的抑制率相比,槲皮素对马铃薯提取酪氨酸酶的抑制率较低。
本文通过酶抑制动力学实验,研究了槲皮素对马铃薯酪氨酸酶的抑制特性及其机理。结果表明,槲皮素是马铃薯酪氨酸酶的竞争性抑制剂,抑制常数为2.23mg/mL,该研究可以为酪氨酸酶竞争性抑制剂的分子设计提供一定的参考依据。
作者简介:王露逸(1993-),女,汉族,山东青岛人,硕士研究生,研究方向为食品营养及检验。
