干旱胁迫下大蒜叶绿素合成基因家族鉴定分析
2022-06-21王紫彤周倩怡
王紫彤, 周倩怡, 田 洁,b,①
(青海大学: a. 农林科学院 青海省蔬菜遗传与生理重点实验室, b. 省部共建三江源生态与高原农牧业国家重点实验室, 青海 西宁 810016)
大蒜(AlliumsativumLinn.)为百合科(Liliaceae)葱属(AlliumLinn.)植物,又称胡蒜、蒜。大蒜栽培历史悠久,具有重要的营养和药用价值,是青海省露地主栽蔬菜之一[1,2]。大蒜作为一种浅根性作物,耐旱性较弱[3,4],而青海东部农业区易发生旱灾,并且春季和夏季是大蒜生长的关键时期,也是旱灾发生的高频时期[5],因此在高原大蒜生产过程中,干旱胁迫对大蒜的正常生长、产品品质以及经济效益均造成不利影响。在干旱生长环境中,大蒜叶片的形态结构和生理功能,尤其是光合特性会发生一系列变化[6],且干旱胁迫影响大蒜叶绿素的合成,抑制叶绿体的发育,从而使大蒜的光合效率降低,生长迟缓[7]。
叶绿素生物合成是一个涉及多步反应且十分复杂的过程,有多种酶和基因参与[8]。目前已有研究证实拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕的叶绿素生物合成大致需要15步反应,包含起催化作用的17种酶和27种编码基因[9]。叶绿素合成的第1步是由L-谷氨酰-tRNA合成原卟啉Ⅸ,其中的编码基因HEMA、HEMB、GSA、HEMC、HEMD、HEME、HEMF和HEMG已从拟南芥[8]和水稻(OryzasativaLinn.)[10]中分离获得;第2步由原卟啉Ⅸ合成叶绿素,相关催化酶基因有CHLD、CHLH、CHLI、CHLM、CRD1、DVR、POR、CHLG和CAO[11],已在大麦(HordeumvulgareLinn.)[11]、烟草(NicotianatabacumLinn.)[12]和玉米(ZeamaysLinn.)[13]等植物中被鉴定得到。叶绿素合成基因家族成员虽已在模式植物和一些禾本科(Poaceae)作物中鉴定到并进行了功能分析,但对于一些追求高品质、高产量的经济作物来说,对其叶绿素合成基因家族进行系统分析,探究其调控机制是亟待解决的问题。
叶绿素合成基因在逆境胁迫应答过程中发挥着重要作用。黄蔚[14]发现,极端温度条件下,芹菜(ApiumgraveolensLinn.)的17个叶绿素合成基因分别通过显著上调或下调其表达水平应答环境温度的变化。李翠[15]将酿酒酵母5-氨基乙酰丙酸(ALA)合酶基因(YHem1)转入番茄(LycopersiconesculentumMill.),盐胁迫下转基因植株的HEMA、HEMB和GSA基因通过上调或下调表达来应答胁迫。张修德等[16]认为,聚乙二醇(PEG)模拟的干旱能够诱导苹果(MaluspumilaMill.)组培苗HEMA基因表达量增加,从而抵御干旱胁迫。目前,对于逆境胁迫下大蒜叶绿素合成的研究多集中于生理指标[17,18],大蒜中叶绿素合成基因家族成员尚未被鉴定,相关基因家族成员的功能和作用机制尚未完全清晰。
本研究基于前期干旱胁迫大蒜转录组测序结果(未公布),筛选出响应干旱胁迫的大蒜叶绿素合成基因家族,结合实时荧光定量PCR(qRT-PCR)分析其在干旱胁迫下的表达情况,并利用生物信息学方法对其进行综合鉴定和分析,以期为进一步研究大蒜叶绿素合成基因家族的生物学功能奠定基础,并为大蒜在干旱胁迫下提高光合效率、延缓衰老和增强适应性等方面提供理论参考。
1 材料和方法
1.1 材料
供试材料为青海省特色大蒜品种‘乐都紫皮大蒜’(‘Ledu Purple Skin Garlic’),选取蒜瓣较饱满、大小均匀、表面光滑、色泽光亮且已经解除休眠的大蒜鳞茎,于2021年3月播种在栽培基质为珍珠岩、蛭石和草炭(体积比1∶1∶2)的盆(口径12 cm、底径9 cm、高12 cm)中,每盆栽种1个鳞茎,共60盆。然后置于植物光照培养箱中,培养条件为:昼温25 ℃,夜温15 ℃,光照时间14 h·d-1,光照度12 000 lx,空气相对湿度70%左右。培养至大蒜幼苗期(株高10 cm左右)时进行干旱胁迫处理。
1.2 方法
1.2.1 干旱胁迫处理 参照铁原毓等[19]的方法通过停止浇水进行人工控水,保持空气相对湿度30%,参照杨彦会等[20]的方法控制土壤相对湿度为45%~55%,其他培养条件不变。各处理设置3个重复。分别于处理0(CK)、3、6、9、12和15 d取样。每个重复取长势均匀的5株大蒜植株上部的幼嫩叶片,取样后立即放入液氮中冷冻,然后置于-80 ℃冰箱中保存、备用。
1.2.2 叶片总RNA的提取 利用TRNzol Universal总RNA提取试剂〔天根生化科技(北京)有限公司〕提取大蒜叶片总RNA,采用质量体积分数1%琼脂糖凝胶电泳检测总RNA的完整性,利用TGem微量分光光度计(OSE-260)〔天根生化科技(北京)有限公司〕检测总RNA质量。
1.2.3 cDNA文库构建与转录组测序 上述RNA样品交由北京诺禾致源科技股份有限公司测序。首先构建叶片cDNA文库,库检合格后进行Illumina HiSeq测序。测序片段经CASAVA碱基识别转化为序列数据(raw reads),过滤后得到clean reads,基于此测序数据进行后续分析。
1.2.4 叶绿素合成基因筛选 将由转录组测序得到的 大蒜unigenes序列与NR、NT、Pfam、KOG/COG、Swiss-Prot、KEGG和GO数据库进行基因功能注释,获得unigenes的蛋白功能注释信息后,参考张少平等[21]的方法筛选被注释的叶绿素合成基因。
1.2.5 转录组表达分析 对不同干旱胁迫时间大蒜叶绿素合成基因转录组数据的FPKM值(每千个碱基的转录每百万映射读取的碎片)进行统计,以FPKM值大于0.3作为基因表达的阈值,统计FPKM值大于0.3的unigenes,分析其在不同干旱胁迫时间的表达水平和表达模式,使用TBtools软件绘制大蒜叶绿素合成基因表达热图,筛选unigenes表达量较高的叶绿素合成基因家族进行后续的鉴定与分析。
1.2.6 qRT-PCR分析 为验证转录组数据的可靠性,同时进一步分析筛选到的叶绿素合成基因的表达情况,采集不同干旱胁迫时间的大蒜叶片进行qRT-PCR分析。按照HonorTMⅡ1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)反转录试剂盒(天津诺禾致源生物信息科技有限公司)说明书合成cDNA。从大蒜转录组数据筛选出的unigenes表达量较高的叶绿素合成基因家族中,随机选取1个unigene进行验证,利用Primer Premier 5.0设计qRT-PCR引物后交由生工生物工程(上海)股份有限公司合成,引物序列见表1,然后进行qRT-PCR检测,每个样品3次技术重复。

表1 大蒜叶绿素合成基因家族部分unigenes的引物序列及其退火温度
qRT-PCR反应体系总体积为20.0 μL,包括SYBR Green Master Mix(天津诺禾致源生物信息科技有限公司)10.0 μL、10 μmol·L-1正向和反向引物各0.6 μL、100 ng·μL-1cDNA 1.0 μL、ddH2O 7.8 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、相应温度退火30 s(退火温度见表1)、72 ℃延伸150 s,共35个循环。每个样品3次技术重复。选取大蒜CYP基因作为内参基因,采用2-ΔΔCT计算目的基因的相对表达量。
1.2.7 蛋白质理化性质分析 利用ExPASy网站中的ProtParam在线工具(https:∥www.expasy.org/resources/protparam/)预测大蒜叶绿素合成基因家族unigenes编码氨基酸序列的理论相对分子质量、理论等电点、不稳定指数、脂溶系数和总平均亲水性等。
1.2.8 氨基酸序列多重比对及进化树分析 将大蒜叶绿素合成基因家族unigenes编码氨基酸序列在NCBI数据库中通过BLAST比对,选择相似性高且已在其他植物中鉴定到的叶绿素合成基因编码氨基酸序列,使用Mega X的最大似然法(maximum likelihood,ML)构建系统进化树,校验参数Bootstrap值设置为重复1 000次。通过Evolview(https:∥www.evolgenius.info/evolview/)对进化树进行优化。
1.2.9 保守基序分析 使用在线分析软件MEME(https:∥meme-suite.org/meme/tools/meme)对不同大蒜叶绿素合成基因家族unigenes编码的氨基酸序列分别进行保守基序分析,基序的最大数量设置为3~5,将得到的meme.xml文件放入TBtools进行结构可视化,并绘制图形。
1.3 数据统计和处理
采用SPSS 25.0软件中的Duncan’s新复极差法(p<0.05)对实验数据进行差异显著性分析[22],采用Origin 2021软件绘制图表。
2 结果和分析
2.1 叶绿素生物合成基因的筛选
从大蒜转录组序列中筛选出160个与叶绿素合成相关的unigenes,经鉴定被注释为17个叶绿素合成基因家族(表2)。其中被注释数量最多的是AsHEMG基因家族,共有43个unigenes。在L-谷氨酰-tRNA到原卟啉Ⅸ的合成途径中,σ-氨基酮戊酸(ALA)的合成是叶绿素合成过程中一个重要的控制点[23],编码的基因家族为AsHEMA和AsGSA,分别注释到5和2个unigenes。从原卟啉Ⅸ到叶绿素的合成途径中,金属离子插入原卟啉Ⅸ是叶绿素合成过程中另一个重要的分支点[24],编码的基因家族为AsCHLH、AsCHLI和AsCHLD,分别注释到7、6和5个unigenes。
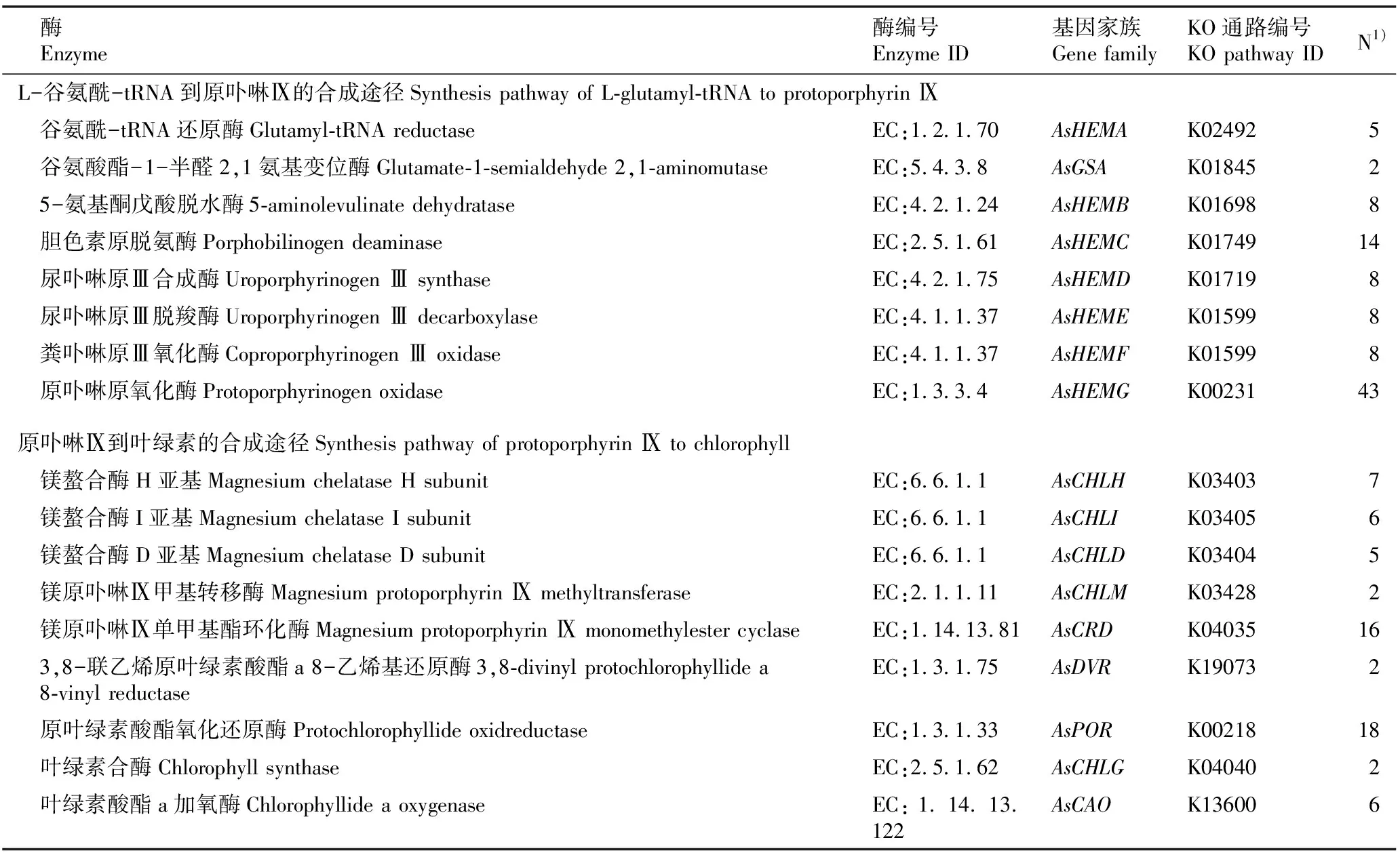
表2 大蒜叶绿素合成基因的筛选信息
2.2 转录组表达分析
干旱胁迫下大蒜叶绿素合成基因家族unigenes表达热图见图1。结果显示:17个大蒜叶绿素合成基因家族unigenes响应干旱胁迫的模式大致分为2种:AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO基因家族unigenes在干旱胁迫6 d时相对表达量明显增加,达到峰值,积极响应干旱胁迫;而AsHEMC、AsHEMD、AsHEME、AsHEMF、AsHEMG、AsCHLH、AsCHLM、AsCRD、AsDVR、AsPOR和AsCHLG基因家族unigenes在干旱胁迫下的相对表达量相对较低,且响应干旱胁迫的变化趋势和模式不明显。因此,后续的鉴定和分析将在AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO基因家族中进行。

图1 干旱胁迫下大蒜叶绿素合成基因家族unigenes表达(FPKM值大于0.3)热图
2.3 qRT-PCR分析
为了证实上述6个大蒜叶绿素合成基因家族在干旱胁迫下转录组测序结果的可信性和真实性,从这6个基因家族中各随机选取1个unigene进行qRT-PCR验证。结果(图2)显示:AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO这6个基因家族成员的表达趋势与转录组结果基本吻合,均于干旱胁迫6 d时相对表达量最高。除AsHEMB和AsCHLI基因家族成员外,剩余4个基因家族成员均在干旱胁迫6 d时与其他干旱胁迫时间差异显著。这表明RNA-Seq数据具有准确性和可靠性,可对这6个大蒜叶绿素合成基因家族进行后续鉴定分析。
2.4 蛋白质理化性质分析
上述6个大蒜叶绿素合成基因家族32个unigenes编码氨基酸序列的理化性质见表3。结果显示:32个unigenes编码序列的氨基酸残基数为104~773,理论相对分子质量为11 978~84 411,理论等电点为pI 4.78至pI 9.86,其中同一家族中各成员的理论等电点相对接近,例如:AsCHLI家族成员的理论等电点为pI 4.80至pI 5.75,整体较低;而AsCAO家族成员的理论等电点为pI 7.33至pI 9.86,整体较高。不稳定指数为24.66~60.13,其中8个成员的不稳定指数高于40,属不稳定蛋白,AsCAO家族中有4个成员属于不稳定蛋白,在6个家族中稳定性最差;AsHEMB和AsGSA家族的全部成员均为稳定蛋白。脂溶系数为80.04~104.59。除AsGSA家族外,其余5个家族成员的总平均亲水性均为负值,即AsGSA家族成员为亲水蛋白,其余5个家族成员为疏水蛋白。由此可以看出,这6个大蒜叶绿素合成基因家族成员氨基酸序列的理化性质存在一定差异,但同一家族成员氨基酸序列的理化性质较相似。
2.5 进化树与保守基序分析
大蒜AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO基因家族unigenes与其他植物叶绿素合成基因编码氨基酸序列的进化树见图3。结果显示:上述6个大蒜叶绿素合成基因家族unigenes与石刁柏(AsparagusofficinalisLinn.)、玉簪〔Hostaplantaginea(Lam.) Aschers.〕、小麦(TriticumaestivumLinn.)、狗尾草〔Setariaviridis(Linn.) Beauv.〕、粗柄象腿蕉〔Enseteventricosum(Welw.) Cheesman〕、石斛(DendrobiumnobileLindl.)和芋〔Colocasiaesculenta(Linn.) Schott.〕等植物的叶绿素合成基因编码氨基酸序列聚为6类,各类中大蒜AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO家族成员首先聚在一起,保守性较强。其中,AsHEMA家族成员与登录号XP_020262418.1(石刁柏)和QPO14976.1(玉簪)序列的同源性相对较高;AsHEMB家族的8个成员也比较保守,可进一步分为2个小类,AsHEMB01、AsHEMB03和AsHEMB08聚为一个小类,与登录号XP_034590070.1(狗尾草)和XP_037445707.1(小麦)序列的同源性较高,AsHEMB02、AsHEMB04、AsHEMB05、AsHEMB06和AsHEMB07聚为另一个小类;AsGSA家族成员与登录号RRT65413.1(粗柄象腿蕉)和XP_020693590.1(石斛)序列的同源性较高;AsCHLD家族成员与登录号XP_020268622.1(石刁柏)序列的同源性较高;AsCHLI家族成员与登录号XP_020273053.1(石刁柏)序列的同源性也较高;AsCAO家族可进一步划分为AsCAO01和AsCAO06以及AsCAO02、AsCAO03、AsCAO04和AsCAO05 2个小类,其中AsCAO01和AsCAO06与登录号QPO14978.1(玉簪)、MQL79406.1(芋)和XP_015614086.1(水稻)序列的同源性较高。
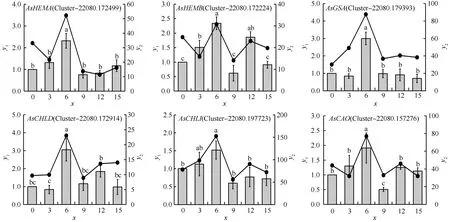
: qRT-PCR; : RNA-Seq.

表3 大蒜叶绿素合成基因家族unigenes编码氨基酸序列的理化性质1)

Ao: 石刁柏Asparagus officinalis Linn.; As: 大蒜Allium sativum Linn.; At: 拟南芥Arabidopsis thaliana (Linn.) Heynh.; Bn: 欧洲油菜Brassica napus Linn.; Bro: 芸薹Brassica rapa var. oleifera de Candolle; Caa: 辣椒Capsicum annuum Linn.; Ce: 芋Colocasia esculenta (Linn.) Schott.; Cha: 藜Chenopodium album Linn.; Cs: 墨兰Cymbidium sinense (Jackson ex Andr.) Willd.; Dn: 石斛Dendrobium nobile Lindl.; Ep: 画眉草Eragrostis pilosa (Linn.) Beauv.; Ev: 粗柄象腿蕉Ensete ventricosum (Welw.) Cheesman; Hp: 玉簪Hosta plantaginea (Lam.) Aschers.; Ku: 独叶草Kingdonia uniflora Balf. F. et W. W. Smith; Mb: 野蕉Musa balbisiana Colla; Nt: 烟草Nicotiana tabacum Linn.; Os: 水稻Oryza sativa Linn.; Pc: 黄连木Pistacia chinensis Bunge; Pha: 蝴蝶兰Phalaenopsis aphrodite H. G. Reichenbach; Pm: 稷Panicum miliaceum Linn.; Poa: 银白杨Populus alba Linn.; Rc: 蓖麻Ricinus communis Linn.; Sb: 高粱Sorghum bicolor (Linn.) Moench; Sig: 粟Setaria italica var. germanica (Mill.) Schred.; Sv: 狗尾草Setaria viridis (Linn.) Beauv.; Ta: 小麦Triticum aestivum Linn.; Vp: 香荚兰Vanilla planifolia Andrews; Vv: 葡萄Vitis vinifera Linn.
上述6个大蒜叶绿素合成基因家族unigenes编码氨基酸序列的保守基序及其结构分别见图4、图5和图6。结果显示:AsHEMA、AsGSA和AsCHLD家族成员氨基酸序列所含的保守基序一致且排列位置也相似,说明同一家族中的成员高度保守;AsHEMB、AsCHLI和AsCAO家族相对保守,部分家族成员存在差异。AsHEMB家族中,AsHEMB01和AsHEMB08的保守基序与其他6个成员存在差异,这与构建的进化树的分析结果基本一致,AsHEMB01和AsHEMB08与登录号XP_034590070.1(狗尾草)和XP_037445707.1(小麦)序列在进化上同源性更高;AsCHLI家族中,AsCHLI05和AsCHLI06与登录号XP_020273053.1(石刁柏)序列的同源性更高,而这2条序列均含有AsCHLI家族成员中的motif1、motif2、motif3和motif4这4个保守基序,推测这4个保守基序在进化上有更为重要的作用;AsCAO家族中,AsCAO01和AsCAO06的序列最长,含有的保守基序数量也较多,与登录号QPO14978.1(玉簪)序列的同源性更高。
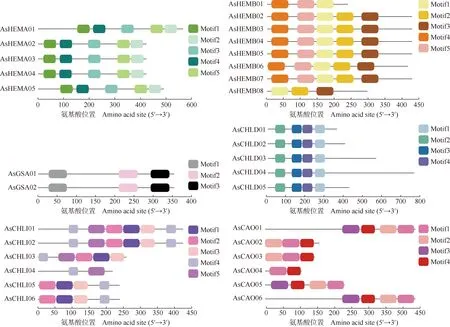
图4 大蒜叶绿素合成基因家族unigenes编码氨基酸序列的保守基序

图6 大蒜AsCHLI和AsCAO基因家族unigenes编码氨基酸序列的保守基序结构
3 讨 论
叶绿素作为参与植物光合作用的重要色素,在捕获光能和电子传递过程中起着十分重要的作用[25]。叶绿素合成基因与植物叶色变化和光合特性密切相关。例如:玉簪叶绿素合成酶基因的表达量控制叶绿素含量,玉簪HEMA、POR和CAO的过量表达促进其叶片的光合作用[26];小麦CHLI基因[27],花叶矢竹(Pseudosasajaponica‘Akebonosuji’)的PORB和CAO基因[28]以及水稻的YGL1、CHLD和CHLI基因[29]在叶片呈色或叶色异变过程中发挥关键作用。叶绿素合成基因的转录不仅与植物自身生长发育状态有关,还受植物所处的外界环境调控。Liu等[30]发现,水分亏缺条件下,水稻的HEMA和CHLH基因显著下调;Wang等[31]发现,低温胁迫导致辣椒的HEMA1、HEMB和CHLH基因的表达量以及叶绿素含量均显著降低。这些研究结果说明植物的光合作用对环境条件非常敏感,参与叶绿素合成的关键酶及其编码基因会受到逆境胁迫的影响。本课题组前期研究发现,干旱胁迫下大蒜叶片变黄,总叶绿素含量显著降低[6],但干旱胁迫是否对大蒜叶绿素合成基因具有调控作用目前还未见相关报道。因此,本研究通过挖掘干旱胁迫下大蒜转录组测序数据,筛选鉴定得到17个大蒜叶绿素合成基因家族;并通过分析各基因家族unigenes在不同干旱胁迫时间的响应模式,发现AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO基因家族unigenes在干旱胁迫下表达模式相似,总体呈现先升高后降低的趋势,且均在胁迫6 d时相对表达量达到峰值。推测这6个基因家族unigenes在大蒜干旱胁迫响应中具有协同调控作用。
进一步对AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO基因家族的32个unigenes进行生物信息学分析,发现这6个叶绿素合成基因家族unigenes编码氨基酸序列的理化性质存在一定差异,但同一家族成员氨基酸序列的理化性质较相似。从进化树可以看出:这6个大蒜基因家族的成员基本上都各自紧密地聚类在一起,具有较高的保守性和相似性,同时与其他植物叶绿素合成基因也具有一定的同源性,推测他们具有相似或相近的生物学功能。结合RNA-Seq和qRT-PCR的结果,这6个叶绿素合成基因家族的成员在应答干旱胁迫中发挥重要作用。其中,HEMA基因作为叶绿素合成限速步骤(ALA的合成)中第1步反应的催化酶基因,是植物叶绿素合成起点的关键基因[24,32]。HEMA基因家族能够参与植物对逆境的响应。张修德等[16]分析苹果MdHEMA1基因的启动子顺式作用元件发现,MdHEMA1基因的转录受干旱胁迫等逆境的诱导。除了HEMA基因家族,HEMB和CHLI也是叶绿素响应逆境的重要调控基因家族。孟昭娟[33]发现弱光逆境下,番茄HEMB基因的表达量显著下调,叶绿素合成水平明显降低。Bhor等[34]将黄瓜(CucumissativusLinn.)CHLI基因家族成员沉默,不仅导致叶绿素含量下降,还使其防御相关基因的表达量显著上调。此外,虽然不同基因家族成员的功能具有多样性,但同源性较高的基因家族或成员往往对植物具有类似的调控作用。本研究中,AsHEMA05与石刁柏和玉簪相关基因的同缘性较高,AsHEMB01、AsHEMB03和AsHEMB08与小麦相关基因的同缘性较高,AsCHLD05、AsCHLD06、AsCHLI03和AsCHLI04与石刁柏相关基因的同缘性较高,AsCAO01和AsCAO06与玉簪相关基因的同缘性较高,说明同为单子叶植物的大蒜与小麦、石刁柏和玉簪的亲缘关系较近。
综上所述,本研究首次鉴定了大蒜叶绿素合成基因家族成员,发现大蒜AsHEMA、AsHEMB、AsGSA、AsCHLD、AsCHLI和AsCAO基因家族在响应干旱胁迫中发挥重要作用,这将为解析干旱胁迫下大蒜的叶绿素合成基因的功能和作用机制提供了研究基础。
