海水环境下MICP的反应机理与影响因素
2022-06-21王子玉喻文晔齐超楠赵翔宇
王子玉,喻文晔,齐超楠,赵翔宇
(海南热带海洋学院 a.海洋科学技术学院;b.崖州湾创新研究院;c.生态环境学院,海南 三亚 572022)
微生物诱导碳酸钙沉淀技术加固土体是近年来发展起来的新兴技术,其原理是通过向土体中的微生物提供钙源和氮源,促进砂土间碳酸钙生成并沉淀,起到胶结土体的作用,使土体得到固化。MICP是一种在自然界中广泛存在的生物矿化过程,机理简单,快速高效,具有成本低、环境友好等特点,非常符合生态建设岛礁的需求[1-7]。
近年来,学者们对海水环境下的MICP技术应用进行了探索研究,彭劼等[8]、余振兴[9]研究了海水环境下微生物诱导碳酸钙沉淀的加固效果,发现海水环境会抑制MICP反应的碳酸钙生成量。张浩男[10]研究了海水环境下巴氏生孢八叠球菌产钙率的影响因素。付佳佳等[11]在研究海相粉土的加固试验中发现,采用拌和加固法可使加固过程更简便,加固试样更均匀,且加固试样的脆性破坏现象更明显。李昊等[12]经无侧限试验发现,海水环境的试样加固力学效果比淡水好,且海水的弱碱性环境也有利于加固。杨司盟等[13]研究发现,将海水浓缩至3倍,钙离子含量约为0.033 mol/L,尿素添加量为浓缩海水中钙离子含量的3倍时,可提高利用胶结液中钙离子产生沉淀的效率;使用流速为2 mL/min的胶结液注入对5 cm砂柱进行加固,可以得到最佳加固效果。Kannan等[14]进行了MICP技术在海相黏土中有效性的研究,生物增强使海相黏土的液限和塑性指数分别降低到29%和47%左右,海相黏土的性质也实现了从黏土到弹性粉砂的转变。Daryono等[15]进行了人工滩岩与天然滩岩的对比研究,天然滩岩的胶结机理特性使得在沿海生产人造滩岩方面采用MICP生态环境开发方法具有潜力。董博文等[16]研究发现,天然海水使微生物的生长出现滞后期,但稳定期的微生物数量和脲酶活性与淡水环境下相差不大,与淡水相比,加固后钙质砂的渗透系数可降低一个数量级。
由于海水环境的特殊性,海水pH值较高,同时,海水中含有多种离子成分,这些离子成分对细菌的活性与沉淀物矿物成分有直接影响。通过查阅大量文献可知,海水环境下,MICP产钙的影响因素主要为营养盐、微生物(菌液)、温度、海水pH值等。目前对海水环境下MICP技术应用的研究不够深入,鉴于此,笔者针对上述各项影响因素,同时在海水环境和去离子水环境下改变营养盐浓度、菌液与营养盐体积比、环境温度等条件进行微生物诱导碳酸钙沉淀试验;分别取海水和去离子水环境下的矿化反应试样进行测试,通过对比分析,获得海水环境下的MICP反应机理。
1 试验概况
1.1 试验材料
1)海水:试验用海水取自三亚大东海附近海域,海水pH值为8.25,含盐量为3.6%。海水离子成分见表1。
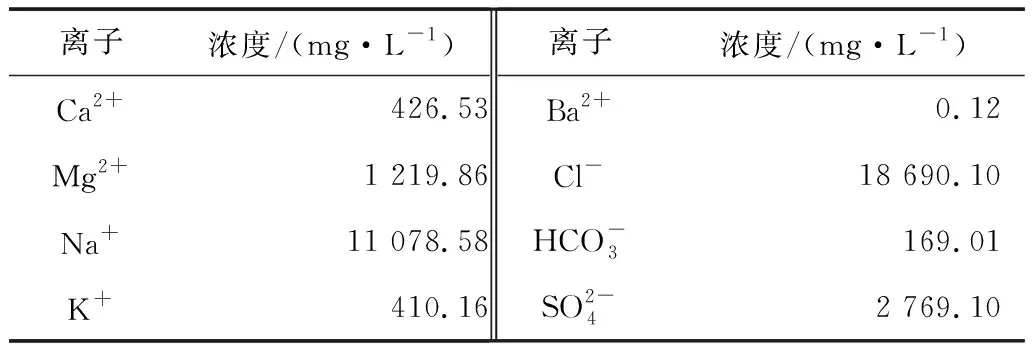
表1 试验海水离子成分及其浓度
2)微生物:试验选取大肠埃希氏菌ATCC25922(巴氏芽孢杆菌)作为试验菌种,购自广东省微生物菌种保藏中心,该细菌为化能异养型革兰氏阳性菌,是目前在岩土工程领域MICP应用最普遍的细菌。经活化后,加入液体培养基中培养,培养基成分为(每1 000 mL中):尿素20 g、蛋白胨15 g、大豆蛋白胨5 g、氯化钠5 g,并用NaOH溶液将培养基pH调节至7.3,以适宜细菌生长,将培养基放入高压灭菌锅中,以121 ℃灭菌30 min,将加入了菌种的培养基(如图1)放入摇床中,以220 r/min的转速30 ℃下培养36 h,取出后测量菌液浓度和菌液脲酶活性。

图1 在摇床培养后的菌液Fig.1 Bacterial solution cultured in a shaking
1.2 试验方法
1.2.1 微生物浓度和活性测定 利用分光光度计测定菌液浓度,测试其在波长600 nm下的吸光率(OD600)。测定菌液水解尿素的能力,取5 mL菌液与45 mL 1.1 mol/L尿素溶液混合,用电导率仪测量溶液电导率的变化(测量5 min),所测5 min内平均电导率变化值乘以稀释倍数(10倍),即为菌液初始酶活性。试验测得菌液的吸光度(OD600)为1.027,5 min内电导率变化为1.36 mmol/(L·min)。
1.2.2 MICP试验 试验过程中营养盐均选取CaCl2和尿素1∶1的混合溶液,共进行3个批次。第1批:选取温度为常温(25 ℃),菌液和营养盐体积分别为30、120 mL,设置营养盐水源分别为去离子水和海水,营养盐的浓度分别为0.5、0.75、1.0、1.25、1.5 mol/L;第2批:根据第1批结果,选取最优营养盐浓度为1.0 mol/L,设置营养盐水源分别为去离子水和海水,温度分别为4 ℃和常温(25 ℃),菌液与营养盐体积分别为30、60 mL,30、120 mL,30、180 mL,30、240 mL,30、300 mL。试验均在烧杯中进行,如图2所示。

图2 MICP水溶液试验Fig.2 MICP aqueous solution
试验过程中使用PXS-270(离子计)及PCa-1-01(钙离子电极)和232-01(参比电极)、PHS-25(pH计)及E-201-C(pH复合电极)每8 h测量一次钙离子浓度和pH值,如图3、图4所示。离子计每次测量前需使用标准溶液(10-1、10-4mol/L的CaCl2溶液)进行标定,然后使用标准溶液(10-1、10-2、10-3、10-4mol/L的CaCl2溶液)测量出pX值和对应的电位值,绘制pX值和电位值的关系曲线,每次均测量电位值,而后根据关系曲线得到pX值,由于离子计的最低量程为10-1mol/L,而查阅文献可知,MICP水溶液试验在反应停止时的最低钙离子浓度为0.05 mol/L[10],所以,每次测量前均搅拌均匀后再使用移液管提取1 mL试样,并加入9 mL去离子水稀释10倍后搅拌均匀再测量;pH计每次测量前需使用pH值为4.00、6.86、9.18的缓冲溶液进行标定,每次搅拌均匀后再测量。设定环境温度为低温(4 ℃)的试样在每次测量完成后立即放入4 ℃的冰箱中。试验结束后,用去离子水清洗浸泡24 h,并在烘箱中以60 ℃烘干24 h,测量生成物质量。

图3 PXS-270(离子计)

图4 PHS-25(pH计)
2 试验结果与分析
2.1 营养盐浓度对矿化反应的影响
在去离子水和海水环境下分别进行水溶液试验,分析营养盐浓度对矿化反应过程及生成沉淀物质量的影响规律,如图5~图7所示。在两种水环境反应过程中,钙离子浓度均随着营养盐浓度的增加而降低,随着反应的进行,钙离子浓度减小的速率趋于平缓,且在反应时间达到60 h时,钙离子浓度在0.3 mol/L附近达到平衡。这是由于较低浓度营养盐提供的钙离子较少,随着钙离子浓度增加,可用于反应消耗的钙离子变多,促进了反应的快速进行。
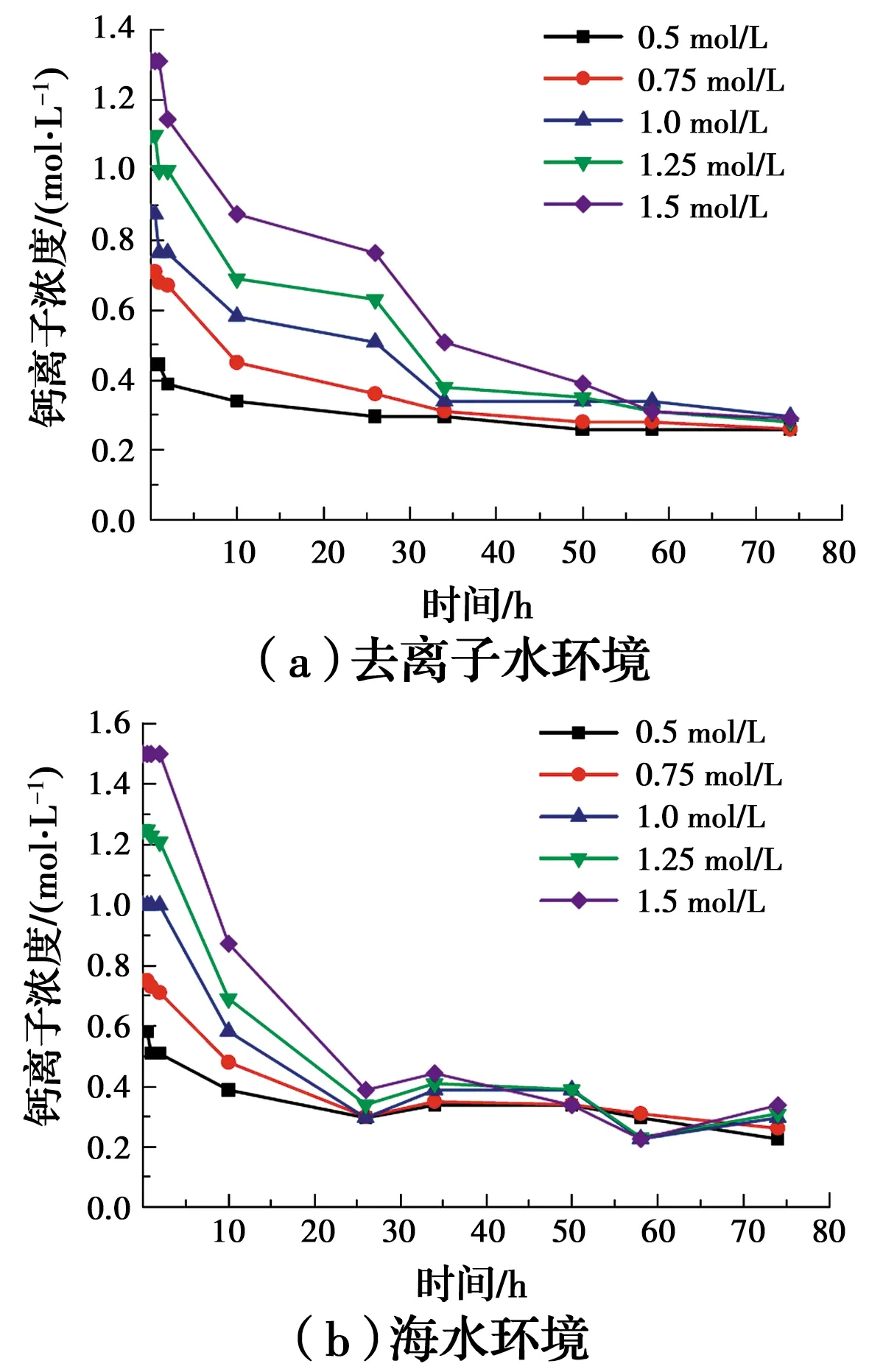
图5 水溶液反应过程中钙离子浓度变化曲线Fig.5 Curve of the change of calcium ion concentration
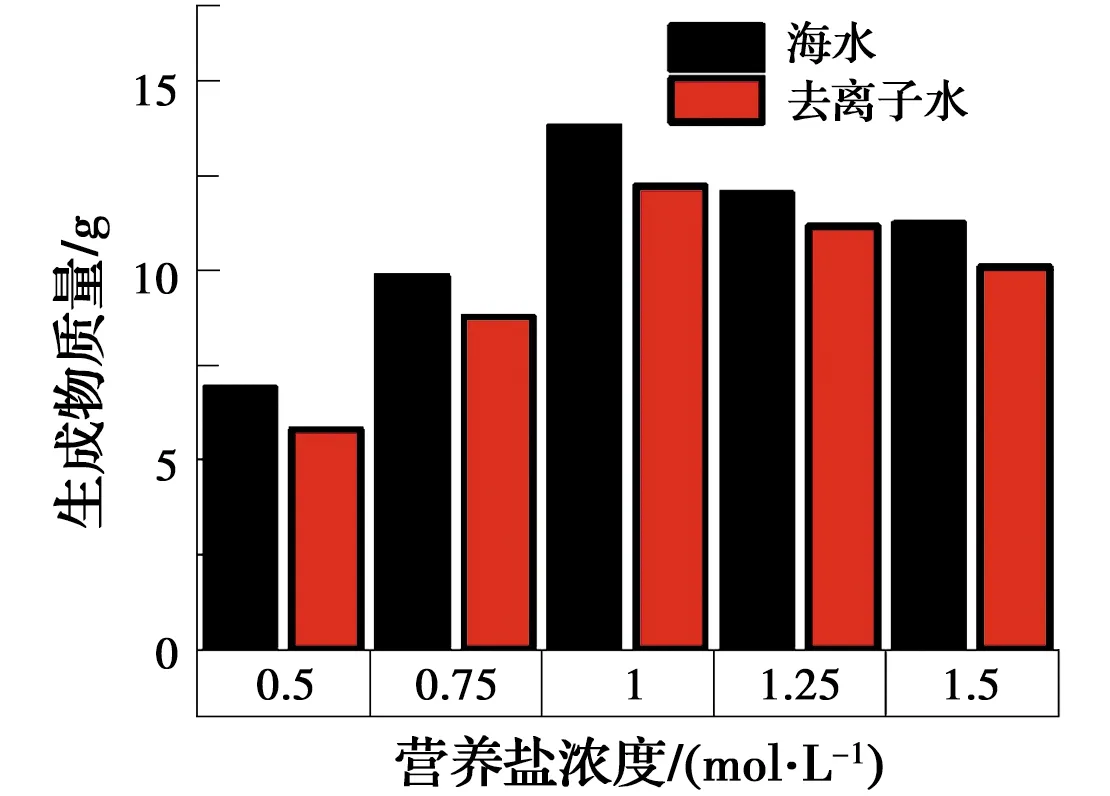
图7 不同水环境生成碳酸盐质量对比Fig.7 Carbonate quality comparison in different
去离子水环境下,pH值先升高后降低,是因为在反应最初几小时内,尿素水解量超过了微生物的利用效率,使得溶液中OH-浓度升高,随后微生物进行了大量的消耗代谢,使溶液中的pH值逐渐降低。比较各种营养盐浓度的试样可以得出,最终1.0 mol/L的试样pH值最低,反应效果最好,海水环境下,pH值呈先下降后逐渐缓慢上升至平稳的趋势,在前25 h内,微生物对尿素进行了大量消耗,随后25~60 h内,微生物代谢速率减慢,而尿素水解出的NH3分子又进行了水解,使pH值缓慢提升。虽然海水条件的初始pH值较高,但下降得较快,说明海水的高pH值加速了尿素的水解,使得微生物对营养盐的利用效率加大,加速了反应的进行。
在海水和去离子水环境条件下,碳酸盐生成量均随营养盐浓度的增加而先增加后减少,并在营养盐浓度为1 mol/L时达到最大碳酸钙生成量,去离子水和海水环境下最大碳酸钙生成量分别为12.21、13.79 g。这是由于营养盐浓度过高,细菌难以再进行利用,使矿化反应进行得不彻底,而低浓度的营养盐提供的钙离子和碳酸根离子较少,碳酸盐生成量也不高。
2.2 菌液和营养盐体积比对矿化反应的影响
在两种水环境下,分别进行不同菌液和营养盐体积配比条件下的水溶液试验,获得钙离子浓度随时间的变化规律及生成碳酸盐的质量,如图8、图9所示。由图可见,在4 ℃时,两种水环境反应速率均随着菌液在反应液中比例的增大而增大;在常温(25 ℃)下,两种水环境反应速率均随着菌液在反应液中比例的增大而先增大后降低,峰值在配比为30∶120的反应液中出现。这是由于常温条件下随着菌液比例的降低,反应速率逐渐减慢,而在配比为30∶60的试样中,营养盐浓度在混合溶液中较低,反应速率不及30∶120的试样。
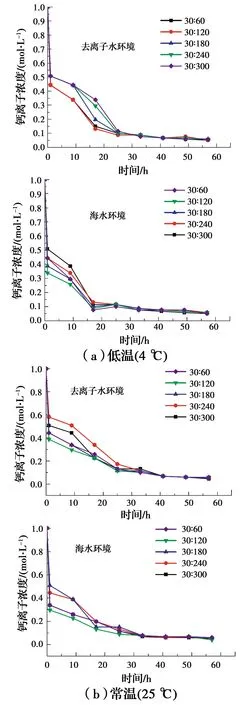
图8 水溶液反应过程中钙离子浓度的变化曲线Fig.8 Curve of the change of calcium ion concentration
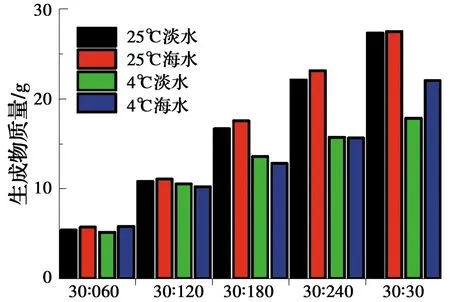
图9 矿化反应生成沉淀物质量的对比Fig.9 Quality comparison of precipitates
在两种温度条件下,随着营养盐配比的增加,生成的碳酸盐质量也逐渐增加,在常温(25 ℃)条件下,均是海水环境中的生成量略高于去离子水,推测原因为在海水环境中不仅有碳酸钙生成,同时还有镁盐、钡盐等生成,而在4 ℃时,海水环境中生成矿物质量与去离子水中相差不大,原因是低温使菌液活性减弱,且对海水的减弱效果更明显。两种水环境下,随着营养盐的比例增大,常温(25 ℃)下的沉淀物生成量均大于4 ℃,说明低温对生物矿化作用有一定的抑制作用。
2.3 温度对矿化反应的影响
选取营养盐浓度为1 mol/L、菌液和营养盐体积分别为30、120 mL的试样在低温(4 ℃)和常温(25 ℃)两种条件下进行试验,分析钙离子浓度变化规律,如图10所示。在两种水环境中,钙离子浓度均随着时间降低,且常温(25 ℃)时的钙离子消耗较低温(4 ℃)快,说明低温对反应的进行有抑制作用;海水环境下的反应在30 h后就趋于稳定,而去离子水环境下的试样在40 h后才达到稳定值,说明海水中的碱性成分更有利于反应的进行。
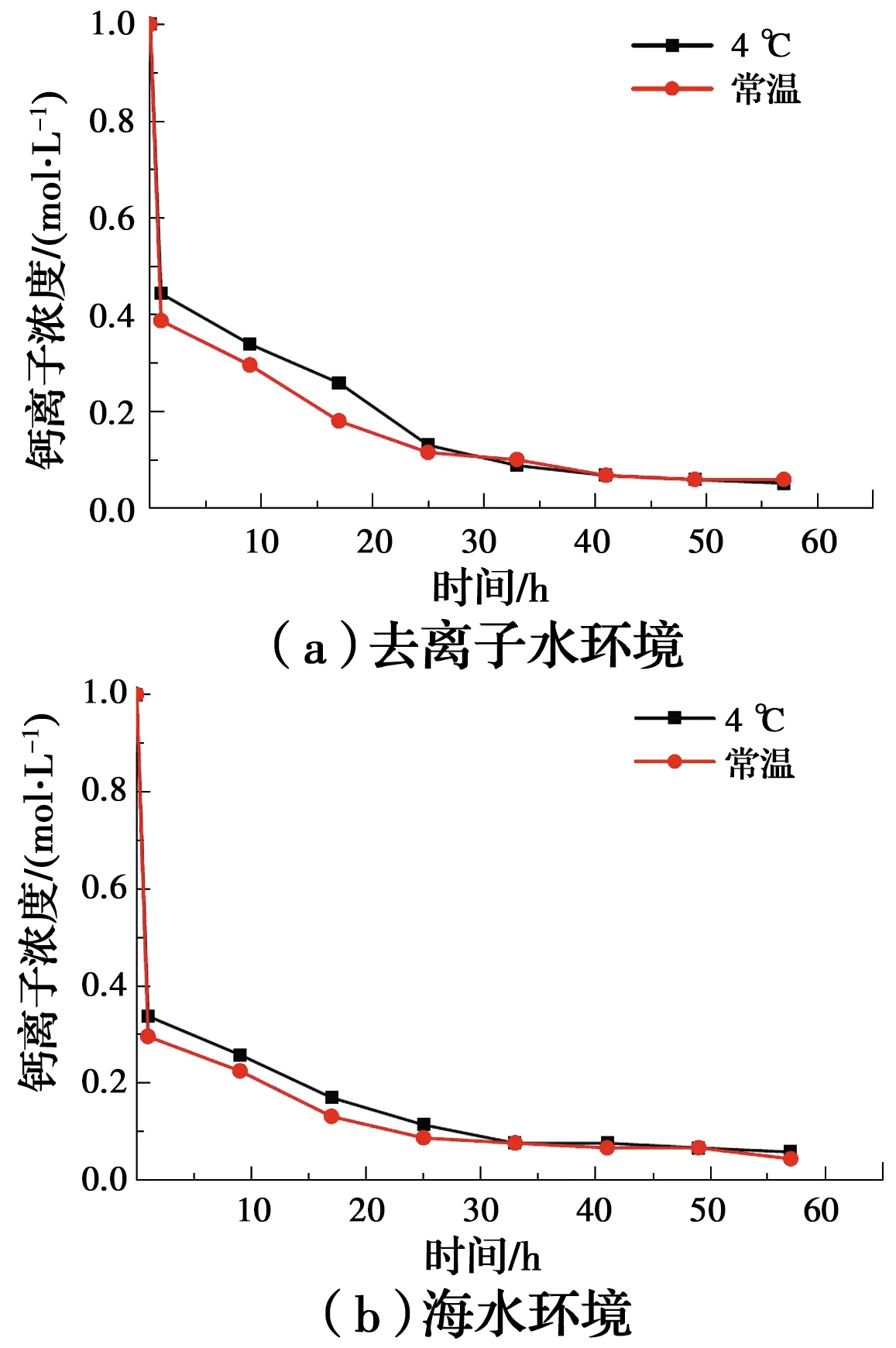
图10 水溶液反应过程中钙离子浓度的变化曲线Fig.10 Curve of the change of calcium ion concentration
2.4 SEM和EDS结果分析
分别选取1.0 mol/L的去离子水和海水环境下的样品进行扫描电镜测试,其形貌如图11所示。如图11(a)所示,在10 000倍扫描电镜下,去离子水环境中的碳酸钙形成了较好的方解石晶体;如图11(b)所示,在2 700倍扫描电镜下,海水环境下也生成了大量的方解石晶体,如图中红线圈出部分,海水样品中还含有少量的碱式碳酸镁(Mg5(CO3)4(OH)2·4H2O)和碳酸钡晶体附着在碳酸钙晶体上,导致碳酸钙晶体表面不光滑且有小颗粒附着。

图11 扫描电镜下生成物结构Fig.11 Structure of product under scanning
去离子水和海水水溶液生成物的能谱分析如图12所示。可以看出,海水环境下生成的矿物成分较去离子水中多出了镁、钡等元素,推测是由于海水中存在的少量镁离子和钡离子使得反应过程中除生成碳酸钙以外,还含有少量的碳酸镁和碳酸钡等矿物成分。
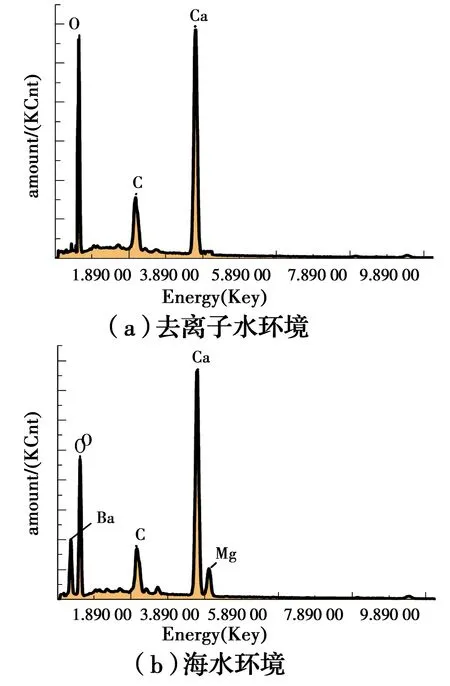
图12 沉淀物能谱图Fig.12 Energy spectrum of
3 海水环境微生物诱导矿化反应过程
分别选取1.0 mol/L的去离子水和海水环境下的样品进行XRD测试。由图13(a)可以看出,在去离子水环境中,只生成了大量的碳酸钙方解石晶体。由图13(b)可以看出,在海水环境中,同样有较多方解石晶体生成。由于海水的碱性环境和其中含有的少量Mg2+、Ba2+,使得海水环境中还生成了少量的球形碱式碳酸镁(Mg5(CO3)4(OH)2·4H2O)和γ型碳酸钡。
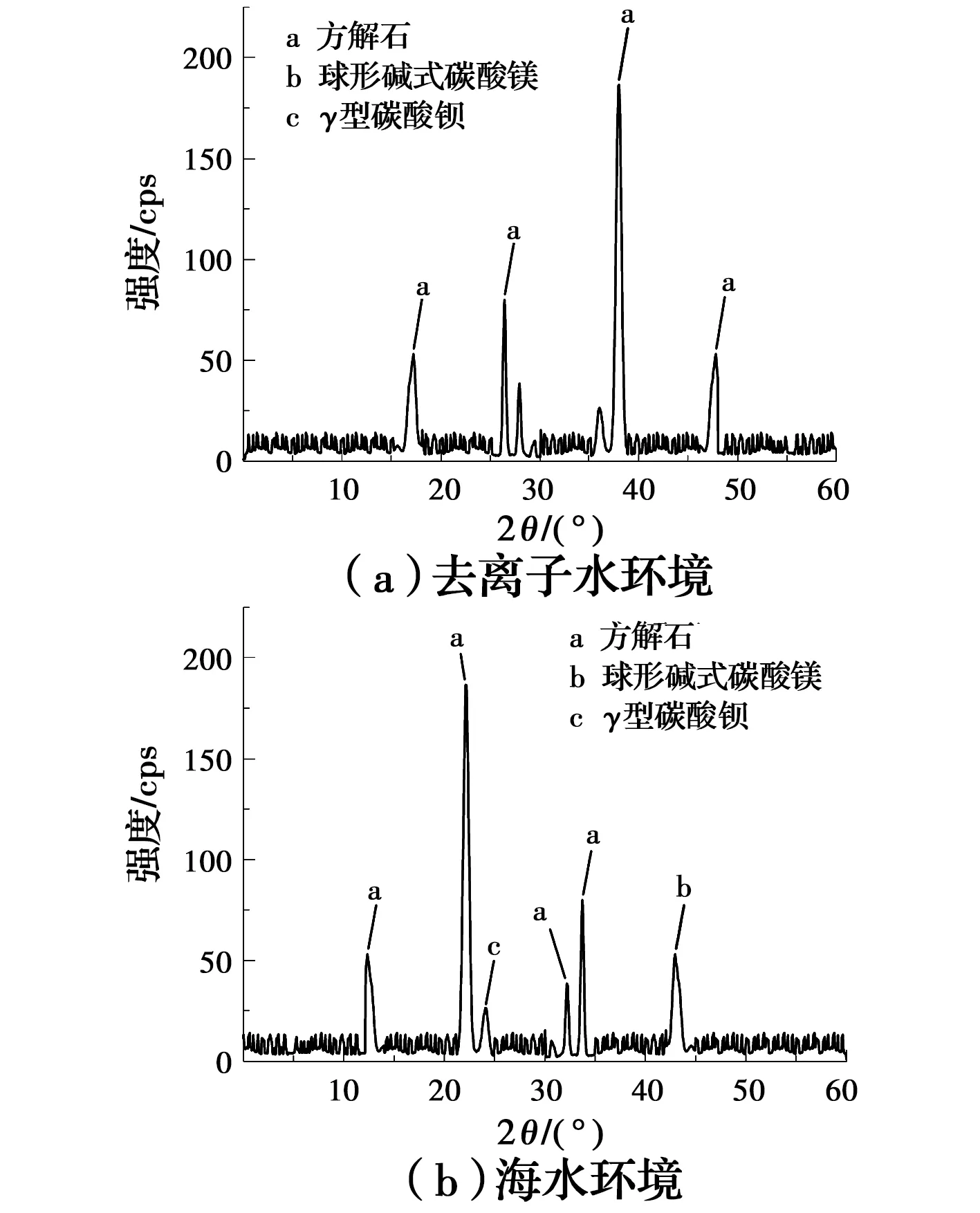
图13 沉淀物X射线衍射分析图Fig.13 X-ray diffraction analysis of
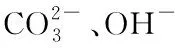




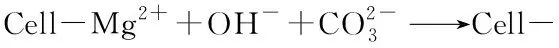
4 结论
通过水溶液试验方法对海水环境与去离子水环境下的MICP矿化机理与影响因素进行研究,在试验过程中,通过改变营养盐浓度、菌液与营养盐体积比、温度等条件,分析各因素对微生物诱导碳酸钙沉淀随时间的变化规律的影响,得到以下结论:
1)基于MICP技术,在水溶液中诱导碳酸盐沉淀,通过改变营养盐浓度、菌液与营养盐体积比、环境温度等条件,并进行了海水和去离子水条件下的对比,得出了两种水环境下的最优条件和不同的反应机理。
2)在海水和去离子水环境下,通过改变营养盐浓度、菌液与营养盐体积比、环境温度等条件进行MICP水溶液试验,得出碳酸盐生成量均随营养盐浓度的增加而先增加后减少,并在营养盐浓度为1 mol/L时达到最大生成量,菌液与营养盐体积比为30∶120时,反应速率最快,效果最佳,常温(25 ℃)时的钙离子消耗较低温(4 ℃)时快,且更早趋于稳定值。
3)对比不同水环境下的矿化反应,发现高pH值可以加速反应的进行,且海水中存在少量的Mg2+、Ba2+等离子,使得沉淀物中除CaCO3外,还生成少量的Mg5(CO3)4(OH)2·4H2O、BaCO3等矿物成分。
