人参种植对非林地土壤微生物群落结构的影响分析
2022-06-21田海玲马正赫康辰凯郭德山赵立轩武伦鹏
田海玲,马正赫,康辰凯,郭德山,赵立轩,武伦鹏*
(1.延边大学实验动物中心,延吉 133002;2.国家参茸产品质量监督检验中心,延吉 133000)
人参是我国传统名贵中药材,由于其活性成分具有多种重要的生物活性和药理作用,如抗病毒、抗癌、抗疲劳、抗衰老、抗糖尿病和免疫调节等[1,2],在医药、食品保健、日化等领域具有巨大应用价值。我国是人参生产大国,其产量占世界人参产量的70%[3]。
虽然我国人参种植历史悠久、产量很高,但始终采用传统的“伐林栽参”模式,每年破坏大量的森林资源,从而加大人参与森林争地矛盾、破坏生态环境等一系列不良后果,已经不再适合产业可持续发展的需求。因此,急需转型既要保证人参产量和质量,又要保证生态环境的人参生产模式,这是多年来相关行业科研人员不断追求和探索的生产模式。“非林地栽参”模式正是在这个背景下产生的一种人参种植模式,用非林地土地资源进行人参种植,能够解决参林矛盾、保护生态环境[4],是人参产业健康和可持续发展的一条根本出路。“非林地栽参”是主要指在农田里种植人参,但是大部分农田由于长期使用过量的化肥,土壤盐碱化,板结程度严重[5],不能满足人参生长所需的土壤结构和微生态要求。其中,土壤微生态是土壤健康的敏感生物指标,直接影响植物的产量和品质[6]。在植物生长过程中,土壤微生物与其所处的植物之间构成了一个复杂且微妙的系统,他们之间可以相互协同、相互抑制。在自然生境条件下这种系统是相对稳定的,但是长时间种植一种植物,会打破这种系统的稳定性,土壤中有益微生物数量减少,土壤微生物区系从细菌主导型向真菌主导型转化,最终导致土壤微生物群落结构失衡,使病原菌更容易侵染植物而引起各种土传病害[7,8]。人参为多年生药用植物,长期的栽培方式使人参容易受到各种土传病原菌的侵害,危害较严重的有人参锈腐病菌、根腐病菌等[9,10],他们在土壤微生物群落中的比例与人参病害有密切的关系。本研究采用高通量测序技术对未种植人参和种植人参的非林地土壤微生物群落结构及丰度变化进行研究,为非林地人参土传病害的研究提供科学依据。
1 材料和方法
1.1 土壤样品采样
土壤样品于2020年10月17日采集于吉林省珲春市华瑞参业有限公司的非林地西洋参种植基地:(1)距离采参点约10m未种过人参的土壤作为对照(NS组);(2)3年生的健康参根部土壤(NGS组),取20 cm左右根周围土壤,每组分别用五点取样法采集土壤样品,充分混匀装入无菌聚乙烯封口袋内,低温运输至实验室,在4℃条件下贮藏。
1.2 土壤微生物总DNA的提取和测序
非林地土壤微生物总DNA的提取按照E.Z.N.A.Soil DNA Kit试剂盒说明书进行提取。提取的DNA分别进行细菌16S rDNA和真菌ITS扩增。细菌16S rRNA扩增引物采用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),真菌ITS扩增引物为ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R (5'-GCTGCGTTCTTCATCGATGC-3')。采用Illumina公司的TruSeq Nano DNA Library Prep Kit制备测序文库,构建好的文库经检测合格后,使用Illumina Miseq平台测序,委托生工生物工程(上海)股份有限公司完成。
1.3 数据处理
采用Illumina MiSeq平台对群落DNA片段进行双端(Paired-end)测序,运用USEARCH(v11.0.667,http://www.drive5.com/usearch/)[11]检查并剔除嵌合体序列,获得每个样品的有效序列。使用UCLUST序列比对工具[12]对前述获得的序列按97%的序列相似度进行归并和OTU(Operational Taxonomic Unit)聚类,在聚类过程中去除嵌合体,得到OUT代表序列。将所有优化序列比对至OTU代表序列,选出与代表序列相似性在97%以上的序列,生成OTU表格。使用R软件(v3.6.0),对丰度高的优势物种进行聚类分析并绘制热图。
2 结果与讨论
2.1 测序数据和OUT聚类分析
通过对土壤样品中16S rDNA和ITS基因进行测序,对有效序列进行聚类,细菌NS组和NGS组中包含的OTU数目分别为2490和2098个,真菌NS组和NGS组中包含的OTU数目分别为514和428个。根据获得的OTU丰度矩阵,通过韦恩图直观地呈现两组样品的OTU数目组成相似性及重叠情况,两组样品共有的细菌和真菌的OTU数目分别为1812个和280个(图1 A和1 B)。将序列进行随机抽样,以抽到的序列数与它们所代表的OTU数目构建稀释性曲线,如图2 A和2 B所示,2个样品的稀释曲线均趋于平缓,说明继续增加测序的数量对产生的OTU数量的影响较少,测序数量足够,取样合理,能够较真实地反映土壤样品的微生物群落。
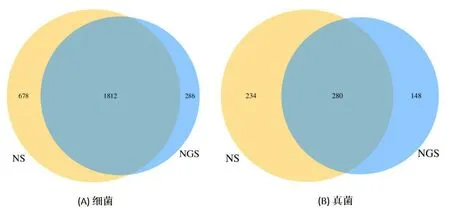
图1 .OUT分布韦恩图Fig.1 Venn diagram of distribution of OTUs
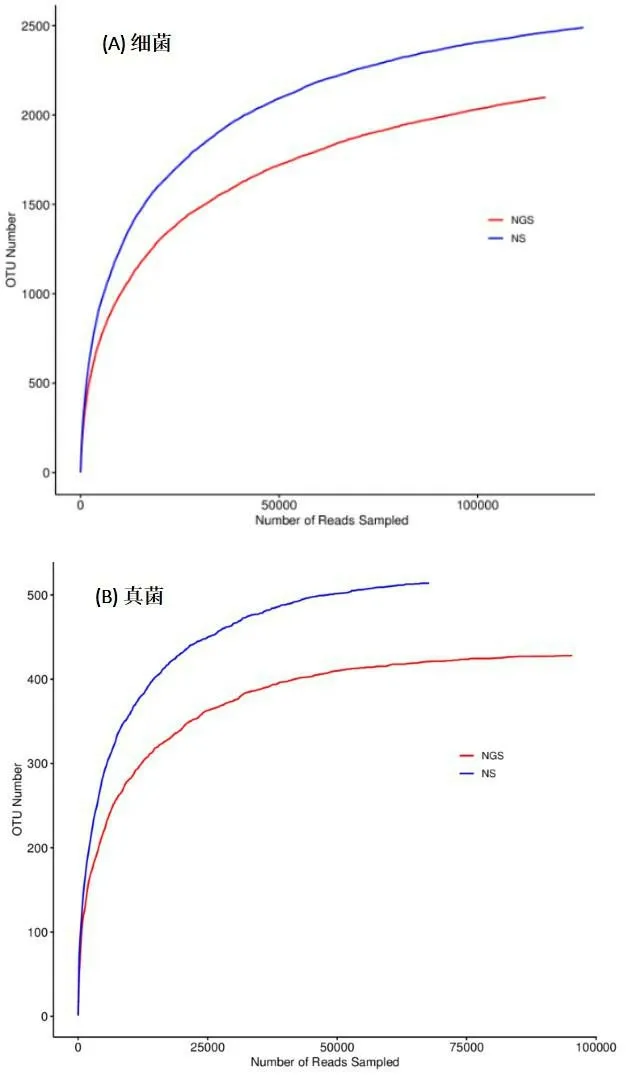
图2 .两个样本中OUT稀释曲线Fig.2 Rarefaction curves of OTUs in two samples
2.2 微生物群落结构变化
使用统计学分析方法,获取2个样品在门水平上的物种组成和丰度分布表,以便直观查看各样品在门水平上的物种组成及其比例(图3)。在种植人参的非林地土壤中12种细菌和5种真菌为优势菌种,其中优势细菌为Proteobacteria(27.27%)、Acidobacteria(20.6%)、Unclassified_Bacteria(14.79%)、Actinobacteria(8.09%)、Thaumarchaeota(6.45%)、Candidate_division_WPS-2(4.24%)、Bacteroidetes(4.16%)、Planctomycetes(3.26%)、Gemmatimonadetes(2.96%)、Firmicutes(2.23%)、Verrucomicrobia(1.88%)和Candidate_division_WPS-1(1.54%)等;优势真菌为Ascomycota(44.75%)、Mortierellomycota(29.24%)、Basidiomycota(19.98%)、Unclassified(3.01%)和Glomeromycota(2.65%)等。

图3 .门水平的物种相对丰度柱状图Fig.3 Relative abundance of species on level of phylum
2.3 优势物种热图
使用R软件,将门水平的群落组成数据根据分类单元的丰度分布加以聚类,根据聚类结果对分类单元和样品分别排序,并通过热图呈现。通过聚类,将高丰度和低丰度的分类单元区分,并以颜色梯度反映样品之间的群落组成相似度(图4)。颜色越深(红),表示物种的丰度越高;颜色越蓝,表示物种的丰度越低。从图4A可以看出,种植人参前后,非林地土壤中
Proteobacteria、Acidobacteria、Actinobacteria、Bacteroidetes和Unclassified_Bacteria等4种细菌均呈现较高的丰度。种植人参后,Bacteroidetes、Actinobacteria、Candidate_Saccharibacteria、Cyanobacteria_Chloroplast等细菌的丰度减少,而Acidobacteria、Thaumarchaeota和Candidate_division_WPS-2等细菌的丰度增加。从图4B可以看出,种植人参前后,除了Ascomycota和Basidiomycota丰度较为接近外,其他真菌的丰度有较大 的 差 异 包 括Mortierellomycota、Rozellomycota、Chytridiomycota、Basidiomycota、Glomeromycota和Unclassified等真菌,特别是种植人参后Mortierellomycota等病原真菌[13]的丰度明显增加。

图4 .门水平的细菌和真菌丰度聚类热图Fig.4 Cluster heatmap analysis of bacteria and fungi community on level of phylum
3 结论
人参种植与土壤微生物的变化密切相关。种植人参后,被孢霉门Mortierellomycota等病原真菌的丰度显著增加,推测这与人参病害有一定的关联。因此,深入研究非林地土壤微生物群落结构及优势菌群,对阐述非林地土壤微生物群落与人参土传病害的关系具有较重要的作用,并有助于揭示非林地栽参模式的连作障碍等问题。
