冰温贮藏甘南藏羊肉色稳定性与线粒体MMb还原能力研究
2022-06-21师希雄张攀高赵瑞娜包晓明范小宁
师希雄 张攀高 赵瑞娜 包晓明 范小宁
(甘肃农业大学食品科学与工程学院, 兰州 730070)
0 引言
藏羊可适应海拔3 000 m以上的高寒缺氧环境[1],其中,甘南藏羊包括欧拉型、乔科型与甘加型[2]。欧拉型藏羊产肉性能良好,且形成了风味独特的羊肉产品[3]。欧拉型藏羊肉在贮藏期间肉色不稳定,极易发生劣变。因此,有必要研究藏羊肉贮藏期间肉色稳定性的调控。
影响肉色稳定性的因素有内在因素和外在因素:内在因素包括肉的pH值、高铁肌红蛋白还原酶活性(Metmyoglobin-reducing activity,MRA)等;外在因素有温度、光照、氧气、微生物等[4]。高铁肌红蛋白还原酶使肌红蛋白处于还原状态,一旦形成高铁肌红蛋白,将使之还原,延长肉的货架期。冰温指冻结点以上,0℃以下的温度[5]。冰温贮藏可通过调控高铁肌红蛋白还原酶系统从而影响肉色的稳定。文献[4]报道,冰温条件下,大尾寒羊与小尾寒羊杂交公羊的肉色稳定性与烟酰胺腺嘌呤二核苷酸(Nicotinamnide adenine dinucleotide,NADH)浓度、MRA有关。目前,冰温贮藏对畜禽肉、鱼肉及虾肉等品质的影响已有研究报道[6-12]。
然而,由于品种、生活习性与地域的差异,藏羊与普通羊肉的肉品质、生理生化特性存在差异[13],这些可能会影响贮藏过程中品质的变化。对于冰温贮藏中线粒体高铁肌红蛋白(Metmyoglobin,MMb)还原能力与藏羊肉色稳定性关系尚未见报道。
参考文献[14]的方法,本文预试验测定藏羊肉的冰点温度为-1.5℃,考虑到设备温度±0.1℃波动,本文确定-1.4℃作为藏羊肉冰温贮藏温度。本研究以甘南藏羊后腿肉为试验材料,在冰温((-1.4±0.1)℃)与冷藏((4±1)℃)两种条件下分别贮藏,测定贮藏期间(0、1、3、5、7、9 d)MRA、NADH含量、琥珀酸脱氢酶(Succinate dehydrogenase,SDH)活力、线粒体膜通透性、线粒体膜电位与肉色色调角的变化,研究冰温贮藏甘南藏羊肉色稳定性与线粒体MMb还原能力的关系,从而为改善肉色提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1试验原料及样品处理
选取3岁去势甘南藏羊后腿肉宰后0.5 h肉样,一部分样品现场测定肉色指标后液氮速冻,用于测定“0 d”其他指标,剩余肉样除去脂肪与筋膜,之后,随机分为冰温组和冷藏组(取一份肉样进行冰点的测定,冷藏组为对照),用保鲜膜包裹后在-18℃冰箱降温,冷藏组与冰温组样品的中心温度分别达到4℃及0℃时取出,分别放入冷藏库((4±1)℃)和恒温恒湿试验箱((-1.4±0.1)℃),在贮藏1、3、5、7、9 d取出冰温组与冷藏组肉样,现场测定色度,其余样品在-80℃保存,测定其余指标。
1.1.2试验仪器与试剂
试验仪器:恒温恒湿试验箱(QL-HWHS-100L型),合肥安科环境试验设备有限公司;色度计(Konica CR-10型),柯尼美能达光电股份有限公司; pH计(PHS-3C型),上海宁隆仪器有限公司;紫外-可见分光光度计(UV-2550型),岛津上海有限公司;高速冷冻离心机(TGL-24MC型),湖南平凡科技有限公司;荧光分光光度计(RF 5301-PC型),日本岛津公司;酶标仪(Spectramax M2型),美国美谷分子仪器有限公司。
试验试剂:肌红蛋白、Tris-HCl、Hepes、蔗糖、甘露醇,以上试剂均为分析纯。
线粒体的提取、膜电位测定(JC-1)及SDH活力检测所用的试剂盒购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1MRA测定
参考文献[15]制备反应物。将MMb配制成0.75 mmol/L溶液;标准反应混合物由5.0 mmol/L乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)、3.0 mmol/L K4Fe(CN)6、2.0 mmol/L NADH、50 mmol/L磷酸盐缓冲液(pH值7.0)组成。
参考文献[15]的方法稍作修改制备高铁肌红蛋白还原酶。取肉样10 g加入20 mL冰预冷的磷酸盐缓冲液(2.0 mmol/L,pH值7.0),在冰浴条件下均质1 min。均质液在4℃条件下离心(10 000 r/min,20 min),上清液过滤除去脂肪。将滤液中的氧合肌红蛋白用稍过量的高铁氰化钾氧化后,用上述缓冲液在4℃条件下透析1 d,之后,在4℃条件下离心(12 000 r/min,20 min),用磷酸盐缓冲液将上清液定容至20 mL,即为粗酶液。
MRA测定参考文献[16]的方法并修改,取一定量的肌肉提取液加入到标准反应混合物中,在580 nm波长处测定MbO2和MMb的吸光度,MRA用反应线性阶段每克肉具有的活力单位(U/g)表征。
1.2.2NADH含量测定
参考文献[17],根据试剂盒说明书进行操作。称取0.1 g肉样中加入0.5 mL碱性提取液,冰浴研磨,煮沸5 min,冰浴冷却后,4℃条件下离心(10 000g,10 min),取上清200 μL,加入等体积酸性提取液混匀,4℃条件下离心(10 000g,10 min),取上清,然后测定。
1.2.3线粒体提取
按照试剂盒说明书进行。取肉样0.2 g,加入冰预冷的Lysis Buffer 1.0 mL,在冰浴条件进行20次研磨,随后4℃、1 000g离心5 min,重复1次。取上清,离心10 min(4℃,12 000g),弃上清,沉淀中加入Wash Buffer 0.5 mL重新悬浮线粒体沉淀,离心(4℃、1 000g)5 min,取上清,离心(4℃、12 000g)10 min,弃上清,线粒体沉淀在管底,用0.1 mL Store Buffer重新悬浮沉淀,-80℃保存待用。
1.2.4线粒体膜通透性测定
参考文献[18]的方法并做修改。取肉样3 g,加入30 mL分离液(250 mmol/L蔗糖,10 mmol/L Tris-HCl,1 mmol/L EDTA,pH值7.4),匀浆后离心15 min(4℃,1 500g),将上清液离心20 min(4℃,12 000g),用分离液洗涤沉淀两次后溶于缓冲液(250 mmol/L蔗糖,10 mmol/L Tris-HCl,pH值7.4)中,即得到线粒体悬浮液,测定蛋白浓度并稀释。取0.3 mL稀释溶液加入到2.7 mL测试溶液(230 mmol/L甘露醇,70 mmol/L 蔗糖,3 mmol/L Hepes,pH值7.4)中,25℃水浴3 min后,于540 nm处测吸光度。另外,以3 mL测试溶液作为对照。
1.2.5线粒体膜电位测定
按照试剂盒说明书进行测定。线粒体蛋白(0.1 mg/mL)与9倍体积的JC-1染色工作液混合。在490 nm的激发波长、530 nm的发射波长和525 nm的激发波长、590 nm的发射波长条件下测定溶液单体荧光值和聚集态荧光值。单体荧光值与聚集态荧光值的比值即为线粒体膜电位。
1.2.6SDH活力测定
根据试剂盒说明书测定。在0.5 g肉样中加入0.86%的生理盐水4.5 mL,冰浴匀浆后在4℃、1 000g条件下离心10 min,取上清测定。
1.2.7色调角测定
参考文献[19]的方法,采用色差仪测定样品的a*、b*值,运用arctan(b*/a*)计算色调角[20]。
1.3 数据处理
用SPSS 19.0软件做方差分析、相关性分析,多重比较采用Duncan法,Origin 9.0软件绘制图形,所有的指标测定3次,试验结果以“平均数±标准差”来表示。
2 结果与分析
2.1 MRA
MRA是肉色保持稳定的主要影响因素[21]。从图1(大写字母表示组内差异显著,小写字母表示组间差异显著(P<0.05),下同)可知,随着时间的延长,冰温组和冷藏组MRA均呈逐渐下降的趋势。冰温组在贮藏3、5、7、9 d时,MRA显著高于冷藏组(P<0.05),9 d时,冰温组的MRA比冷藏组高16.67%(P<0.05)。由此可见,冰温贮藏延缓了藏羊肉MRA的下降。这可能是由于温度对高铁肌红蛋白还原酶活性的影响[22]。该结果与文献[4]报道的冰温对高铁肌红蛋白还原活性影响的结果相似。

图1 冰温贮藏对藏羊肉MRA的影响Fig.1 Effects of controlled freezing point storage on MRA in Tibetan sheep meat
2.2 NADH含量
线粒体外膜NADH依赖型的MMb还原酶的酶促还原反应是线粒体将MMb还原的途径之一[23]。在糖酵解和细胞呼吸作用的柠檬酸循环中产生NADH,NADH是辅酶,作为电子供体在MMb还原过程中发挥作用[17]。从图2可知,随着时间的增加,冰温组和冷藏组NADH含量均呈逐渐下降的趋势。在第9天时,冰温组NADH含量(质量摩尔浓度)比冷藏组高33.16%(P<0.05)。由此可见,冰温贮藏可延缓NADH含量的下降,可能由于冰温贮藏延缓了藏羊肉骨骼肌呼吸功能的破坏[24]。

图2 冰温贮藏对藏羊肉NADH含量的影响Fig.2 Effects of controlled freezing point storage on NADH content in Tibetan sheep meat
2.3 线粒体膜通透性
线粒体膜的通透性指数常用540 nm处吸光度表示,其越小,表示透过线粒体膜的光越多,线粒体膜通透性越大[18]。从图3可知,在冰温和冷藏贮藏条件下吸光度随着贮藏时间的延长而逐渐下降,表明了线粒体膜的通透性不断增加。在第9天时,冰温组的吸光度比冷藏组高25.45%(P<0.01)。由此表明,冰温贮藏可延缓线粒体膜通透性的增大,这可能由于冰温贮藏延缓了线粒体结构的损伤[24]。

图3 冰温贮藏对藏羊肉线粒体膜通透性的影响Fig.3 Effects of controlled freezing point storage on mitochondrial membrane permeability in Tibetan sheep meat
2.4 线粒体膜电位
线粒体膜通透性与线粒体膜电位的变化是线粒体膜损伤的标志[18]。由图4可见,在冰温和冷藏两种贮藏条件下,线粒体膜电位随着时间的增加而下降。在第9天时,冰温组藏羊肉线粒体膜电位比冷藏组高16.57%(P<0.05)。由此可见,冰温贮藏可延缓藏羊肉贮藏过程中线粒体膜电位的下降,这可能是由于冰温抑制了线粒体膜的改变。

图4 冰温贮藏对藏羊肉线粒体膜电位的影响Fig.4 Effects of controlled freezing point storage on mitochondrial membrane potential in Tibetan sheep meat
2.5 SDH活力
SDH是线粒体的标志酶,它的活性能反映线粒体的功能[25]。从图5可知,在冰温和冷藏两种贮藏条件下SDH活力随宰后贮藏时间的延长而显著降低。在第9天时,冰温组SDH活力显著高于冷藏组(P<0.05),比冷藏组高40.45%(P<0.05)。由此可见,冰温可延缓SDH活力的下降,这可能是由于低温延缓了酶活性的降低。
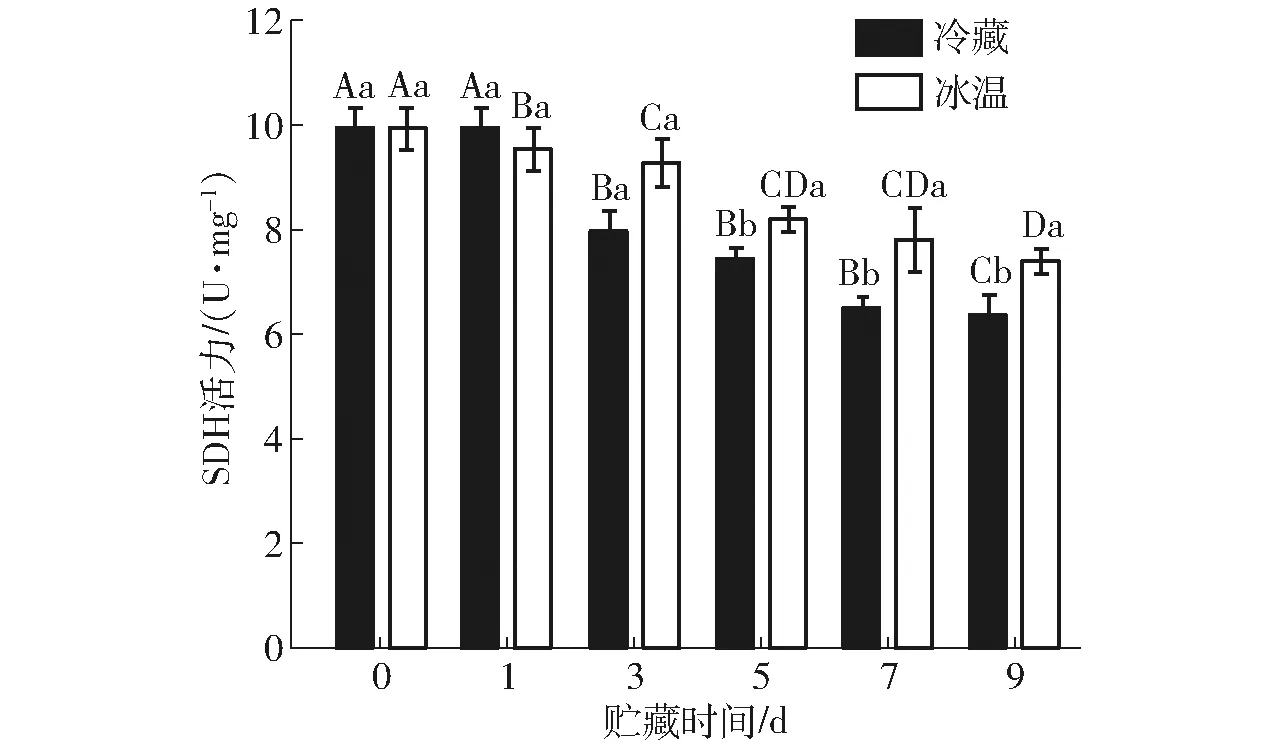
图5 冰温贮藏对藏羊肉SDH活力的影响Fig.5 Effects of controlled freezing point storage on SDH activity in Tibetan sheep meat

图6 冰温贮藏对藏羊肉色调角的影响Fig.6 Effects of controlled freezing point storage on Hue angle in Tibetan sheep meat
2.6 色调角
色调角代表褪色程度,其值越大,表明褪色速率越快[26]。由图6可看出,冷藏组与冰温组的色调角总体呈现先上升后稳定的趋势。在第9天时,冰温组色调角比冷藏组低13.13%(P<0.01)。本研究表明,冰温贮藏可延缓色调角的上升,可能是由于冰温延缓了MMb的形成,因而有利于保持肉色稳定[27]。
2.7 线粒体高铁肌红蛋白还原能力与肉色稳定性的相关性
由表1可知,冰温组、冷藏组MRA、NADH含量、线粒体膜540 nm处吸光度、线粒体膜电位、SDH活力均与色调角呈极显著负相关(P<0.01)。由此可见,MRA、NADH含量越高,线粒体结构损伤程度越小,MMb还原能力越强,色调角越低,肉的颜色越稳定。MMb还原酶是高铁肌红蛋白酶促还原反应的关键酶,在NADH存在的条件下,它可将高铁肌红蛋白还原[28]。而且,畜禽宰后贮藏受损的线粒体结构会导致肉色稳定性显著降低[21]。因此,MRA、NADH含量越高,线粒体结构损伤程度越小,肉色越稳定。本试验结果与文献[4]报道的冰温贮藏通过影响大尾寒羊与小尾寒羊杂交公羊肉高铁肌红蛋白还原酶活性及NADH浓度调控肉色稳定的结果相似。
3 结束语
贮藏9 d时,冰温组MRA、NADH含量、线粒体膜的通透性指数、线粒体膜电位和SDH活力分别比冷藏组高16.67%、33.16%、25.45%、16.57%和40.45%。色调角比冷藏组低13.13%。因此,冰温贮藏延缓了藏羊肉MRA、NADH含量、线粒体膜540 nm处吸光度、线粒体膜电位和SDH活力的降低,色调角的升高,有利于维持线粒体高铁肌红蛋白还原能力,延缓线粒体结构的损伤,进而维持藏羊肉色的稳定。

表1 冰温与冷藏两种条件贮藏过程中各指标间的相关性Tab.1 Correlation coefficients of various indicators under controlled freezing point storage and cold storage
