樱桃链格孢菌叶斑病拮抗链霉菌的筛选与鉴定
2022-06-20刘雨芹魏有海郭良芝郭青云
刘雨芹,杨 莹,魏有海,郭良芝,程 亮,郭青云
(青海大学农林科学院,青海省农业有害生物综合治理重点实验室,青海 西宁 810016)
樱桃(Prunusavium)又名含桃,其果实色泽鲜艳,营养丰富,酸甜可口,成熟期早,具有较高的经济价值[1],近年来,在我国各省市得到大面积推广栽培[2],同时伴随的病害问题也愈加凸显。其中,叶斑病是世界范围内樱桃产区普遍发生且比较严重的病害之一,直接影响樱桃叶片的光合作用[3],削弱树势,给果农造成巨大的经济损失[4]。目前,樱桃叶斑病菌主要有Blumeriellajaapii[5-6]、Alternariaalternata[7]、Passaloracircumscissa[4]、Pseudocercosporapruni-persicicola[8]等。放线菌,尤其是链霉菌,存在于不同类型的土壤和水中,能够产生多种抗菌活性的抗生素,已在生物防治上广泛应用[9-11]。瞿佳等[12]从核桃树根际土壤中筛选出具有拮抗作用的暗蓝色链霉菌(Streptomycescaeruleatus)WMF106菌株,其无菌发酵滤液原液对离体叶片上由野油菜黄单胞菌(Xanthomonascampestris)和成团泛菌(Pantoeaagglomerans)造成的核桃黑斑病防治效果分别达到77.44%和58.33%。李志田等[13]研究发现,分离自青海地区土壤中的浑圆链霉菌(Streptomycesglobosus)对桃细菌性穿孔病菌(Xanthomonasarboricola)和草莓炭疽病菌(Strawberryanthracnose)具有明显的拮抗作用。刘俏等[14-15]在对青海地区的樱桃叶斑病调查中发现其主要病原菌为链格孢菌属(Alternariaspp.)和刺盘孢菌属(Colletotrichumspp.)。其中,链格孢菌属中的Alternariaalternata是引起青海樱桃叶斑病的优势病原菌,其分离频率达84.95%。目前,防治樱桃叶斑病主要是依靠化学防治,但化学农药在抑制樱桃叶斑病发生的同时,也存在防治效果不稳定、农药残留高及病害易复发等负面问题[15]。近年来,微生物菌剂因其绿色环保无污染等特性,受到广泛关注,其中放线菌产生的多种天然抗生素已成为广泛应用的次级代谢产物[16-17],并已在农业生产中广泛应用,但利用放线菌防治樱桃叶斑病的研究仍然不足。因此,筛选拮抗樱桃叶斑病病原菌的放线菌,对樱桃叶斑病的生物防治具有重要意义。本研究从发病樱桃根际土壤中筛选出具有高效拮抗樱桃链格孢叶斑病菌的生防链霉菌株,为樱桃叶斑病的生物防治方法提供参考依据。
1 材料与方法
1.1 试验材料
供试樱桃叶斑病病原菌由青海大学农林科学院植物保护研究所课题组分离、鉴定和保存。供试樱桃品种为“萨米脱”;拮抗菌菌源土采自青海省海东市乐都区发病樱桃根际土壤;供试拮抗菌菌株分离和发酵培养基分别为Gause′s No.1培养基和小米培养基,拮抗菌培养特征观察培养基为PDA培养基、Gao′s No.1培养基、Gao′s No.2培养基、OA培养基、Czapek-Dox培养基和LB培养基。配制方法参照文献[15]。
1.2 试验方法
1.2.1 菌株的分离 使用点取样法,取青海省海东市乐都区发病樱桃根际土壤,按土壤放线菌的标准方法分离放线菌。将土壤样品自然风干后混匀,将10 g土壤样品和90 mL无菌水混匀后制备成土壤稀释液,稀释至10-1、10-2、10-3和10-4等不同梯度,分别涂布于Gause′s No.1培养基上,于28 ℃培养箱中培养5 d,根据不同个体菌落的菌丝形态生长特点和其他菌丝生长特性等,挑取不同的单菌落进行纯化。
1.2.2 生防放线菌菌株的初筛 采用琼脂块平板对峙培养法[12],在PDA平板上接种供试的樱桃叶斑病菌,在28 ℃的培养箱中培养3 d,用直径为5 mm的灭菌打孔器打取菌饼,用无菌接种针将菌饼接种于PDA平板中心,菌丝表面向下。采用同样的方法将培养7 d的生防放线菌菌株,在樱桃叶斑病菌菌饼四周均匀反贴4个待测放线菌菌饼,以仅接种樱桃叶斑病菌的平板为对照,每种处理重复3次,于28 ℃培养箱中培养,每天观察并记录病原菌菌落直径,7 d后计算抑菌率。

1.2.3 生防放线菌菌株无菌发酵液制备 将生防菌株接种于Gause′s No.1培养基上,28 ℃培养7 d。从该平板取直径为8 mm的圆形菌饼,放入300 mL三角瓶中,再装入60 mL的小米液体培养基,放入温度为28 ℃,220 r/min的搅拌摇床中振荡培养5 d,发酵产物在10 000 r/min的离心机下离心10 min,得到了小米发酵滤液,然后经无菌微孔滤膜(0.22 μm)过滤,放4 ℃冰箱保存备用。
1.2.4 生防放线菌菌株的复筛 采用生长速率法,在培养皿中加入无菌发酵滤液1 mL,与冷却至50 ℃左右的9 mL PDA培养基充分混匀后至凝固。用直径为5 mm无菌打孔器打出樱桃叶斑病菌菌饼,将其向下放置于平板的正中心,以无菌水与PDA制成的平板为对照,在28 ℃下培养,用十字交叉法测量培养7 d后的菌落直径并计算抑菌率。
1.2.5 生防放线菌菌株的离体筛选 选取健康完整、叶龄相同的“萨米脱”樱桃叶片,对其进行消毒处理,然后放在灭菌滤纸上晾干,使用无菌昆虫针在叶背主叶脉两侧针刺6个对称的伤口,用移液器在伤口上滴加30 μL 1×105个/mL的樱桃叶斑病菌孢子悬浮液,28 ℃下放置2 h自然晾干,于24 h和48 h后分别滴加30 μL 1×108cfu/mL的生防菌菌悬液和250 g/L嘧菌酯悬浮剂500倍液,以无菌水处理做对照,每个处理3片叶,3次重复,同样晾干后置于培养皿中并保湿,在温度28 ℃、相对湿度80%的条件下进行12 h 6 000 lx光照,12 h黑暗培养。每天记录樱桃叶片的病斑直径,7 d后计算抑菌率。
1.2.6 拮抗菌株的鉴定 在6种不同的培养基(PDA、LB、Czapek-Dox培养基、OA培养基、Gao′s No.1培养基和Gao′s No.2培养基)上分别接种放线菌菌株,放入28 ℃的培养箱中培养,在7~15 d内进行观察并记录其生长情况。生理生化特性鉴定参考《放线菌快速鉴定与系统分类》[18]方法。分子生物学鉴定采用CTAB法提取待测菌株的基因组DNA,使用引物(正向7F:5′-CAGAGTTTGAT CCTGGCT-3′;反向1540R:5′-AGGAGGTGATCCAGCCGCA-3′)进行16S rRNA片段扩增,扩增产物由生工生物工程(上海)股份有限公司进行测序。将其与研究相关所得的16S rRNA基因序列组合在NCBI的Blast Search功能对放线菌菌株基因进行相似性基因检索,从GenBank数据库中已知序列进行BLAST比对分析,采用MEGA5.1中邻接法(Neighbor-Joining)构建系统进化树。
1.3 数据处理
所有数据均使用SPSS 22.0软件进行差异显著性分析,采用单因素随机区组试验设计和新复极差法(Duncan)进行多重比较分析处理。
2 结果与分析
2.1 樱桃叶斑病菌拮抗放线菌的筛选
对分离的56株放线菌采用平板对峙法进行筛选,其中对樱桃叶斑病菌具有抑制作用的有4个放线菌菌株,分别为5-16、5-17、3-22、7-1,部分结果见表1和图1。抑菌率均在64%以上,其中3-22菌株的抑菌率达到了76.39%(表1)。4个菌株的抑菌带边缘菌丝稀疏,镜检观察发现,抑菌带周围樱桃叶斑病菌的部分菌丝扭曲、断裂,分生孢子膨大、畸形(图1),说明拮抗放线菌对樱桃叶斑病菌的生长有明显的抑制作用。

表1 拮抗菌株对樱桃叶斑病菌的抑制效果

图1 拮抗樱桃叶斑病菌生防放线菌的筛选Fig.1 Screening of biocontrol Actinomycetes against antagonistic Prunus avium leaf spot
2.2 拮抗放线菌无菌滤液对樱桃叶斑病菌的抑菌活性
由表2可知,放线菌3-22菌株和5-16菌株的抑菌效果较好,处理后7 d对樱桃叶斑病菌的抑菌率分别为84.44%和79.17%,菌落直径分别为13.47 mm和18.03 mm。5-17菌株的无菌滤液对樱桃叶斑病菌的抑菌效果最低,仅为73.43%。3-22菌株与其他3个菌株的抑菌率相比,在P<0.05水平抑制作用有显著性差异。图2为4株放线菌菌株无菌滤液对樱桃叶斑病菌的菌落直径的抑制作用。
图2 拮抗放线菌无菌滤液对樱桃叶斑病菌的抑菌活性Fig.2 Antibacterial activity of sterile filtrate of antagonistic actinomycetes against Prunus avium leaf spot
2.3 生防放线菌菌株的离体叶片筛选结果
由表3可知,不同放线菌菌株对离体叶片叶斑病具有一定的防治效果,其中放线菌3-22菌株的抑菌效果最好,与250 g/L嘧菌酯悬浮剂500倍液的抑菌率差异不显著(P=0.05)。不同时间的处理结果表明,早接种拮抗放线菌的效果高于晚接种的效果,尤其是早接种的保护作用好于晚接种的保护作用。其中,3-22菌株在24 h后接种处理的抑菌率为79.75%,而48 h后接种处理的抑菌率为75.54%。

表3 不同放线菌悬浮液对樱桃叶片病斑直径的影响
2.4 拮抗放线菌的形态学观察及生理生化特性分析
2.4.1 形态学特征 用电子显微镜对4株菌株进行观察,其成熟孢子丝形成的孢子链均呈串珠状,孢子为柱形,表面光滑无刺(图3),此特征为链霉菌属的一种典型形态学特征。

图3 放线菌菌株5-16、5-17、3-22和7-1在电子显微镜下的形态特征Fig.3 Morphological characteristics of actinomycete strains 5-16,5-17,3-22 and 7-1 under electron microscope
将4株放线菌接种于6种测试培养基,在28 ℃培养48~72 h后开始有菌落出现,5 d后开始产生孢子。菌落在不同的培养基上生长情况均不同,结果见表4。5-16菌株在Gao′s和Czapek-Dox培养基表面生长紧密,气生菌丝随着时间的推移逐渐发育变深,由白色变成灰色或深灰色。但在LB、OA和PDA培养基上气生菌丝颜色较浅,多为白色或灰白色,该菌株在这6种培养基上均不产生可溶性色素,基内气生菌丝呈现不同的颜色,在LB培养基上生长一般。5-17菌株在Gao′s No.1、Gao′s No.2和OA培养基上分别产生褐色、中赭黄色和橘黄色的可溶性色素,在另外3种培养基上不产生可溶性色素,气生菌丝为白色到深灰色等不同颜色。3-22菌株和7-1菌株在6种培养基上均不产生可溶性色素,气生菌丝的颜色多为白色和灰色。

表4 5-16、5-17、3-22、7-1菌株在6种不同培养基上的培养特征比较
2.4.2 生理生化特性 参照《放线菌快速鉴定与系统分类》[18]鉴定方法,对4个菌株进行生理生化鉴定,结果显示4个菌株明胶液化、淀粉水解、硝酸盐还原、阿拉伯糖、纤维二糖、葡萄糖、果糖、木糖醇、木糖、甘露醇、赤藓糖醇、鼠李糖、甘露醇和肌醇为阳性,蜜二糖、D-山梨糖醇、牛奶凝固、纤维素水解、硫化氢、吲哚反应、甲基红反应和V-P试验为阴性,与链霉菌具有相同的生理生化特性(表5)。

表5 4株拮抗放线菌的生理生化特征
2.4.3 16S rDNA基因序列分析 以5-16、3-22、5-17菌株和7-1菌株基因组DNA为模板,扩增获得相应菌株的16S rDNA序列长度分别为1 468 bp、1 469 bp、1 425 bp和1 469 bp(图4)。基于16S rDNA基因序列的系统发育分析结果表明(图5),4个菌株与链霉菌菌株处于同一分支,一致性高达99%。结合其形态学特征、生理生化特性及基于16S rDNA基因序列的系统发育分析结果,将4个菌株鉴定为链霉菌属(Streptomycessp.)。
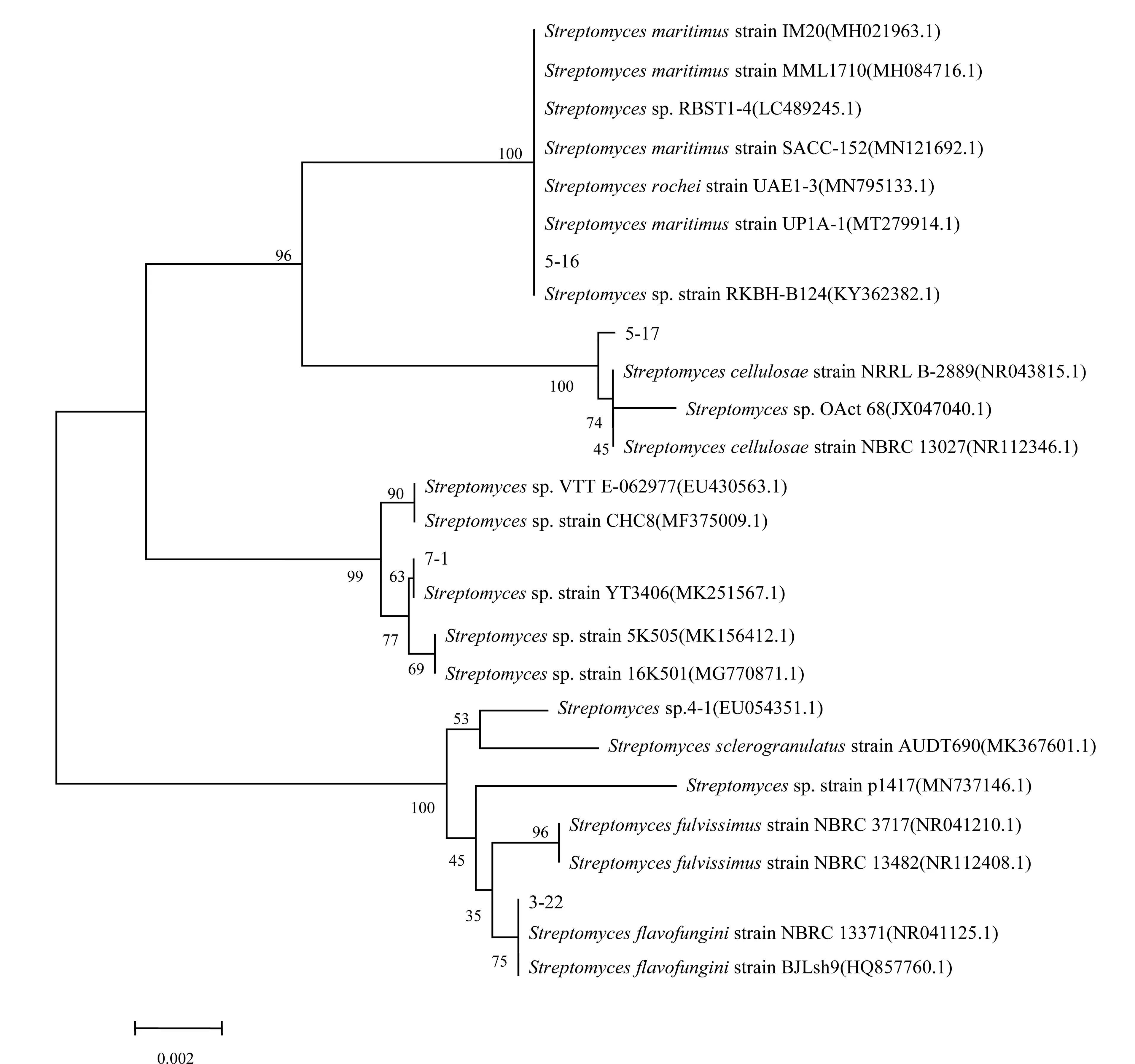
图5 基于16S rDNA基因序列Blast结果构建的4个菌株系统发育树图Fig.5 Phylogenetic tree constructed according to Blast results of 16S rDNA genes
3 讨论与结论
链霉菌属是放线菌类群中常见的成员之一,具有防病抗菌功能,且抑菌谱广,可产生多种抗生素,在生物农药和生物制剂开发方面具有潜在的应用价值。国内学者研究表明链霉菌对蓝莓溃疡病(Botryosphaeriadothidea)[19]和葡萄霜霉病(Plasmoparaviticola)[20]有不同程度的拮抗活性。Boukaew等[21]研究表明,生米卡链霉菌(S.mycarofaciensSS-2-243)对红辣椒树根茎性腐病(Ralstoniasolanacearum)、水稻白叶枯病(Xanthomonasoryzae)、番茄灰霉病(Botrytiscinerea)和马铃薯疮痂病(Streptomycesscabies)有不同程度的拮抗活性,在田间条件下能明显降低病害的发病率。同时,链霉菌属已被制成杀菌剂应用于植物病害的防治,在应用过程中发现其不仅能防治真菌病害,还能产生吲哚乙酸IAA等活性物质促进植物生长发育[22]。本研究从感病樱桃根际土壤中筛选得到1株拮抗链霉菌菌株3-22,该菌株对樱桃离体叶斑病菌表现较强的抑菌效果,与250 g/L嘧菌酯悬浮剂500倍液的抑菌效果相当,且越早接种拮抗菌对病害的控制越有利,与陆继臣等[23]报道的结果一致。由此可见,3-22菌株是一株较为理想的拮抗菌,可作为樱桃叶斑病链格孢菌的生防菌株。此外,通过形态学特征和16S rDNA鉴定,该菌株属于链霉菌属。但是关于3-22菌株在生物防治中的作用机理和在田间的拮抗效果仍需进一步探究。
