白酒糟和发酵白酒糟对西门塔尔杂交牛瘤胃发酵参数和微生物区系的影响
2022-06-20彭忠利吴华卓游茵洁王晨曦
刘 垚, 姜 菲, 彭忠利, 吴华卓, 游茵洁, 王晨曦
(西南民族大学畜牧兽医学院,青藏高原动物遗传资源保护与利用重点实验室,四川成都610041)
瘤胃是反刍动物重要的器官, 其具有强大的降解纤维物质的能力, 这种能力依赖于其中共生的各种瘤胃微生物(Roderick-I,2002),包括细菌、原虫、古细菌及真菌,这些微生物种群的活动对宿主的营养吸收和能量代谢起到极其重要的作用(Xu 等,2015)。动物的年龄、饲粮结构和健康状况等均会影响瘤胃发酵参数和微生物区系(Carberry等,2012),其中饲粮结构是最主要的因素。目前反刍动物营养学中普遍持有的观点是瘤胃微生物高度适应不同的饲粮结构 (Pitta 等,2014;Mullins等,2013)。 目前将白酒糟作为饲料利用的主要方式有鲜酒糟直接饲用、 烘干饲用及微生物发酵后饲用等方式, 而鲜酒糟直接饲用有水分大、 酸度高、极易腐败变质等诸多不足(刘志云等,2020)。与玉米相比,白酒糟中粗蛋白质含量较高,淀粉含量较少,含有大量稻壳,导致其纤维含量高,影响其利用效率(杨艳红,2016)。通过微生物发酵可有效改善酒糟的营养特性, 微生物能够将酒糟中的纤维素等物质转化为短链脂肪酸, 并可产生各种生物酶, 进而提高利用效率 (宋善丹等,2015;Lumpkins 等,2005)。 研究发现,在羔羊饲粮中添加酒糟对胴体品质和生长性能没有影响, 但可提高瘤胃中挥发性脂肪酸的含量(Crane 等,2017)。饲喂干酒糟能提高公牛的生长性能及肉品质(Viviane 等,2020)。
在我国,西门塔尔杂交牛(西门塔尔牛×本地黄牛,以下简称西杂牛)是主要的肉牛养殖品种之一, 白酒糟作为饲料原料在西杂牛生产中具有广阔的应用前景。 本试验拟采用白酒糟和发酵酒糟替代部分牧草,饲喂育肥肉牛,进而探索不同处理方式的白酒糟对西杂牛瘤胃发酵参数和微生物多样性的影响, 以期为酒糟饲料的合理开发和高效利用提供参考。
1 材料与方法
1.1 试验时间和地点 本试验在四川省宜宾市长宁县九牛肉牛养殖有限公司进行。试验开始前,做好圈舍清洁和消毒等准备工作, 对所有牛免疫驱虫。牛只分栏拴系饲养,正试期以预饲期采食量为参考投喂全混合日粮, 每日饲喂2 次 (7:00 和16:00),牛只均自由采食和饮水,饲养期间保持圈舍整洁通风。
1.2 试验设计 选取49 头体重相近[(491.35±48.32)kg]、 健康状况良好的西门塔尔杂交公牛进行育肥试验, 在其饲粮中以粗料的形式分别用一定量的白酒糟和发酵酒糟替换等量皇竹草(干物质基础),按照体重相近的原则随机分为七个处理组,分别为试验1 组(对照组0%)、试验2 组(20%白酒糟)、试验3 组(40%白酒糟)、试验4 组(60%白酒糟)、试验5 组(20%发酵白酒糟)、试验6 组(40%发酵白酒糟) 和试验7 组 (60%发酵白酒糟),每个处理7 个重复,每个重复1 头牛。预饲期15 d,正饲期60 d。
1.3 试验饲粮 试验饲粮由精料(玉米、浓缩料)和粗料(皇竹草、白酒糟、发酵白酒糟)组成,白酒糟和发酵白酒糟饲粮分别是以20%、40%和60%白酒糟或发酵白酒糟替换基础饲粮中等量皇竹草配制的全混合日粮, 各处理组饲粮组成及营养水平(干物质基础)见表1。

表1 饲粮组成及营养水平(干物质基础)
1.4 样品采集及指标测定
1.4.1 瘤胃液的采集 试验结束当天晨饲前,采用口腔导管采集瘤胃液,弃去最初的50 mL(避免唾液的影响), 瘤胃液采集后使用PHB-5 型便携式pH 计立即测定pH,然后分装于15 mL 离心管和5 mL 冻存管中,15 mL 离心管-20 ℃保存,用于氨态氮(NH3-N)、微生物蛋白(MCP)、挥发性脂肪酸(VFA)的测定;5 mL 冻存管立即投入液氮中保存,用于细菌菌群多样性的测定。
1.4.2 指标的测定 饲粮中干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、粗灰分(Ash)、钙(Ca)和磷(P)参照国家标准的测定方法进行,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的含量参照Van Soest 等(1991)方法进行测定。NH3-N 参照比色法(冯宗慈等,2010)测定。 MCP 参照考马斯亮蓝法测定(Bradford,1976)。VFA 用Agilent 6890N 气相色谱仪测定。
1.4.3 瘤胃细菌多样性 根据OMEGA-soil DNA试剂盒(USA)说明书进行总DNA 抽提,DNA 浓度和纯度利用NanoDrop2000 进行检测,利用1%琼脂糖凝胶电泳提取得到的DNA 进行质量检测;然后用338F (5'-ACTCCTACGGGAGGCAGCAG-3') 和806R (5'-GGACTACHVGGGTWTCTAAT-3')引物对V3 ~ V4 可变区进行PCR 扩增,扩增程序为:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s), 最后72 ℃延伸10 min (PCR 仪:ABI GeneAmpR9700 型)。扩增体系为20 μL,4 μL 5×FastPfu 缓冲液,2 μL2.5mM dNTPs,0.8 μL 引物 (5 μmol/L),0.4 μL FastPfu 聚合酶;10 ng DNA 模板。
使用2%琼脂糖凝胶回收PCR 产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行定量检测。 然后用纯化后的扩增片段构建Miseq PE 2×300 的文库, 采用Illumina MiSeq 平台(Illumina,San Diego,USA)进行测序(上海美吉生物医药科技有限公司)。
原始测序序列使用Trimmomatic 软件质控,使用FLASH 软件进行拼接, 使用的UPARSE 软件(version 7.1 http://drive5.com/uparse/)根据97%的相似度对序列进行OTU 聚类, 并在聚类的过程中去除单序列和嵌合体。 利用RDP classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释,比对Silva 数据库(SSU128),设置比对阈值为70%。
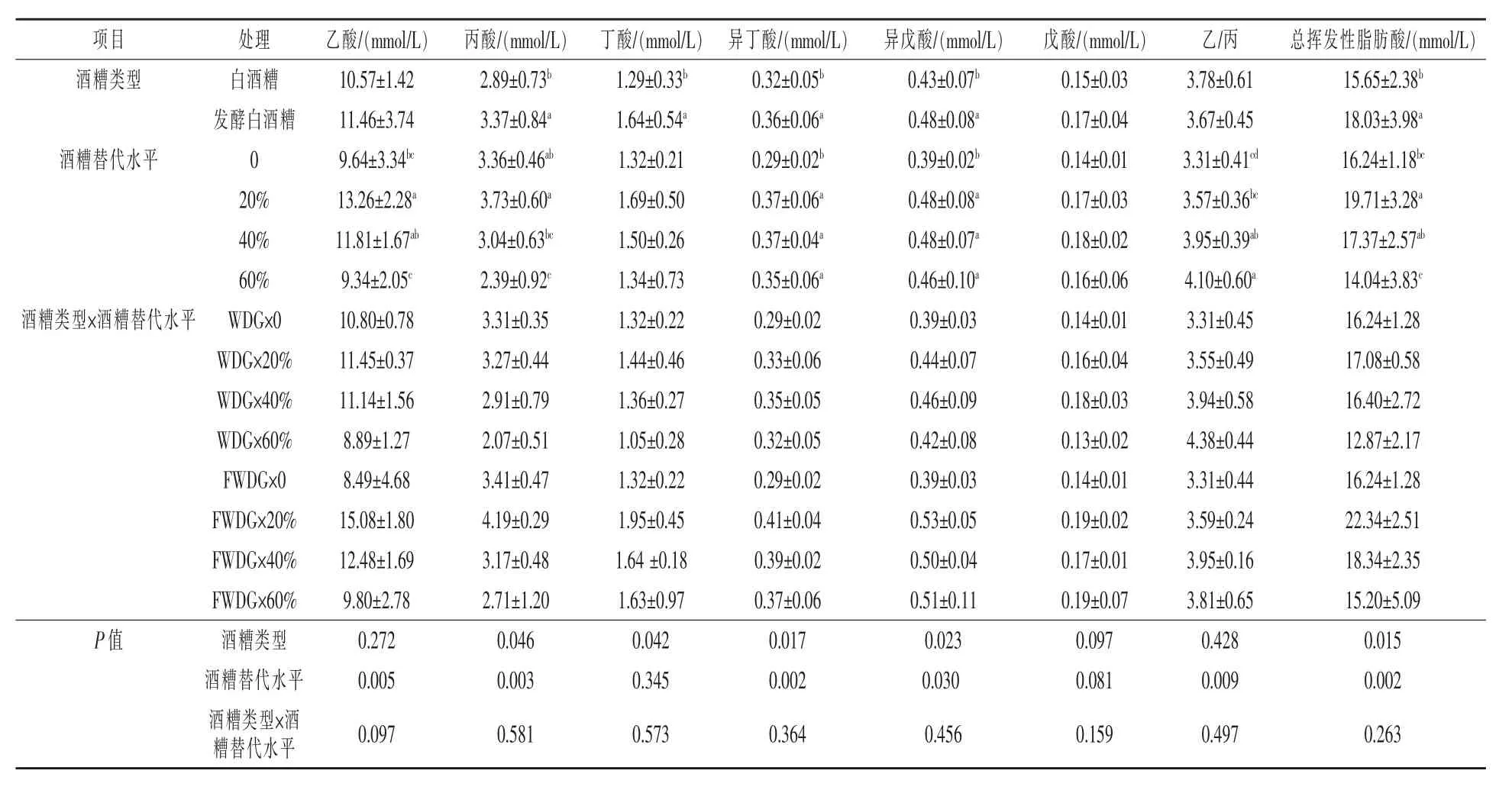
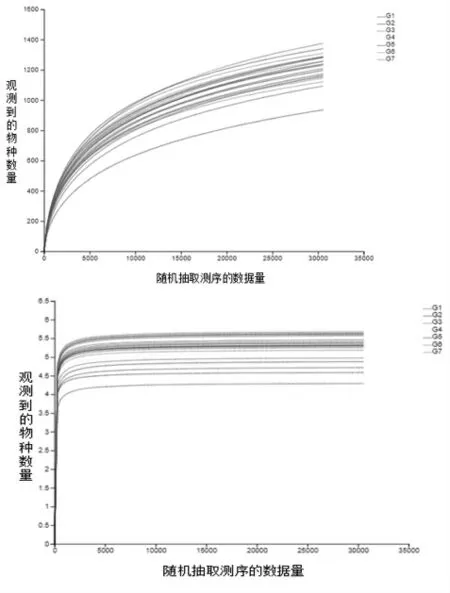
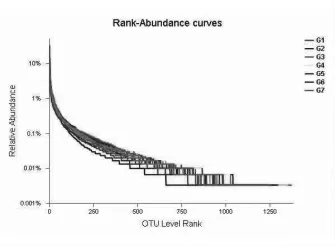
1.5 数据分析 数据通过Excel 2010 整理后,再使用SPSS 20.0 进行双因素方差分析, 采用Duncan's 法多重比较。结果以“平均值±标准差”表示,P< 0.05 表示差异显著,P> 0.05 表示差异不显著,0.05 2.1 白酒糟和发酵白酒糟对西杂牛瘤胃发酵参数的影响 2.1.1 白酒糟与发酵白酒糟对西杂牛瘤胃发酵VFA 组成的影响 由表2 可知, 酒糟类型对丙酸、丁酸、异丁酸、异戊酸以及总挥发性脂肪酸含量均有显著影响(P< 0.05),对乙酸、戊酸含量以及乙丙比无显著影响(P> 0.05),其中白酒糟组的丙酸、丁酸、异丁酸、异戊酸以及总挥发性脂肪酸含量均显著低于发酵白酒糟组(P< 0.05)。 饲粮中酒糟替代水平对乙酸、丙酸、异丁酸、异戊酸、总挥发性脂肪酸含量以及乙丙比均有显著影响(P<0.05),其中以替代20%酒糟组乙酸和总挥发性脂肪酸含量最高,显著高于对照组和替代60%组(P< 0.05),与替代40%组无显著差异(P> 0.05);对照组异丁酸和异戊酸含量显著低于替代20%、40%和60%酒糟组(P< 0.05)且替代水平间无显著差异(P> 0.05);丙酸以替代20%酒糟组含量最高, 显著高于替代40%和60%酒糟组 (P<0.05),与对照组无显著差异(P> 0.05);乙丙比以替代60%组含量最高, 显著高于对照组和替代20%组(P< 0.05),与替代40%组无显著差异(P>0.05)。 酒糟类型和酒糟替代水平对乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸、挥发性脂肪酸及乙丙比均无显著的互作效应(P> 0.05)。 表2 白酒糟与发酵白酒糟对西杂牛瘤胃VFA 组成的影响 2.1.2 白酒糟与发酵白酒糟对西杂牛瘤胃发酵pH、NH3-N 及MCP 的影响 由表3 可知,酒糟类型对pH、 氨态氮及微生物蛋白均有显著影响 (P<0.05),其中白酒糟替代组pH 和氨态氮均显著高于发酵白酒糟组(P< 0.05),但发酵白酒糟组微生物蛋白显著高于白酒糟组(P<0.05)。 酒糟添加水平对pH、 氨态氮及微生物蛋白均有显著影响 (P<0.05),其中对照组的氨态氮含量显著高于酒糟替代组(P< 0.05),同时随着酒糟替代量的升高显著降低(P<0.05);对照组MCP 含量显著低于酒糟替代组(P< 0.05),同时随着酒糟替代量的升高显著提高(P<0.05);而pH 则以酒糟60%替代组最高,显著高于对照组、酒糟20%和40%替代组(P<0.05),其中以酒糟20%替代组最低,均显著低于对照组和酒糟40%替代组,而对照组和酒糟40%替代组无显著差异(P>0.05)。 酒糟类型和酒糟添加水平对微生物蛋白(MCP)含量有显著的互作效应(P<0.05)。 表3 白酒糟与发酵白酒糟对西杂牛瘤胃发酵pH、NH3-N 及MCP 的影响 2.2 白酒糟和发酵白酒糟对西杂牛瘤胃微生物区系的影响 2.2.1 测序基本信息 如表4 所示, 通过Miseq测序,28 个瘤胃液样本共获得1788887 条优化序列,每个样本平均产生63889 条,序列平均长度为419.52 bp。 表4 样本测序基本信息 2.2.2 Alpha 多样性分析 如表5 所示, 七个处理组样本覆盖率达到98.9%以上, 说明测序深度高, 足以反映瘤胃菌群的丰富度及多样性,Shannon 指数和Simpson 指数反映物种多样性,Shannon 指数值越大,Simpson 指数值越小, 说明群落多样性越高,Ace 指数和Chao 指数可反映瘤胃菌群的丰度,由表可知,酒糟类型及替代水平对微生物多样性及丰度无显著影响且酒糟类型与酒糟添加量之间不存在交互作用(P> 0.05)。 表5 白酒糟和发酵白酒糟对西杂牛瘤胃细菌群落Alpha 多样性的影响 稀释曲线可以反映出各个处理组在不同测序数量时的微生物多样性, 曲线的趋势是否平坦可说明样本的测序数量是否合理。由图1 可得,各个处理组测序量在20000 条以上时, 物种数量逐渐趋于饱和,说明测序数据量逐渐接近最高值,反映出测序数据的合理及物种多样性信息具有代表性。多样性指数曲线可反映瘤胃细菌多样性,七个处理组曲线均趋于平坦, 其中试验5 组瘤胃细菌多样性最低,试验6 组最高,其余从高到低依次为试验7 组、3 组、1 组、4 组、2 组。 对照1 组和试验2、3、4 组群落多样性相差不大且略低于试验6 组和7 组。 图1 瘤胃细菌稀释性曲线(left)和多样性指数曲线(right)图 Rank-Abundance 分析可比较瘤胃细菌群落丰度和均匀度在饲粮中白酒糟和发酵白酒糟不同添加量下的差异。由图2 可知,对照组在图中横轴上的曲线长度最长,表明其物种丰度最高,然后依次是试验4 组、试验6 组、试验7 组、试验2 组、试验3 组、 试验5 组。 且各个处理组曲线均逐渐平直,说明七个处理组物种组成均匀度都较高。 图2 瘤胃细菌Rank-Abundance 分析图 2.2.3 瘤胃微生物菌群分析 瘤胃细菌OTU 分布的Venn 图可以反映各处理组中瘤胃细菌多样性相似程度。由图3 可知,试验1 组到7 组瘤胃中OTUs 总 数 分 别 为2021、1985、2000、1929、1887、1957、1896,相同用量下,白酒糟各组多样性均高于发酵白酒糟; 各组共有OTUs 数为1142, 独有OTUs 数分别为79、30、26、12、20、23、28, 占各自OTUs 总 数 的 3.91% 、1.51% 、1.30% 、0.62% 、1.06%、1.18%、1.48%。 图3 瘤胃细菌OTU 分布的Venn 图 美吉生物云交互分析结果显示, 经过序列对比和注释,28 个样本中共有2666 个OTU,从物种分类水平上分为21 个门,41 个纲,87 个目,156个科,390 个属,743 个种。由表6 可知,门水平上,七个处理组瘤胃微生物物种组成的相对丰度较高的门有6 个,分别为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋菌门(Spirochaetae)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和纤维杆菌门Fibrobacteres(Fibrobacteres)。 其中对照组相对丰度前6 的有Bacteroidetes、Firmicytes、Spirochaetae、Proteobacteria、Actinobacteria、Fibrobacteres,分别占瘤胃细菌的64.33%、27.71%、2.38%、1.13%、0.74%和1.32%, 试验2、3、4、5、6、7组的Bacteroidetes 分别占瘤胃细菌的64.53%、58.56%、64.73%、69.17%、65.03%和61.62%,Firmicutes 分别占瘤胃细菌的25.65%、32.69%、29.38%、25.35%、27.45%、30.23%,Spirochaetae 分别占瘤胃细菌的1.78%、1.44%、1.38%、1.02%、2.47%、1.98%,Proteobacteria 分别占瘤胃细菌的1.11%、1.11%、1.13%、1.66%、1.58%、2.00%,Actinobacteria 分别占瘤胃细菌的2.64%、3.25%、0.86%、0.45%、0.89%、0.67%,Fibrobacteres 分别占瘤胃细菌的2.81%、0.95%、0.54%、0.43%、0.73%、1.07%。 表6 白酒糟和发酵白酒糟对西杂牛瘤胃细菌丰度的影响(门水平)% 门水平差异性统计分析显示,西杂牛瘤胃主要优势菌门为拟杆菌门(Bacteroidetes) 和厚壁菌门(Firmicutes), 试验各组拟杆菌门和厚壁菌门差异都不显著(P> 0.05),其余4 种相对占比较大的门中仅放线菌门(Actinobacteria) 丰度有差异(P<0.05), 白酒糟替代组中放线菌门丰度显著高于发酵白酒糟组(P<0.05)。此外,随着白酒糟用量的升高,白酒糟各处理组中螺旋菌门(Spirochaetae)和纤维菌门(Fibrobacteres)丰度逐渐降低;随着发酵白酒糟用量的升高,发酵白酒糟各处理组中纤维菌门丰度逐渐升高,但各组差异均不显著(P>0.05)。 从属水平对七个处理组的瘤胃微生物物种组成相对丰度分析(表7),结果表明,七个处理组中相对丰度约在1.5%左右且含量在前8 以上的属中,含量最高的是普雷沃氏菌属1(Prevotella 1),其次是拟杆菌属BS11 (Bacteroidales BS11 gut group), 理研菌属RC9 (Rikenellaceae RC9 gut group), 普雷沃氏菌科UCG-003(Prevotellaceae UCG-003), 拟杆菌属RF16 (Bacteroidales RF16 group), 拟 杆 菌 属S24-7 (Bacteroidales S24-7 group),瘤胃球菌属2(Ruminococcus 2),疣微菌科NK4A214(Ruminococcaceae NK4A214 group)。对照组(1 组)瘤胃菌属相对丰度在1.5%左右且含 量 在 前8 的 属 中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG-003、Bacteroidales RF16 group、Bacteroidales S24 -7 group、Ruminococcus 2 和Ruminococcaceae NK4A214 分别占瘤胃细菌的24.43% 、13.89% 、8.49% 、6.30% 、2.17% 、1.79% 、1.60%和1.87%。试验2 组瘤胃菌属相对丰度约在1.5%左右且含量在前8 的属中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG -003、Bacteroidales RF16 group、Bacteroidales S24 -7 group、Ruminococcus 2 和Ruminococcaceae NK4A214 分 别占瘤胃细菌的25.81%、11.51%、6.77%、4.83%、3.14%、4.52%、2.36%和1.59%。 试验3 组瘤胃菌属相对丰度约在1.5%左右且含量在前8 的属中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG-003、Bacteroidales RF16 group、Bacteroidales S24-7 group、Ruminococcus 2 和 Ruminococcaceae NK4A214 分别占瘤胃细菌的30.56%、5.80%、6.49%、2.79%、2.70%、3.63%、3.57%和2.35%。 试验4 组瘤胃菌属相对丰度约在1.5%左右且含量在 前8 的 属 中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG-003、Bacteroidales RF16 group、Bacteroidales S24-7 group、Ruminococcus 2 和Ruminococcaceae NK4A214 分别占瘤胃细菌的20.53% 、17.32% 、7.25% 、2.73% 、6.13% 、2.47% 、2.95%和2.03%。试验5 组瘤胃菌属相对丰度约在1.5%左右且含量在前8 的属中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG -003、Bacteroidales RF16 group、Bacteroidales S24 -7 group、Ruminococcus 2 和Ruminococcaceae NK4A214 分 别占瘤胃细菌的22.17%、21.25%、6.09%、3.78%、6.08%、3.18%、2.77%和1.55%。 试验6 组瘤胃菌属相对丰度约在1.5%左右且含量在前8 的属中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG-003、Bacteroidales RF16 group、Bacteroidales S24-7 group、Ruminococcus 2 和 Ruminococcaceae NK4A214 分别占瘤胃细菌的26.32%、8.19%、6.99%、5.46%、4.05%、2.85%、3.05%和2.33%。 试验7 组瘤胃菌属相对丰度约在1.5%左右且含量在前8 的 属 中,Prevotella 1、Bacteroidales BS11 gut group、Rikenellaceae RC9 gut group、Prevotellaceae UCG-003、Bacteroidales RF16 group、Bacteroidales S24-7 group、Ruminococcus 2 和Ruminococcaceae NK4A214 分别占瘤胃细菌的29.92%、4.34%、4.54%、3.19%、4.21%、2.91%、3.40%和1.99%。 表7 白酒糟和发酵白酒糟对西杂牛瘤胃细菌丰度的影响(属水平)% 属水平差异性统计分析显示, 各处理组丰度大于1.5%的8 中菌属中, 是瘤胃主要的优势均属,各处理组普雷沃氏菌属(Prevotella 1)均无显著差异(P> 0.05);随着发酵白酒糟用量的增加,40%替代组和60%替代组中拟杆菌属BS11(Bacteroidales_BS11_gut_group) 丰度较20%替代组显著降低;白酒糟60%替代组拟杆菌科RF16(Bacteroidales RF16 group) 丰度较其他组显著提高(P< 0.05), 而发酵白酒糟20%替代组拟杆菌科RF16 丰度显著高于对照组(P< 0.05);随着替代比例的增加,40%和60%发酵白酒糟替代组较对照组瘤胃球菌属2(Ruminococcus_2)丰度显著升高(P< 0.05)。各处理组其他几种菌属丰度差异不显著(P> 0.05)。 Beta 多样性分析通过对不同生境或微生物群落间的物种多样性进行组间比较分析,探索不同分组样本间群落组成的相似性或差异性,其中主坐标分析(PCoA)图中样本之间的距离代表两者的相似度,距离越近则相似度越高。从图4 可以看出,本试验中试验5 组两个重复偏离较远,其他样本点出现交叉现象,说明相似度水平较高。 图4 瘤胃微生物主坐标分析 3.1 白酒糟和发酵白酒糟对西杂牛瘤胃发酵参数的影响 反刍动物瘤胃发酵产生的VFA 可为机体提供70% ~ 80%的能量,同时也可为瘤胃微生物的增殖提供碳架 (王玲,2016;Spears 等,2004), 其中乙酸、 丙酸和丁酸含量占TVFA 的95%左右, 丙酸可作为糖异生的原料合成葡萄糖为机体提供能量(丁健,2013),进而提高动物的生产性能及饲料利用率。本试验结果显示,发酵白酒糟组丙酸、丁酸、异丁酸、异戊酸及TVFA 含量显著高于白酒糟组, 同时也有研究发现饲料中添加发酵酒糟相比添加干酒糟更能提高瘤胃中丙酸、丁酸和TVFA 的含量(汪成等,2021),与本研究结果相近, 可能是由于发酵酒糟中纤维含量较低,同时含有多种有益微生物和生长促进因子,有利于瘤胃微生物的生长繁殖,从而提高动物对饲料的利用效率,说明饲料中添加发酵酒糟可为机体提供更多的可消化能。 从酒糟添加水平上,本研究发现20%的酒糟添加量更有利于乙酸、 丙酸和TVFA 的生成,而60%的添加量显著降低了三者的含量,说明添加过高的酒糟不利于瘤胃VFA 生成。 瘤胃pH 是反映反刍动物瘤胃生理状况的重要指标也是瘤胃生理状况的最直接表现, 对瘤胃功能、 瘤胃发酵产物及瘤胃微生物区系等有重要影响(Nagaraja 等,2007)。 pH 的大小主要取决于瘤胃VFA、乳酸等有机酸的含量。 pH 过低,就会引起反刍动物瘤胃酸中毒, 过高就会影响反刍动物瘤胃VFA 的产生,导致机体供能不足。 有研究表明,当反刍动物瘤胃发酵pH 低于6.1 时,瘤胃内纤维素降解菌活动就会因为酸度过高而受到抑制,当pH 低于5.9 时停止活动(Miwa 等,1997)。另有研究报道,瘤胃发酵正常pH 为6 ~ 7(James等,1997)。 本试验中,各处理组的瘤胃发酵pH 均在正常范围内, 说明在本试验条件下添加白酒糟和发酵白酒糟对瘤胃pH 没有造成不利影响。 pH的大小与饲料组成密切相关(Yang 等,2001)。 本研究发现添加发酵白酒糟组pH 显著低于添加白酒糟组, 与前人研究结果相比干酒糟添加发酵酒糟显著降低了瘤胃pH(汪成等,2021)相一致,可能与发酵酒糟在瘤胃中更容易产生有机酸有关,与本试验中瘤胃发酵VFA 的结果相吻合,但本研究也发现当酒糟添加量为60%时,pH 显著升高,具体原因有待进一步探索。 氨态氮是瘤胃微生物利用饲料中的粗蛋白质合成的,也是合成MCP 的原料,其含量可反映瘤胃微生物分解饲料中的含氮物质产生NH3的速率及对NH3的利用情况(刘宗柱等,1998),研究表明, 瘤胃中NH3-N 的浓度正常范围为6.3 ~27.5mg/10 mL(Illius,1989),如果NH3-N 浓度过低, 无法为瘤胃微生物合成MCP 提供充足的氮源,从而影响宿主的生产性能,若NH3-N 浓度过高, 表明微生物利用NH3-N 合成MCP 的速率低于微生物降解饲料中CP 和内源氮生成NH3-N 的速率,从而造成氮的浪费。本研究结果显示各处理组NH3-N 浓度为11.09 ~ 12.78 mg/10 mL, 均在正常范围,略高于汪成等(2021)和曹广等(2020)在牦牛上的研究, 推测可能是本试验添加酒糟量与之相比较多,使饲料中CP 含量较高,经微生物分解后未能及时用于合成MCP 所致。但本研究也发现白酒糟组NH3-N 浓度高于发酵白酒糟组,而发酵白酒糟组MCP 高于白酒糟组,可能是由于发酵白酒糟相比干酒糟蛋白质组成较好且适口性较好,酒糟经发酵处理后蛋白质水平升高,利于微生物利用合成MCP。 同时在酒糟添加水平上发现,添加酒糟后NH3-N 浓度低于对照组,MCP 含量高于对照组,而曹广等(2020)研究结果显示在饲料中分别添加2.5%和5%发酵酒糟后,NH3-N 浓度和MCP 含量相比对照组无显著变化,本试验分别以20%、40%和60%的添加量饲喂,两者浓度差异较大,可能会引起不同的结果。 3.2 白酒糟和发酵白酒糟对西杂牛瘤胃微生物区系的影响 3.2.1 白酒糟和发酵白酒糟对西杂牛瘤胃微生物多样性的影响 测序深度和覆盖度是评估测序结果的两个方面,一般情况下两者呈正相关。本试验中,Miseq 测序显示28 个瘤胃液样本共获得1788887 条优化序列, 每个样本平均产生63889条, 序列平均长度为419.52 bp, 试验各组共有1142 个OTUs, 其中白酒糟各组共有1501 个OTUs,发酵白酒糟各组共有1447 个OTUs,测序覆盖率均在98.9%以上。Mao 等(2015)研究表明,覆盖率大于97%则说明测序样品充分,即本试验的测序结果能覆盖西杂牛瘤胃中大多数细菌群落,能真实地反映育肥西杂牛瘤胃中细菌的组成情况。白大洋(2019)试验研究结果显示,试验各组西杂牛共有1811 个OTUs, 本试验结果与其相比较高, 推测可能的原因与西杂牛年龄阶段及饲养环境的不同有关。 反刍动物瘤胃微生物多样性是微生物与动物本身共同进化的结果, 由于宿主本身的种类差异、 不同年龄和生理阶段其瘤胃微生物多 样 性 也 会 有 所 不 同 (Jami 等,2013;Yasuo,2006),同时反刍动物瘤胃微生物多样性也受日粮结构影响(马健等,2019)。本试验西杂牛采用拴系饲养,其日粮结构较为单一,可能会使得瘤胃微生物多样性较低。 在本试验中, 西杂牛瘤胃细菌多样性和物种群落丰度检测结果显示, 七个处理组瘤胃细菌多样性从高到低依次为: 试验6 组>试验7 组>试验3 组>对照组1>试验4 组>试验2 组>试验5 组,瘤胃细菌群落丰度从高到低依次为:对照组1>试验4 组>试验6 组>试验7 组>试验2 组>试验3组>试验5 组,各组间差异不显著。 说明本试验条件下添加白酒糟和发酵白酒糟对西杂牛瘤胃细菌多样性及物种群落丰度没有显著影响。 试验5 组瘤胃细菌多样性和群落丰度较低的原因可能是该组瘤胃液pH 较低抑制了某些微生物的生长繁殖, 同时在发酵白酒糟促进较为优势的瘤胃微生物生长繁殖的情况下, 会一定程度再次限制瘤胃中较低含量细菌的活动。 3.2.2 白酒糟和发酵白酒糟对西杂牛瘤胃微生物菌群结构的影响 研究表明, 西门塔尔牛(吴琼等,2019)和牦牛(曾钰等,2020)瘤胃微生物的优势菌门主要是拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),本试验研究结果与其相同,说明牛瘤胃优势菌门(Bacteroidetes 和Firmicutes)不受品种、年龄和日粮结构的影响。 本试验中,各个处理组丰度较高的门均为6 个, 分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、互养菌门(Spirochaetae)、变形菌门(Proteobacteria)、变形菌门(Actinobacteria)和纤维杆菌门(Fibrobacteres)。其中发酵白酒糟组放线菌门丰度显著低于白酒糟组,而放线菌大部分是腐生菌,推测可能是酒糟经发酵处理后有害菌减少, 饲用后可改善瘤胃菌群环境,抑制放线菌的生长。发酵酒糟组和白酒糟组与对照组相比在其他菌门均无显著差异, 这表明白酒糟与发酵白酒糟替代粗饲料对育肥牛瘤胃中优势菌群无不良影响, 为酒糟在肉牛饲料中新的应用方式提供了理论指导。 研究发现,核心菌群是反刍动物共有的,属水平上,普雷沃氏菌属是瘤胃中优势菌属,其优势地位与饲粮结构无关 (赵娜等,2019; 李岚捷等,2017;Jami 等,2012), 普雷沃氏菌属是主要的蛋白降解菌之一, 可降解瘤胃中蛋白质和淀粉等高分子物质(Avgustin 等,1997)。 本试验中,各组育肥瘤胃中优势菌属均为普雷沃氏菌属, 与前人研究结果(曾钰等,2020;赵娜等,2019;李岚捷等,2017;Jami 等,2012)一致;拟杆菌属BS11 随发酵白酒糟替代比例的增加,丰度显著降低,推测可能是随着替代比例的增加,饲粮中纤维含量降低,粗蛋白质和淀粉等营养物质含量升高, 普雷沃氏菌属处于优势地位,抑制了拟杆菌属BS11 的生长,导致丰度降低; 瘤胃球菌属是瘤胃中主要的纤维降解菌,能产生大量的纤维素酶、半纤维素酶和木聚糖酶,降解粗饲料中的纤维素和半纤维素。发酵白酒糟40%和60%组替代较对照组和20%替代组瘤胃球菌属2 丰度显著提高, 推测可能是白酒糟经发酵工艺处理后产生了可以促进瘤胃球菌生长、 增殖的物质。 各处理组Prevotella 1 和Prevotellaceae UCG-003 含量均没有显著的差异,但试验7 组Prevotella 1 含量比试验4 组提高,相比白酒糟, 饲粮中高用量发酵白酒糟提高了西杂牛瘤胃Prevotella 1 含量,可能是白酒糟的酸度和稻壳等因素一定程度上抑制了Prevotella 1 的生长繁殖活动。 Bacteroidales 主要降解饲粮中植物多糖,本试验中饲粮粗料中20%发酵白酒糟和60%白酒糟用量有利于Bacteroidales RF16 group 的生长繁殖活动, 但随着发酵白酒糟用量的提高其生长繁殖活动受到抑制, 而白酒糟用量的提高有利于Bacteroidales RF16 group 生长繁殖活动, 可能是Prevotella 和Bacteroidales RF16 group 对饲粮淀粉和蛋白质等营养成分的利用相似, 存在一定的竞争关系,当发酵白酒糟添加量较低时,同时促进了两者的生长繁殖活动,随着添加量升高,优势更大的Prevotella 1 利用资源大量繁殖,逐渐抑制Bacteroidales RF16 group 的生长繁殖活动; 而白酒糟用量较高时,可能因为酸度、稻壳等因素一定程度上不利于Prevotella 1 的生长繁殖活动,从而使Bacteroidales RF16 group 更能充分利用饲粮营养物质,具体原因还需进一步探索。 本试验中各处理组瘤胃发酵pH 均在正常范围内。 白酒糟和发酵白酒糟有利于瘤胃液NH3-N的转化和MCP 的合成,且发酵白酒糟效果优于白酒糟。 发酵白酒糟相比白酒糟更有利于改善西杂牛瘤胃发酵方式。 白酒糟和发酵白酒糟对西杂牛瘤胃细菌多样性和物种群落丰度没有影响, 对西杂牛瘤胃微生物门水平上的两种主要优势菌(拟杆菌门、厚壁菌门)丰度没有影响。 本研究中,60%发酵白酒糟替代组较其他组可产生更多的MCP,能提高饲料原料氮利用效率和瘤胃微生物Shannon 指数, 降低Simpson 指数,更有利于维持瘤胃微生物多样性。2 结果与讨论






3 讨论
4 结论
