一株强抗逆性猪源乳酸菌的筛选及生物学特性研究
2022-06-20毛宗林杨凤娟宋青龙
蔡 爽, 陈 涛, 毛宗林, 杨凤娟, 宋青龙
(1.国家饲料工程技术研究中心,北京100193;2.贵州大北农牧业科技有限公司,贵州贵阳550025)
仔猪养殖阶段的腹泻率与死亡率高是造成养殖业经济损失的重要因素之一, 尤其是仔猪断奶后极易引起动物消化道微生态紊乱, 感染病原微生物,造成仔猪腹泻、生长停滞甚至死亡(任曼等,2014)。抗生素在改善畜禽生长性能以及疾病防治方面具有重要作用, 在世界各国被广泛应用已有几十年的历史, 但长期在饲料中使用抗生素会造成畜禽肠道菌群紊乱, 会加剧耐药性细菌或超级耐药性细菌的产生和扩散, 导致严重的人和畜禽生物安全、 环境污染和食品安全等一系列的问题(Yi 等,2017;Falagas 等,2012;Cho 等,2012;Larsson 和Wolk,2010)。 因此,我国决定自2020 年7月全面禁止促生长类药物饲料添加剂在饲料中的使用,但这对畜牧业生产将是一个严峻的挑战。
乳酸菌是人及动物肠道中正常菌群的一部
分, 在调控畜禽肠道健康、 保持胃肠道微生态平衡、提高畜禽生长性能等方面发挥重要作用(Chiquette,2009;Timmerman 等,2006)。但天然乳酸菌的热稳定性较差,在饲料的加工过程中难以存活。并且天然乳酸菌不耐胃酸及胆盐, 进入动物胃部30 min 后存活率极低,最终顺利到达肠道的活菌数非常少, 难以定植在肠黏膜发挥作用(郭志杰等,2010;黄沧海等,2004),这些因素限制了乳酸菌在实际生产中的应用。 因此,筛选耐酸、耐高温且有益生特性的乳酸菌,对解决仔猪腹泻、饲料中抗生素用量大等问题具有重要意义。 本研究以健康无病仔猪宿主为筛选载体, 从健康仔猪粪便中初步分离出备选菌株, 并进行严格筛选和16S rRNA 进化分析。 通过抗逆性和益生特性选育,并系统地研究该菌株生长曲线和生理生化特性,为其发酵和应用提供重要理论依据。
1 材料与方法
1.1 试验材料 用以分离和筛选菌株的样品均来自健康无病仔猪的粪便。培养基包括MRS 肉汤培养基、麦康凯培养基、M17 培养基和糖醇发酵培养基。
1.2 菌株的分离与鉴定 称取1 g 健康仔猪的新鲜粪便,加入9 mL 生理盐水,室温下振荡混匀。 对混合液进行梯度稀释, 均匀涂布于含有10 mg/kg放线菌酮的MRS 琼脂培养基及M17 琼脂培养基平板上。 37 ℃恒温培养72 h 后,选取生长良好的特征单菌接入MRS 液体培养基,反复划线纯化至获得纯菌株。
16S rRNA 基因序列分析: 选用细菌基因组DNA 提取试剂盒(天根生化科技有限公司,北京,中国)进行细菌总DNA 的提取,并采用细菌通用引物进行16S rRNA 扩增。 扩增反应体系(50 μL)如表1 所示。

表1 PCR 扩增体系
扩增程序为:95 ℃5 min;94 ℃1 min;58 ℃1 min;72 ℃2 min,进行30 个循环,72 ℃10 min。之后进行1%琼脂糖凝胶电泳, 选取片段长度1500 bp 左右的阳性产物纯化后测序 (中美泰和生物技术(北京)有限公司),在NCBI 数据库中进行同源性比对, 并通过MEGA 4.0 与模式菌种进行亲缘关系研究,选取同源性大于99%为种的分界阈值。
1.3 革兰氏染色和接触酶试验 取少量MRS 肉汤培养物置于载玻片上,烘干固定后,依次用结晶紫染色液染色1 min, 革兰氏碘液染色1 min,丙酮乙醇混合液(丙酮:95%乙醇= 3:7)脱色30 s,沙黄染色液复染1 min, 然后在光学显微镜下观察。 选取具有革兰氏阳性形态的杆菌进一步进行接触酶试验,具体步骤为:取0.2 mL 培养物接入MRS 琼脂培养基斜面,在5% CO2、37 ℃条件下培养24 h 后,滴加3%过氧化氢溶液于菌落上,观察是否有气泡产生,若有则为革兰氏阳性菌,若无则为革兰氏阴性菌。
1.4 菌株生长曲线绘制 按1%(V/V) 将待测菌株接种于MRS 肉汤培养基,同时设置空白对照组(不加待测菌株)。将培养基置于37 ℃恒温培养箱中培养18 h,并每小时测定OD600值,进行菌株生长曲线的绘制。
1.5 菌株的抗逆性选育 耐热试验:将待测菌株按2%(V/V)接种到MRS 液体培养基中,分别在不同温度(60、70、80 ℃)下孵育10 min。 孵育结束后立即置于室温下冷却,进行活菌数的测定。
耐酸试验: 将待测菌株按2%(V/V) 接种到pH 3.0 的MRS 液体培养基中,在接种0、1、2 h 和3 h 后吸取菌液涂板。 将平皿置于37 ℃恒温培养24 h,进行菌落计数,并计算酸处理后的存活率。
耐胆盐试验:将0.3%(m/V)或1.0%(m/V)牛胆酸钠加入MRS 培养基并摇匀,制成不同胆盐浓度的MRS 固体培养基。将待测菌株倍比稀释后接入平皿,同时设置对照组(不含牛胆酸钠)。将平皿置于37 ℃恒温培养48 h,进行菌落计数,并计算胆盐处理后的存活率。
耐贮藏试验: 将pH 6.7 的MRS 培养基置于Hungates 滚管中, 制成厌氧无菌肉汤。 每管中加1 mL 待测菌株,于37 ℃恒温培养箱中进行培养。分别于0、24、72、104、128 h 和176 h 吸取菌液,梯度稀释后均匀涂布于MRS 培养基。将平皿置于37 ℃恒温培养24 h,进行菌落计数。
抗生素抗性试验:将金霉素、磺胺二甲嘧啶、泰乐菌素、速大肥、乙酰甲喹、阿散酸、杆菌肽锌、洛克沙砷、牛至油、喹乙醇、三甲氧苄氨嘧啶、抗敌素和吉他霉素13 种抗生素分别加入到灭菌的MRS 培养基中,将待测菌株按2%(V/V)接种到含不同抗生素的MRS 液体培养基中,37 ℃培养24 h,观察其菌落生长情况。
1.6 与致病菌混合培养试验 将待测菌株接入MRS 肉汤培养基,37 ℃培养24 h 后, 取5 mL 培养物(8.2×109cfu/mL)分别与5、10、15 mL 营养肉汤混合, 制成3 个含不同菌株培养物浓度的营养肉汤,分别接种伤寒沙门氏菌、金黄色葡萄球菌、大肠杆菌K88 和O157, 接种量为培养液的10%,于37 ℃、5% CO2培养箱培养24 h 后,观察结果。
1.7 抑菌试验 以嗜水气假单胞菌(CVCC519)、绿 脓 杆 菌 (CMCCB10102)、 大 肠 杆 菌(ATCC25922)、鸡白痢沙门(CVCC519)、枯草芽孢杆 菌 (CICC 20076)、 荧 光 假 单 胞 菌(CGMCC 1.1802)、李斯特杆菌(CVCCC53-5)、化脓链球菌(ATCC19615)、鼠伤寒沙门(CVCC2212)、巴氏杆菌(CVCC464)、金黄色葡萄球菌(CVCC1882)为指示菌,测定待测菌株的抗菌活性。 取无菌培养皿,用1.5%灭菌的琼脂铺底,然后将灭菌的牛津杯放置在凝固的琼脂上。 将指示菌接入LB 培养基,原菌液浓度为107cfu/mL,待测菌株菌液浓度为108cfu/mL,然后将LB 含指示菌一起倒到装有牛津杯的板上,待LB 凝固后用无菌镊子取出牛津杯,试验孔打入待测菌,然后将培养皿放在37 ℃恒温培养箱培养12 ~24 h,最后记录抑菌圈大小以检测待测菌株对各指示菌的抗菌活性。
2 结果与分析
2.1 菌株的分离与鉴定 试验以健康无病仔猪为宿主,对其粪便样品中的微生物进行分离纯化,并结合革兰氏染色和接触酶试验, 最终获得5 株乳酸菌, 分别命名为NFER-1、NFER-2、NFER-3、NFER-4 和NFER-5。 将5 株乳酸菌和4 株模式菌株的16S rRNA 基因序列通过MEGA 4.0 软件进行对比,并绘制系统进化树,以同源性大于99%为种的分界阈值,对其进行鉴定。 结果表明,NFER-1和 NFER -4 与Lactobacillus parabuchneriJCM12493 具有高度相似性, 归属为Lactobacillus parabuchneri;NFER -2 与Streptococcus thermophilus的同源性为99%, 与Streptococcus thermophilusATCC19258 也处于同一分支, 判定为Streptococcus thermophilus;NFER-3 与Lactobacillus plantarumNCDO1752 处于同一亚群,结合同源性结果,判定其为Lactobacillus plantarum;NFER-5 与Enterococcus faeciumLMG11423 处于同一分支,因此被判定为Enterococcus faecium(图1)。

图1 菌株的聚类分析图
2.2 菌株的抗逆性选育
2.2.1 耐热性能选育 通过将分离纯化出的5 株菌株分别在不同温度条件下(60、70、80 ℃)处理10 min, 检测菌株对高温环境的敏感性。 结果表明,经过60 ℃热处理10 min 后,5 株菌株都可以稳定的存在,但是NFER-3 的数量减少最多。 经过70 ℃热处理10 min 后,NFER-1 和NFER-3全部死亡, 表明这两株菌株耐热性能差;NFER-2、NFER-4 和NFER-5 都 还 存 在 活 菌, 其 中NFER-5 存活的活菌数最多。 经过80 ℃热处理10 min 后,NFER-1、NFER-2、NFER-3 和NFER-4 均死亡,仅有NFER-5 仍有较高活菌数(表2)。因此,通过对5 株菌进行耐热性能的选育后,最终选定NFER-2、NFER-4 和NFER-5 进行 后续的抗逆性筛选。

表2 不同温度条件下处理10 min菌株的存活情况cfu/mL
2.2.2 耐酸性能选育 通过将候选的NFER-2、NFER-4 和NFER-5 菌株在pH 3.0 的条件下分别处理1、2 h 和3 h,检测菌株对酸性环境的敏感性。 结果表明, 酸处理1 h 后,NFER-2、NFER-4和NFER-5 三株菌均能存活, 其中菌株NFER-5的存活数最多。 酸处理2 h 后,NFER-2、NFER-4和NFER-5 三株菌仍有少量存活。酸处理3 h 后,菌株NFER-2 全部死亡,菌株NFER-4 存活数极低, 表明NFER-2 和NFER-4 的耐酸能力较弱;但菌株NFER-5 表现出较强的酸耐受性,在酸处理3 h 后,存活率仍达到80%(表3)。 因此,通过对3 株菌进行耐酸性能的选育后, 最终选定NFER-5 进行后续的抗逆性筛选。

表3 pH 3.0 条件下菌株的存活率
2.2.3 耐胆盐性能选育 经过0.3%和1.0%胆盐浓度处理后,菌株NFER-5 的存活率见表4。结果表明,NFER-5 在胆盐浓度为0.3%和1.0%的条件下都表现出较强的耐受性, 存活率分别达到了109.95%和47.39%。

表4 不同胆盐浓度条件下NFER-5 菌株的存活率
2.2.4 耐贮藏性能选育 NFER-5 在不同贮藏时间的活菌数及存活率见表5。 结果表明,NFER-5在37 ℃恒温培养的环境下稳定性较好,培养72 h后菌株的存活率仍高达75%, 培养176 h 后,NFER-5 仍保持较高的活菌数, 存活率仍有28.33%,数量为6.8×109cfu/mL。这一结果说明,菌株NFER-5 具有较好的稳定性。

表5 NFER-5 菌株在不同贮藏时间的活菌数及存活率
2.2.5 抗生素抗性选育 NFER-5 菌株对多种抗生素抗性结果如表6。 结果表明,NFER-5 在含有喹乙醇、牛至油、洛克沙砷、杆菌肽锌、阿散酸、金霉素和抗敌素的培养基中可以生长正常, 表明NFER-5 对这些抗生素具有抗性; 然而,NFER-5在含有乙酰甲喹、速大肥、泰乐菌素、磺胺二甲嘧啶、 三甲氧苄氨嘧啶和吉他霉素的培养基中不生长,表明NFER-5 对这些抗生素敏感。

表6 NFER-5 菌株对各种抗生素的抗性测定
2.3 屎肠球菌NFER-5 的益生特性选育
2.3.1 屎肠球菌NFER-5 与致病菌混合培养试验将屎肠球菌NFER-5 与各致病菌混合培养,检测菌株对致病菌的抑制效果。结果如表7 所示,在不同浓度下,屎肠球菌NFER-5 能够在自身生长不受影响的情况下, 使培养基中伤寒沙门氏菌的活菌数由108减少至102,表明其对伤寒沙门氏菌有较好的抑制效果。 在不同浓度下, 屎肠球菌NFER-5 对大肠杆菌K88 和O157 也有一定的抑制作用, 能够使培养基中大肠杆菌K88 和O157的活菌数由108减少至105,且屎肠球菌NFER-5自身生长不受影响。 但是,试验结果表明,屎肠球菌NFER-5 对金黄色葡萄球菌没有抑制效果,不同浓度的屎肠球菌NFER-5 均没有影响金黄色葡萄球菌的生长。
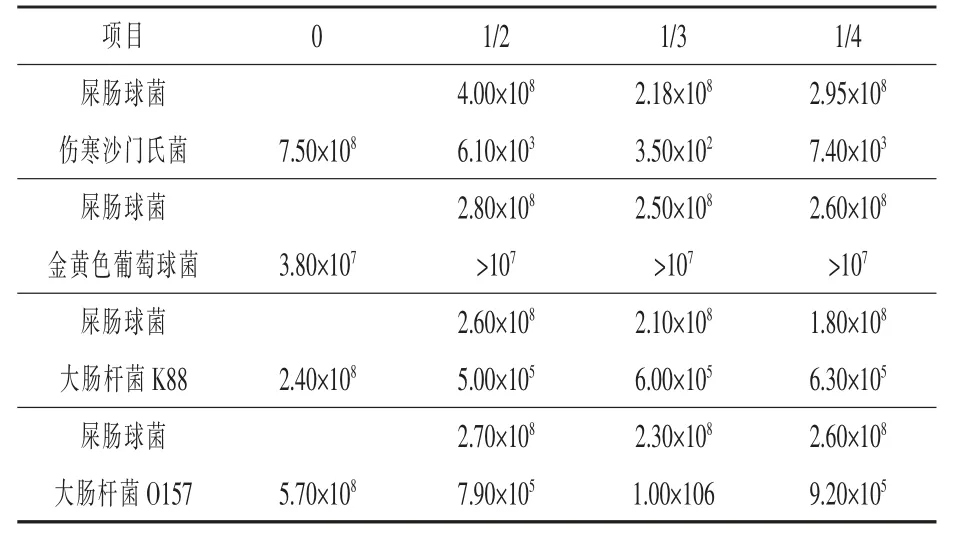
表7 屎肠球菌NFER-5 与致病菌混合培养后的生长情况cfu/mL
2.3.2 屎肠球菌NFER-5 的抑菌特性 通过牛津杯试验, 检测屎肠球菌NFER-5 对大肠杆菌、鸡白痢沙门等多种病原菌的抑菌效果。 试验结果表明,屎肠球菌NFER-5 对巴氏杆菌(CVCC464)、鼠伤寒沙门(CVCC2212)、鸡白痢沙门(CVCC519)、大 肠 杆 菌 (ATCC25922) 和 绿 脓 杆 菌(CMCCB10102)都有较强的抑菌作用,能观察到明显的抑菌圈。 其中抑菌效果最为明显的是鸡白痢沙门(CVCC519),抑菌圈直径达到20.43 mm(表8)。
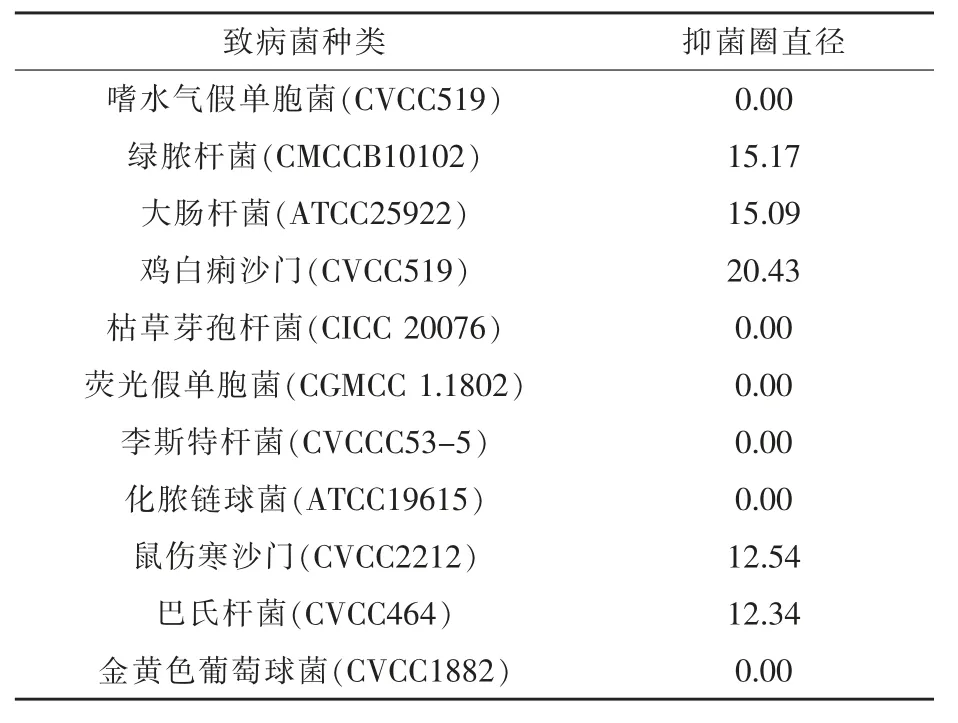
表8 屎肠球菌NFER-5 发酵液上清对指示菌抑菌直径测定mm
2.4 屎肠球菌NFER-5 的生长曲线 在培养过程中,每小时检测菌液OD600值,绘制NFER-5 的生长曲线。 如图2 所示, 在培养2 h 后,NFER-5进入对数生长期; 培养10 h 后,NFER-5 进入稳定期。 因此,该菌株的最佳收获期为培养后10 ~18 h。

图2 NFER-5 的生长曲线
2.5 屎肠球菌NFER-5 的生理生化特性NFER-5 的生理生化特性如表9。 结果表明,NFER-5 发酵葡萄糖、果糖、乳糖、麦芽糖、蔗糖、甘露醇、水杨苷、阿拉伯糖、海藻糖、纤维二糖、淀粉、 龙胆二糖等多种糖类产酸不产气, 判定NFER-5 为肠球菌属(Enterococcus)。

表9 NFER-5 的生理生化特性
3 讨论
屎肠球菌广泛存在于自然界,属于兼性厌氧的乳酸菌, 以活菌的形式广泛应用于动物饲料产品中。 屎肠球菌会产生过氧化氢、有机酸和细菌素等代谢产物。这些代谢产物一方面可以直接影响宿主的代谢,提高机体的免疫力,改善畜产品品质;另一方面, 也可以通过调控宿主的肠道微生物区系,有效抑制腐败菌和病原菌的生长, 促进有益菌的繁殖,间接影响宿主的健康(沈中艳等,2007)。
益生菌活菌都有适宜自身生长的特殊生长环境,恶劣的环境会使其生长缓慢、停滞,甚至死亡。在饲料生产过程中,调质、制粒的温度和压力是制约微生态制剂中活菌数量的关键因素之一, 也是活菌制剂质量的关键步骤。此外,活菌被动物采食后,还要经受动物消化道中消化液的考验。 因此,本研究在筛选过程中同时兼顾了胃酸和胆盐两个影响因素,结合温度耐受性试验和耐贮藏性能,使筛选出的目标菌株不仅能耐受饲料加工过程中的恶劣环境, 对胃酸和胆盐等消化道环境具有较高的耐受性,而且能够较长时间贮藏。一般仔猪饲料的制粒温度为70 ~85 ℃, 本研究筛选出的屎肠球菌NFER-5 在80 ℃处理10 min 后, 仍有较高的存活率,表明其具有良好的耐热性,在饲料加工过程中的损失少。同时,屎肠球菌NFER-5 在pH 3.0 和胆盐浓度0.3%或1.0%的环境下均能够稳定存活, 确保了该菌株进入动物消化道后能经受酸性环境和胆盐的刺激, 能够成功达到肠道发挥其益生功能。
大肠杆菌、 伤寒沙门氏菌和金黄色葡萄球菌是极为常见的条件性致病菌, 也是引起断奶仔猪死亡的重要原因 (Mirhoseini 等,2018;Fairbrother和Nadeau,2005;Kaper,2005)。 研究证实,产肠毒素大肠杆菌在侵入宿主后, 可以通过自身表达产生的黏附素黏附到特定的小肠上皮细胞刷状缘受体上,之后开始快速定植、生长和繁殖,并分泌肠毒素,释放脂多糖,从而引发腹泻、肠道微生物紊乱、肠炎和肠道屏障损伤。 据报道,猪源常见的产肠毒素大肠杆菌菌毛基因型是K88(F4)、K99(F5) 和987P (F6)(Zhang 等,2017; 黄沧海等,2005)。 目前普遍认为,益生菌改善动物健康的主要方式是竞争性黏附及分泌杀菌物质调节宿主微生物区系, 或通过表面大分子与宿主肠道黏膜中识别受体互作,传递信号,从而调节肠道内环境、宿主免疫、 物质代谢及生长性能 (黄沧海等,2005)。 益生屎肠球菌调控宿主健康的方式主要有:(1)通过影响胆汁酸代谢,降低血清胆固醇水平;或通过产生短链脂肪酸及维生素,增强宿主的能量代谢率。(2)以竞争性黏附或分泌抑菌物质的途径,干扰肠道中病原微生物的繁殖,改善肠道菌群的微生态平衡。(3)刺激先天性免疫细胞和T、B淋巴细胞, 调控宿主的免疫功能 (Leblanc 等,2017;Ridlon 等,2016;Lebeer 等,2010)。本研究通过将筛选出的屎肠球菌NFER-5 与大肠杆菌、伤寒沙门氏菌和金黄色葡萄球菌等致病菌混合培养,探究了屎肠球菌NFER-5 对大肠杆菌、鸡白痢沙门等病原菌的抑菌效果, 证实了候选菌株对致病性大肠杆菌K88 和O157 以及伤寒沙门氏菌均有较好的抑制效果, 并且能够显著抑制大肠杆菌(ATCC25922)、鸡白痢沙门(CVCC519)、鼠伤寒沙门(CVCC2212)、巴氏杆菌(CVCC464)和绿脓杆菌(CMCCB10102)的生长。 这一结果与目前大多数关于屎肠球菌的研究结果一致。 屎肠球菌的代谢产物细菌素对志贺氏菌、沙门氏菌、梭状芽孢杆菌和葡萄球菌都具有较好的抑制作用, 而且屎肠球菌代谢产生的乳酸可以显著降低动物的肠道酸度, 从而抑制病原菌在肠道的生长(Connell,2007)。针对健康仔猪和腹泻仔猪的肠道菌群进行对比研究发现,与健康仔猪相比,腹泻仔猪肠道中大肠杆菌数量显著增加, 而乳酸杆菌的数量显著降低(黄沧海等,2003)。 日粮中添加屎肠球菌,断奶仔猪的生长性能得到显著提升, 仔猪的特异性免疫和非特异免疫功能均得到一定程度的改善,且调控了仔猪肠道菌群结构(文静等,2011)。在用大肠杆菌、金黄的葡萄球菌、绿脓杆菌、鸡白痢沙门、 鼠伤寒沙门、 巴氏杆菌感染所作的试验模型中,都证明了屎肠球菌具有抗感染活性。补充屎肠球菌,可通过提高紧密连接蛋白Claudin-4 表达、调控炎症反应, 从而减轻产肠毒素大肠杆菌对猪肠道的侵袭(Kern 等,2017);提高仔猪肠道绒毛高度及绒毛高度和隐窝深度比, 增加肠上皮内淋巴细胞的数量(Rieger 等,2015)。这些结果都证实了屎肠球菌具有良好的益生性能, 具有较大的发展空间和应用价值。
4 结论
通过本试验的抗逆性选育,确定NFER-5 在耐高温、耐胆盐、耐酸、耐贮藏等方面具有较大优势,是一株可用于微生态制剂的优势菌种,并鉴定为屎肠球菌。 本试验筛选出的屎肠球菌对大肠杆菌(ATCC25922)、绿脓杆菌(CMCCB10102)、鸡白痢沙门(CVCC519)、鼠伤寒沙门(CVCC2212)和巴氏杆菌(CVCC464)有较强的抑制作用,是一株优良的微生态制剂用菌株。
