膈肌电活动监测在神经重症患者呼吸机撤机中的应用价值*
2022-06-20伍年龙姜梦珂窦云有
汤 云,王 奎,于 涛,张 卫, 伍年龙, 姜梦珂, 窦云有
(皖南医学院第一附属医院弋矶山医院神经外科ICU,安徽芜湖 241000)
神经重症患者由于原发呼吸中枢严重受损导致中枢性呼吸衰竭,常需要机械通气作为重要的生命支持手段。研究表明神经危重患者撤机失败率高达20 %~40 %[1],而撤机失败又延长了患者的机械通气时间而导致出现呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)、呼吸机相关性肺损伤(ventilator associated lung injury,VILI)及呼吸机相关性膈肌功能障碍(ventilator-induced diaphragm dysfunction,VIDD)等并发症[2-4],同时也增加了患者的ICU住院时间及住院病死率[5]。因此,选择一种安全可靠的撤机指标对于提升撤机成功率有着重要的临床意义。撤机成功的关键在于呼吸肌收缩功能与呼吸负荷之间的平衡,其中,膈肌是人体最主要的呼吸肌并承担着主要的呼吸力量。床旁超声评估膈肌功能指导撤机的研究较多且敏感性和特异性较佳,但是对于临床医生的技术要求较高且测量时容易受到性别、年龄、体位、声窗质量等多种因素的干扰。膈肌电活动(EAdi)是呼吸中枢动作电位经膈神经传导至膈肌时膈肌纤维所产生的动作电位总和,它直接客观反映了呼吸中枢对膈肌的驱动强度。因此,本研究就EAdi监测应用于神经危重患者的撤机进行分析总结,以寻求一种新的撤机参考指标。
1 对象与方法
1.1对象 选取2019年3月—2021年7月入住皖南医学院第一附属医院神经外科ICU行机械通气时间大于24h并且由临床医生判断符合SBT试验标准的患者。根据撤机结果分为撤机成功组和撤机失败组。本研究获本院医学伦理委员会审批(审批号:2019-51),所有机械通气治疗患者均签署知情同意书。
纳入标准: (1)年龄18~84周岁;(2)机械通气时间≥24 h;(3)符合SBT试验标准[6]:导致呼吸衰竭的原发中枢性疾病得到有效控制或稳定;体温≤38 ℃,且>35 ℃;血流动力学稳定(心率≤140次/min,动脉血压稳定,未用血管活性药物或仅用小剂量血管活性药物);血红蛋白浓度≥70 g/dL;有自主呼吸能力;代谢状态稳定;无明显呼吸性酸中毒;氧合状况良好[氧合指数(PaO2/FiO2)≥150~200 mmHg(1 mmHg=0.133 kPa),呼气末正压(PEEP)≤5~8 cmH2O(1 cmH2O=0.098 kPa)],吸入氧浓度(FiO2)≤0.4。
排除标准 : (1)不宜放置EAdi导管的患者如严重食管静脉曲张、出血,食管梗阻、穿孔,膈疝,胸廓畸形等;(2)严重的中枢性呼吸抑制、高位截瘫、重症肌无力;(3)严重膈神经传导障碍及各种原因导致的膈肌麻痹;(4)既往存在支气管哮喘、慢性阻塞性肺部疾病及严重肺部感染等基础疾病;(5)肋骨骨折、血气胸、肺挫裂伤。
1.2方法
1.2.1正确放置EAdi导管 先计算出经鼻尖至耳垂再至剑突的距离之和(NEX),再根据相应的导管型号(成人,16 Fr,长125 cm,瑞典Maquet Critical Care公司)和计算公式Y=0.9×NEX+18,正确估算需置入的导管深度并给予经鼻置入EDi导管。然后根据呼吸机屏幕显示的4道心电图波形进行调整,直至满足EAdi标记信号(蓝色膈肌电信号)出现在第二、三道波形中且信号稳定时说明导管位置正确。如图1。

图1 EAdi导管正确位置判断
1.2.2撤机方法 所有符合SBT试验标准的患者均采用低水平PSV法进行SBT 30 min。呼吸机压力支持水平(PS)设置为5~8 cmH2O,PEEP≤5 cmH2O,吸入氧浓度(FiO2)≤40 %。SBT通过后立即给予撤机并随访观察48 h。如果患者SBT失败则立即停止并恢复原先的通气模式及参数。SBT失败标准[9]为:(1)患者出现明显的精神状态恶化(嗜睡、昏迷、躁动、焦虑);(2)明显大汗;(3)主观感觉不适;(4)明显呼吸做功费力、辅助呼吸肌肉参与呼吸、胸腹矛盾呼吸运动;(5)当吸入FiO2≥50 %的情况下,动脉血气中的动脉血氧分压(PaO2)≤50~60 mmHg或者血氧饱和度(SpO2)<90 %;(6)动脉二氧化碳分压(PaCO2)>50 mmHg或者增加>8 mmHg;(7)pH<7.32或降低幅度>0.07;(8)浅快呼吸指数( rapid shallow breathing index ,RSBI)≥105次/min/L;(9)呼吸频率(f)>35次/min或增加幅度>50 %;(10)心率(HR)>140次/min或增加幅度大于20 %;(11)收缩压>180 mmHg或增加幅度大于20 %;(12)收缩压<90 mmHg;(13)出现心律失常。
1.2.3撤机分组的标准 撤机成功组标准:顺利通过SBT试验,并且撤机48h内病情稳定无需再次使用呼吸机。撤机失败组标准:①SBT试验失败;②SBT通过后撤机48h内需再次给予呼吸机辅助通气;③撤机48h内病情恶化或死亡。若出现以上任一条均定义为撤机失败。
1.2.4观察指标 (1)记录患者的一般资料包括性别、年龄、诊断、急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation,APACHEⅡ)、入院GCS评分、撤机前机械通气日(d);(2)记录SBT开始前的生命体征、动脉血气及机械通气参数;(3)记录SBT结束时的生命体征、动脉血气、机械通气参数及膈肌功能指标主要包括膈肌电活动峰值(EAdimax)、膈肌电活动低值(EAdimin)、神经通气耦联指数(NVE)、神经机械耦联指数(NME);(4)观察两组患者临床预后指标主要包括NSICU住院时间、总住院时间、28 d病死率。

2 结果
2.1一般资料 本研究共纳入52例患者,其中撤机成功组38例(73.1 %),撤机失败组14例(26.9 %)。两组患者在性别、年龄、诊断、APACHEⅡ评分、入院GCS评分、撤机前机械通气日、SBT开始前的生命体征、动脉血气分析、机械通气参数方面差异均无统计学决意义(P>0.05)。见表1。

表1 两组患者一般资料及SBT开始前机械通气参数比较
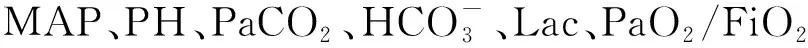

表2 SBT结束时两组患者生命体征及动脉血气对比[M(QL~QU)]
2.3SBT结束时两组患者机械通气参数及膈肌功能指标 两组患者在气道峰压(Ppeak)、平均气道压(Pmean)、分钟通气量(MV)及呼出潮气量(VTE)等机械通气参数监测上均差异无统计学意义(P>0.05)。成功组的膈肌功能指标NVE、NME、NVE×NME均显著高于失败组,差异均有统计学意义(P<0.05)。但EAdimax、EAdimin两组均差异无统计学意义(P>0.05)。见表3。

表3 SBT结束时机械通气参数比较[M(QL~QU)]
2.4NVE、NME、NVE×NME对撤机成功的预测价值 当NVE的最佳临界值为59.15 mL/μV时,预测撤机成功的敏感度为100 %,特异度为42.9 %,ROC曲线下面积(AUC)为0.727;当NME的最佳临界值为1.83 cmH2O/μV时,预测撤机成功的敏感度为86.80 %,特异度为50 %,ROC曲线下面积(AUC)为0.736;当NVE×NME的最佳临界值为76.4 mL×cmH2O/μV2时,预测撤机成功的敏感度为100 %,特异度为42.9 %,ROC曲线下面积(AUC)为0.757。见表4、图2。

图2 膈肌功能指标NVE、NME、NVE×NME预测神经危重患者撤机成功的ROC曲线

表4 SBT结束时膈肌功能指标预测撤机成功的价值
3 讨论
神经重症患者常由于脑出血、颅脑损伤、脑肿瘤等严重病变导致呼吸中枢驱动能力减弱而出现中枢性呼吸衰竭。机械通气正是维持该类患者有效气体交换并纠正原发中枢性呼吸衰竭的重要支持手段。但是,当原发疾病得到有效控制后应及早撤除呼吸机,尽量避免出现因长时间机械通气给患者所带来的一系列并发症。影响神经重症患者撤机成功与否是多因素的,并且充满一定的复杂性和挑战性。本研究显示神经重症患者撤机失败率高达26.9 %,与既往的研究基本一致[7]。由于膈肌作为最主要的呼吸肌承担了人体70 %的呼吸肌力量,因此本研究通过量化评估危重患者的膈肌通气效能和收缩效能对于评估神经危重患者的撤机具有潜在的指导意义。
本研究发现两组患者在SBT结束时,撤机失败组患者的心率和呼吸频率较成功组更快,这说明在同样的呼吸负荷下撤机失败组患者更容易出现呼吸肌疲劳并且代偿能力更差,这与冯辉等[8]的研究基本相似。因此,对于此类患者应在原发神经中枢疾病稳定后应尽早启动康复训练尤其是呼吸肌(主要是膈肌)的训练,通过避免呼吸肌的萎缩和提高其耐力以便为尽早成功撤机提供基础。最近的研究[9]发现SBT结束时撤机失败组的PaCO2往往较成功组更高;然而,本研究却发现撤机失败的患者较成功组患者在SBT结束时PaCO2反而是更低。这可能是主要因为在SBT期间撤机失败组患者呼吸频率较成功组患者明显增快,进而肺泡分钟通气量(MV)增加引起肺过度通气有关,本研究中也发现SBT结束时失败组的MV为8.85 L/min略高于成功组的8.45 L/min。同时SBT仍属于低水平的呼吸支持并且持续时间仅为30min较短,虽然患者呼吸肌做功有所增加,但仍能代偿维持基本正常的呼吸功能,呼吸肌未达到完全衰竭的状态。此外,本研究主要是原发神经中枢系统疾病患者,其本身不存在原发急慢性呼吸系统疾病,因此在SBT结束时撤机失败组的PaCO2水平低于成功组。这也就提示在对此类患者行SBT时应做好PaCO2监测,避免因PaCO2过低引起脑血管收缩进而加重脑缺血缺氧。
研究表明神经重症监护病房约有50 %的患者需要进行机械通气[10],而在机械通气患者中出现明显膈肌功能障碍的患者比例更是高达60 %~80 %[11]。另外,Hudson等[12]研究表明机械通气12~18h即可出现膈肌功能障碍或萎缩。因此,呼吸机相关性膈肌功能障碍是导致神经重症机械通气患者撤机失败的主要因素之一。然而,目前用于评价膈肌功能预测撤机的指标非常有限。Barwing等[13]一项EAdi在困难撤机患者中应用的研究发现采用T型管脱机行SBT 5 min时撤机失败组明显高于撤机成功组,且较其他撤机指标更为敏感。本研究中也发现撤机失败组的EAdimax、EAdimin趋向高于撤机成功组,但是差异不具有统计学意义,这可能是由于样本量较少和本研究采用SBT方法不同导致。本研究结果显示NVE、NME、NVE×NME对神经危重患者撤机均具有一定的指导意义。NVE表示单位EAdi所能产生的VT,可用来反应膈肌的通气效能;NME表示单位EAdi所产生胸腔压力的变化,可用来反应膈肌的收缩效能;NVE×NME既反映了膈肌的通气效能又反应了收缩效能。在本研究中显示SBT结束时撤机成功组的NVE、NME、NVE×NME均明显高于失败组。并且当NVE>59.15 mL/μV时,预测撤机成功的敏感度为100 %,ROC曲线下面积(AUC)为0.727;当NME超过1.83 cmH2O/μV时,预测撤机成功的敏感度为86.80 %,ROC曲线下面积(AUC)为0.736,这与既往的研究[14-15]基本一致。当NVE×NME>76.4 mL×cmH2O/μV2时,预测撤机成功的ROC曲线下面积(AUC)为0.757较单一指标评价略高。但三者特异度较为一般,分别为42.9 %、50 %及42.9 %。这说明影响神经重症患者能否撤机成功的因素除了膈肌功能之外,还可能受到其他多种因素的影响,如感染、心功能受损、严重的呼吸系统病变、神经传导障碍等。Blanch等[16]也证实了当原发神经中枢受损后,患者往往容易出现脑-肺之间的交互作用,进而引起全身炎症反应、神经病变、免疫抑制和自主系统功能障碍等,最终导致包括呼吸系统、心脏、肾脏、淋巴及肝脏的受损,致使患者的撤机过程变得更为复杂。因此,对于此类患者在撤机过程中除了注重膈肌功能的评估,还应注意其他组织器官的功能评价,将撤机前后的管理做到更加精细化以提高撤机成功率。
本研究也存在一定的局限性,首先这是一个单中心的研究且样本量不大,可在今后的研究中进一步扩大以提升研究的精确性;其次,本研究仅探索了EAdi评价膈肌功能对撤机的指导价值,没有联合其他撤机指标进行分析,可在今后的研究中进一步分析研究。
总之,影响神经重症患者撤机的因素较为复杂,通过膈肌电活动监测技术量化评价患者膈肌功能指标对指导临床撤机具有一定的指导意义,同时未来也可能作为一种新的膈肌功能监测手段进行推广和应用。
