土霉素菌渣降解菌的筛选及应用条件优化
2022-06-18康润泽钱斯日古楞倪巍洪杜欣欣于耀东王红英
康润泽,钱斯日古楞,倪巍洪,杜欣欣,于耀东,王红英
(大连工业大学 生物工程学院,大连 116034)
土霉素菌渣是龟裂链霉菌(Streptomycesrimosus)发酵生产土霉素过程中产生的酸性固态废弃物,是在土霉素提取过程中,加入草酸等试剂酸化过滤后产生的[1],因此呈酸性,主要含有土霉素生产发酵培养基成分、生产用菌体和产品分离、提纯所用的试剂以及残留的土霉素等[2]。2008年抗生素菌渣列入《国家危险废物名录》,禁止用作饲料或饲料添加剂[3]。土霉素菌渣含水量高、热值低,在烘干和焚烧过程中需要大量的外部热量和燃料,因此其处置成本较高[4-6]。我国虽没有明文规定抗生素菌渣不能作为肥料使用,但其存在菌渣处理不完全、制备的有机肥可能含有的抗生素残留或代谢中间产物,在生物体内累积,产生抗药性等潜在的生态风险[7-9]。如何在环境友好、安全的前提下,合理有效地利用菌渣是目前亟待解决的重要课题[10-11]。
本研究通过筛选能够耐受土霉素菌渣并能产生蛋白质酶的菌株,旨在利用该菌株对土霉素菌渣进行发酵处理,充分利用菌渣成分,获得可再利用的发酵液,作为培养基成分重新利用于土霉素生产中,在节省资源的同时,达到菌渣的无害化处理目的。
1 材料与方法
1.1 材料
1.1.1 样品
土霉素菌渣和土霉素菌渣堆肥,均由内蒙古华曙生物科技有限公司提供。
1.1.2 试剂与仪器
土霉素标准品(HPLC≥95%),北京索莱宝科技有限公司销售;蔗糖、赖氨酸、Folin-酚试剂、茚三酮、重铬酸钾等试剂均为国产分析纯。TU-1901紫外分光光度计,北京谱析通用仪器公司;TGL-16K高速冷冻离心机,湘仪离心机仪器有限公司;霉菌培养箱MJ-16085-III,上海新苗医疗器械制造有限公司;ZHWY2102C立式双层恒温摇床,上海智城分析仪器制造有限公司。
1.2 方法
1.2.1 培养基的配制
5%菌渣培养基:称取干燥的400目土霉素菌渣粉末5 g加到100 mL自来水中混匀,pH值自然,用高压灭菌锅灭菌121 ℃,20 min,备用。配制5%的菌渣固体培养基需要加入5 g琼脂以确保凝固性。
10%菌渣培养基:称取干燥的400目土霉素菌渣粉末10 g加到100 mL自来水中混匀,pH值自然,用高压灭菌锅灭菌121 ℃,20 min,备用。
察氏液体培养基:硝酸钠3 g、磷酸氢二钾1 g、七水硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、蔗糖30 g、水1 000 mL。121 ℃,20 min灭菌备用。固体察氏培养基添加2%的琼脂。
1.2.2 菌株的筛选
用无菌水浸泡土霉素菌渣堆肥样品,得到的浸出液在察氏培养基平板上进行涂布,30 ℃下培养,获得菌落。
将察氏培养基上生长出的不同单菌落,分别在5%菌渣固体培养基上划线接种,在30 ℃条件下培养,分别获得M-1、M-2的单一菌落。
1.2.3 筛选菌株的生长曲线
制备孢子悬液:分别选择在察氏培养基上长势良好且孢子旺盛的M-1、M-2菌株,分别刮取孢子,用无菌水制成2.0×106个/mL的M-1和M-2的孢子悬液。
在装有100 mL察氏培养基的250 mL锥形瓶中,分别接入1 mL的M-1、M-2孢子悬液。每种菌做3组平行,每组13瓶。30 ℃、160 r/min摇床上培养。每隔12 h取出6瓶,5 000 r/min离心10 min,称量菌丝湿重,绘制生长曲线。
1.2.4 筛选菌株的酸、碱耐受性
分别配制pH值为2、3、4.5、6.5、7、8的100 mL/250 mL察氏培养基。分别接入1 mL的M-1、M-2的孢子悬液,每个梯度平行做3组,在30 ℃,160 r/min条件下培养6 d。5 000 r/min离心10 min,称量菌丝湿重,考察菌株的土霉素耐受性。
1.2.5 筛选菌株的土霉素耐受性
配制含有土霉素0、200、600、1 000、1 400和1 800 u/mL,pH 3的察氏液体培养基各100 mL,分别加入250 mL锥形瓶中。吸取1 mL的M-1、M-2的孢子悬液接入不同土霉素含量的察氏液体培养基中,在30 ℃,160 r/min条件下培养6 d。用5 000 r/min离心10 min,获得湿菌丝,称重,分析并比较土霉素对菌体生长的影响,考察其土霉素耐受性。
1.2.6 菌株产蛋白酶条件的优化
(1)菌株产蛋白酶活力的测定。以酪氨酸为标准物,Folin-酚试剂为显色剂,在660 nm处测定吸光值,绘制酪氨酸标准曲线,其回归方程式为y=127.22x-1.948 8,R2=0.997 4。
取一支试管,加入1 mL酪蛋白溶液(2%,pH 6.5磷酸盐缓冲液配制),置入40 ℃水浴中预热5 min,再加入1 mL 40 ℃预热5 min的样品溶液,混匀后在40 ℃水浴中保温10 min。立刻加入2 mL 0.4 mol/L三氯乙酸,摇匀,保温20 min。离心,吸取上清液1 mL,加入5 mL的0.5 mol/L碳酸钠溶液,最后加入1 mL Folin-酚试剂,于40 ℃水浴中显色20 min。在660 nm波长下测吸光度。
酶活定义为在40 ℃,pH 6.5条件下,每分钟水解酪蛋白产生1 mg酪氨酸所需的酶量为1个酶活力单位(u)。
(2)菌株产蛋白酶条件的优化。为了优化产酶条件,以蛋白酶活力为依据,在察氏培养基中,对培养温度、pH值和培养时间进行研究。在菌渣培养基中,对菌渣添加量、接种量和装液量等因素进行研究。
1.2.7 筛选菌株对土霉素菌渣的转化
(1)菌渣整体质量的变化。在含有100 mL 5%菌渣液体培养基的250 mL锥形瓶中,分别加入8 mL的M-1、M-2的孢子悬液和无菌水,平行3组。在30 ℃、160 r/min条件下培养7 d。取出后在5 000 r/min条件下离心10 min,收集沉淀物。沉淀物在105 ℃条件下烘干至恒重,冷却后精确称量其重量。
(2)菌渣蛋白质含量的变化。培养方法同上。取出后在5 000 r/min条件下离心10 min,收集沉淀物。沉淀物在105 ℃条件下烘干至恒重,用凯式定氮法测定其蛋白含量。
(3)菌渣的游离氨基酸变化影响。培养方法同上。取出后在5 000 r/min条件下离心10 min,收集上清液,定容至一定体积,并测定其游离氨基酸含量。游离氨基酸的测定,以赖氨酸标准物,茚三酮为显色剂,在565 nm波长处测吸光值,得到回归方程式为y=304.74x+7.299 1,R2=0.999 1。
2 结果与分析
2.1 菌株的筛选
分离纯化获得两种霉菌,分别命名为M-1和M-2,菌落形态如下图。经初步鉴定M-1为米曲霉、M-2为绿色木霉。
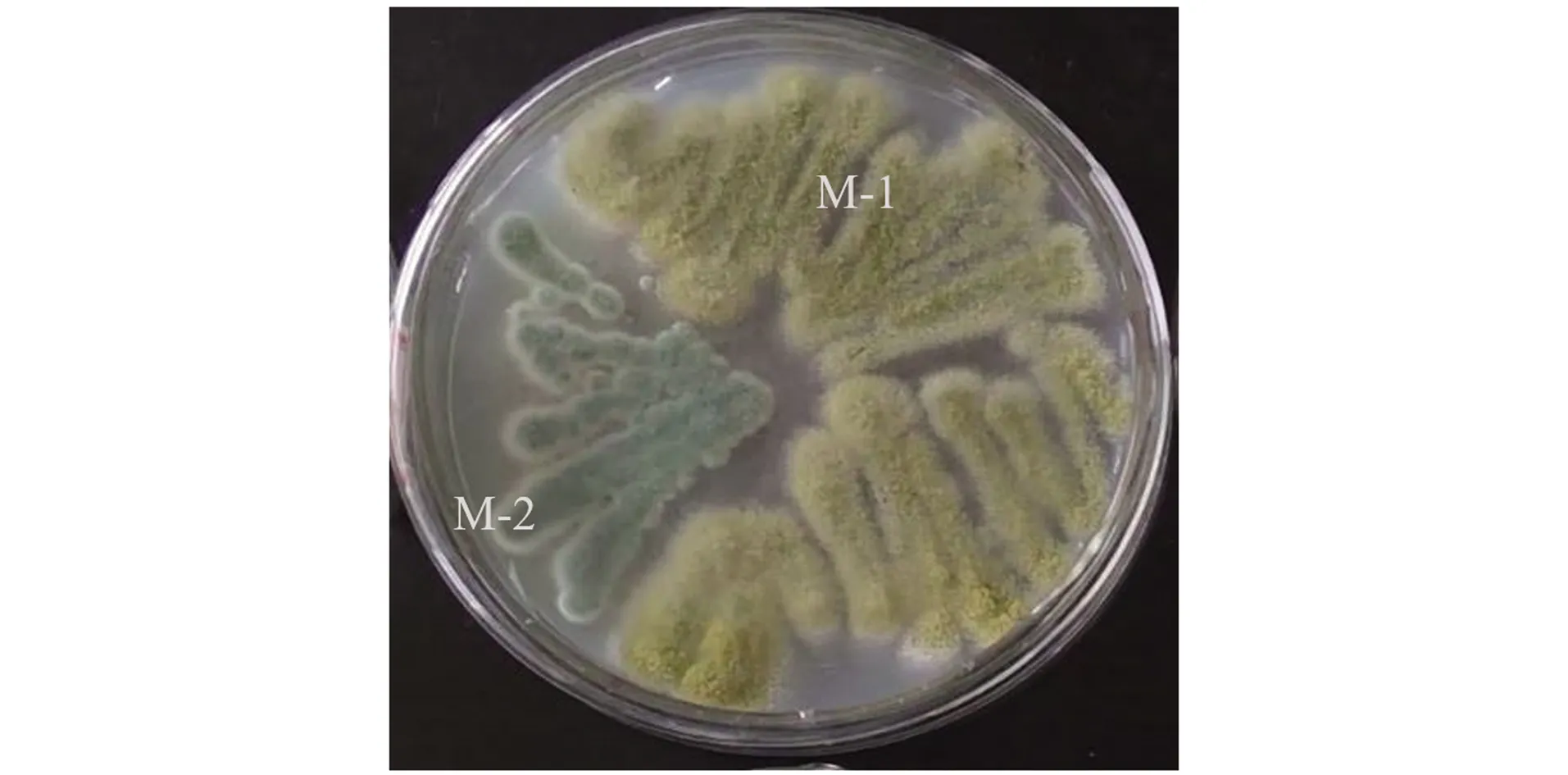
图1 筛选菌株菌落形态
2.2 筛选菌株的生长曲线
将筛选菌株接种到液体察氏培养基中,培养一定时间后分别取样测定菌丝湿重,以菌丝湿重值为纵坐标,培养时间为横坐标,绘制生长曲线。由图2可见,培养开始24 h后,两种菌株的菌丝重量均急剧上升,此时菌种进入快速增长期。在72 h时,菌株M-1到达增长高点,随后菌丝湿重无明显变化,进入缓慢衰亡期;而菌株M-2在108 h时菌丝湿重达增长高点,随后进入衰亡期。
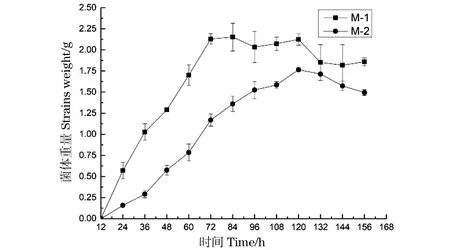
图2 筛选菌株生长曲线
2.3 筛选菌株的酸、碱耐受性
由图3可知,M-1和M-2分别在pH 3和pH 6.5表现出最佳的生长量,均呈现出良好的耐酸性。M-1耐酸性好于M-2。两种菌对碱性环境耐受性较差。

图3 pH值对菌体生长的影响
土霉素菌渣的pH在3.35到3.77之间呈酸性。两种霉菌都可以在样品的pH范围内生长,满足了处理土霉素菌渣的必要条件。
2.4 筛选菌株的土霉素耐受性
从图4可知,M-1土霉素耐受性好于M-2。土霉素浓度低于1 800 u/mL时,对两种霉菌的影响有限,两株霉菌可以在较高浓度的土霉素环境下均生长良好。菌渣里土霉素残留在416.6 u/mL左右,远低于1 800 u/mL的土霉素浓度,所以两种菌株在处理土霉素菌渣时,不会被土霉素抑制继而影响处理效率。

图4 土霉素浓度的变化对菌体生长的影响
2.5 菌株产蛋白酶条件的优化
2.5.1 培养基初始pH对菌株产蛋白酶能力的影响
向100 mL/250 mL察氏培养基中,分别接入1 mL M-1、M-2孢子悬液,初始pH值分别设定为5.5、6、6.5、7、7.5、8、8.5,平行3组,在30 ℃,转速为160 r/min条件下培养168 h,分别取样测定酶活,考察pH值变化对产酶活性的影响,结果如图5。
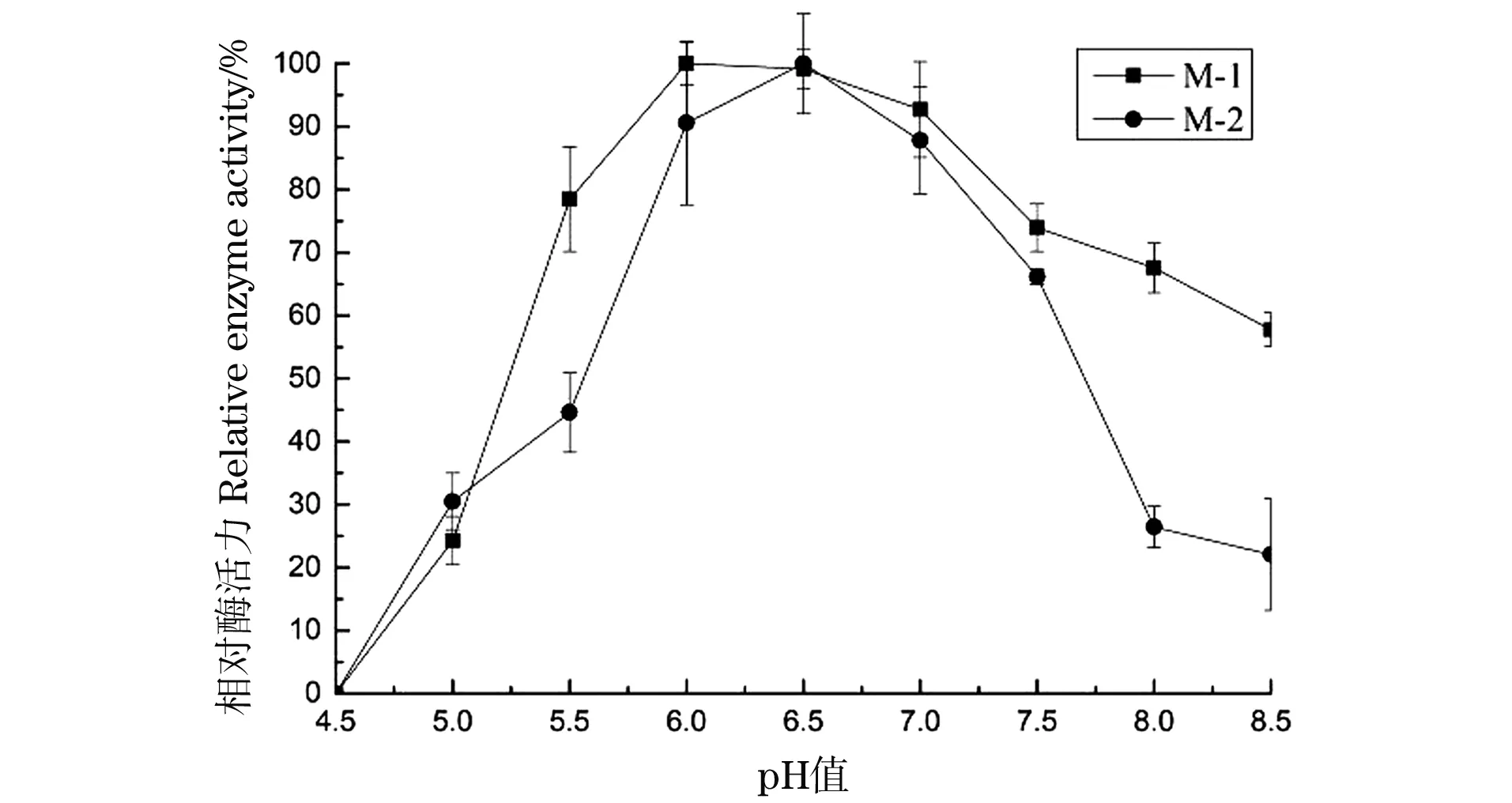
图5 初始pH对菌株产酶的影响
培养基初始pH值小于6.0时,菌株M-1和M-2均随着pH值的增大其产蛋白酶活力快速增加,pH值大于7.0时,随着pH值的增大其酶活力快速下降;菌株M-1在pH 6.0时,蛋白酶活力达到最高值,菌株M-1在pH6.5时其酶活达到最高。因此,菌株M-1和M-2产蛋白酶的最适初始pH值分别确定为6.0和6.5。
2.5.2 培养温度对菌株产蛋白酶能力的影响
向100 mL/250 mL察氏培养基中,分别接入1 mL M-1、M-2孢子悬液,pH值为 6.5,培养温度分别设置为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃,平行3组。在转速为160 r/min条件下培养168 h,分别取样,测定酶活,考察温度的变化对产酶活性的影响,结果如图6。

图6 培养温度对菌株产酶的影响
在30 ℃以下培养时,菌株M-1和M-2产生蛋白酶活力随着温度的升高而增大,温度达到30 ℃时,它们酶活力均达到最高,而后随温度的提高酶活力下降。因此,菌株M-1和M-2产蛋白酶的最适温度确定为30 ℃。
2.5.3 培养时间对菌株产酶的影响
分别向100 mL/250 mL察氏培养基中接入1 mL M-1孢子悬液、1 mL M-2孢子悬液,pH值为6.5,平行3组。在30 ℃转速为160 r/min条件下培养192 h。每隔24 h分别取样测定酶活,考察培养时间对产酶活性的影响,结果如图7。

图7 培养时间对菌株产酶的影响
培养到48 h时,菌株M-1、M-2均开始产蛋白酶,培养至72 h时,酶积累量开始增大。在168 h时M-1产酶活力达到最高值,而M-2在144 h时酶活达到最高;在最高点之后,两种菌的产酶活性随之缓慢下降。因此,菌株M-1和M-2产蛋白酶的最适培养时间分别确定为168 h和144 h。
2.5.4 菌渣添加量对菌株产蛋白酶能力的影响
分别在100 mL/250 mL蒸馏水中加入5、10、15、20、25 g的400目土霉素菌渣粉末,分别向其中接入1 mL M-1、M-2孢子悬液,平行3组。在pH 6.5,转速为160 r/min,30 ℃条件下培养144 h,分别测定酶活,考察菌渣添加量对产酶活性的影响,结果如图8。

图8 菌渣添加量对菌株产酶的影响
菌渣添加量为5%~10%,M-1产蛋白酶的活力随菌渣添加量的增大而增加,10%达到最高。M-2产蛋白酶活力在5%时达到最高,在10%时也保持了较高的酶活力。随后,两种菌的酶活力随着菌渣添加量的增大而快速下降。在菌株M-1和M-2产蛋白酶的培养基中添加过多菌渣不利于其产生蛋白酶,这可能是菌渣中的一些成分影响了菌的产酶活性。所以,菌株M-1和M-2在菌渣培养基产蛋白酶的最适菌渣添加量分别确定为10%和5%。
2.5.5 接种量对菌株产蛋白酶能力的影响
在100 mL/250 mL 5%的菌渣培养基中,分别接种1、3、5、7和9 mL的M-1、M-2孢子悬液,平行3组。在pH 6.5,转速为160 r/min,30 ℃条件下培养144 h,分别取样测定酶活,考察接种量对产酶活性的影响,结果如图9。
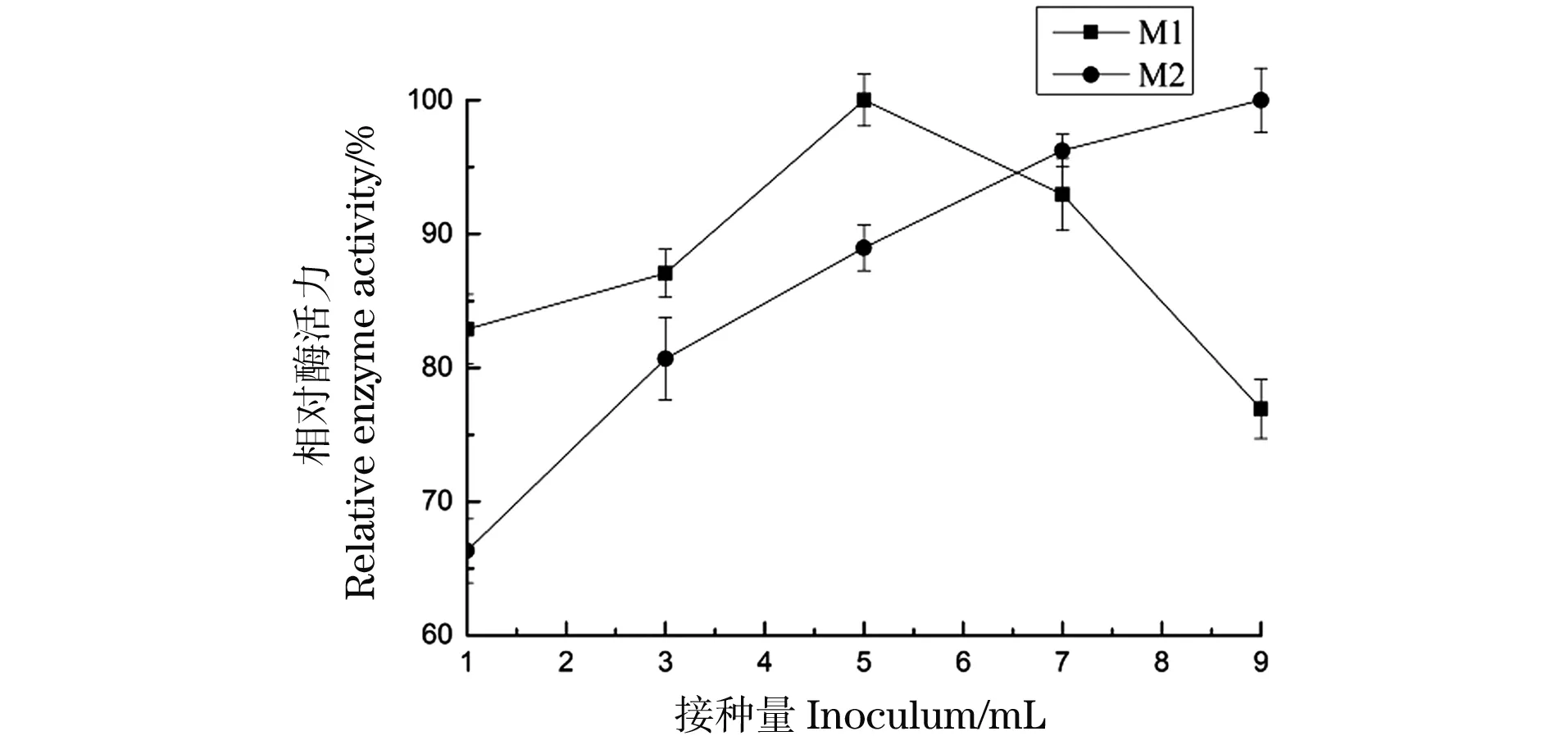
图9 接种量对菌株产酶的影响
菌株M-1的产蛋白酶活力随接种量的提高而增加,直至接种量为5 mL时其酶活力达到最高值,随后其产酶活力逐渐下降,这可能是因为增加初始菌体的量导致菌体生长加快、发酵周期缩短。菌株M-2开始时,随着接种量的加大其蛋白酶活力逐渐增加。所以,菌株M-1和M-2在菌渣培养基中产蛋白酶的最适接种量分别确定为5%和9%。
2.5.6 装液量对菌株产蛋白酶能力的影响
在250 mL的锥形瓶中分别加入5%的菌渣培养基20、40、60、80和100 mL,分别按照5%和9%的接种量接入M-1、M-2的孢子悬液,平行3组。在pH 6.5,转速为160 r/min,30 ℃条件下培养144 h,分别取样测定酶活,考察装液量对产酶活性的影响,结果如图10。

图10 装液量对菌株产酶的影响
菌株M-1在装液量低于40 mL时,其产生蛋白酶活力随装液量的加大而增加,在装液量为40 mL时酶活达到最高,而后其酶活下降。菌株M-2的产蛋白酶活力随着装液量的增加而逐渐提高。所以,在250 mL锥形瓶中,M-1、M-2的最佳装液量确定为40 mL和100 mL。
2.6 菌株在优化菌渣培养条件下的产蛋白酶活力测定
M-1的优化培养条件:在250 mL锥形瓶中,40 mL装液量,10%菌渣添加量,5%接种量,pH值6.0,30 ℃,摇床转速160 r/min培养168 h;M-2的优化培养条件:在250 mL锥形瓶中,100 mL装液量,5%菌渣添加量,9%接种量,pH值6.5,30 ℃,摇床转速160 r/min培养144 h。发酵结束后,测定蛋白酶活力。结果见表1。

表1 筛选菌株产蛋白酶活力
在菌渣培养基中,菌株M-2在其最适产酶条件下,发酵上清液中蛋白酶活为44.41 u/mL,菌株M-1在其最适产酶条件下产蛋白酶活性达到99.33 u/mL,比菌株M-2的高出1.24倍。
2.7 筛选菌株对土霉素菌渣的转化
筛选菌株对菌渣成分的转化研究中,共考察了菌渣总重量、蛋白成分的变化和发酵后游离氨基酸的变化等内容,结果见表2。

表2 菌渣活性成分的变化
菌株M-1和M-2在菌渣培养基中进行发酵时,对菌渣成分能够有效转化;其中M-1对总物质的转化率达到6.21%,其中对菌渣蛋白质成分转化尤为明显达到12.79%;菌渣经M-1发酵处理后其游离氨基酸含量有明显的提升,由原来7.14 mg增加到222.07 mg,提高了30倍。结果表明,筛选菌株M-1在简单的菌渣培养基中能很好地生长,而且对菌渣蛋白质有较好的水解和转化活性。菌株M-2对菌渣总物质的转化率达到2.4%,对菌渣蛋白质成分转化达到3.65%,菌渣经M-2发酵处理后其游离氨基酸含量有较好的提升,由原来7.14 mg增加到49.26 mg,提高了6倍。经M-1处理后的菌渣所减少的质量大部分是蛋白质被转化所致,而M-2处理后的菌渣减少的质量部分是转化蛋白质,另外一部分是被水解的其他物质减少的量。
3 结论
本实验筛选出两株M-1、M-2,经初步鉴定M-1为米曲霉菌,M-2为绿色木霉菌。M-1在pH 3、M-2在pH 6.5时生长量最大,均表现出良好的酸耐受性。两株霉菌在土霉素浓度1 800 u/mL的条件下生长良好,具有较好的土霉素耐受性。菌渣pH值及土霉素残留量对其生长没有抑制作用,适合应用于土霉素菌渣的处理[12],对碱性环境耐受性较差。两株霉菌对处理菌渣是有效的,M-1的处理效果好于M-2。M-1对菌渣蛋白质成分的转化率达到12.79%,游离氨基酸含量提高了30倍;菌渣经M-2发酵处理后其游离氨基酸含量提高了6倍。
筛选菌株可在酸性的菌渣环境中生长,可对生产菌渣进行发酵处理,可以得到蛋白质水解液,用水解液部分替代土霉素生产发酵培养基的碳、氮源进行生产土霉素,可降低生产成本;同时达到菌渣的回收利用和无害化处理目的。对含大量抗生素残留、成分复杂、难降解的危险污染物菌渣,目前还缺乏高效、节能、环境友好型的处理方法。土霉素菌渣中的蛋白质含量可达到43.88%,利用两株霉菌生长及代谢的不同,如果实现两种菌株的混合培养,作为互补进而加强对菌渣的处理能力,对危险菌渣的无害化处理及资源的再利用方面具有重大价值[13],这有待进一步研究。
