交联型“纳米花”酶用于拟除虫菊酯农药的高效水解研究
2022-06-18于劲松朱佳怡陈佳宇
刘 宇,叶 泰,曹 慧,袁 敏,于劲松,徐 斐,朱佳怡,祁 泓,陈佳宇
(上海食品快速检测工程技术研究中心,上海理工大学 健康科学与工程学院,上海 200093)
拟除虫菊酯是一类常用的杀虫剂,其结构类似于在菊花中发现的天然除虫菊酯,但具有更高的杀虫效力和环境稳定性[1]。拟除虫菊酯农药含有酯键,可以通过裂解、水解和不可逆抑制等方式破坏酯键进行降解[2]。有报道称羧酸酯酶能够水解拟除虫菊酯类农药[3],酯酶的催化机制取决于特定的催化三联体,该三联体由酯酶活性位点内的3 个氨基酸残基(丝氨酸、组氨酸和谷氨酰胺或天冬氨酸)组成[4]。然而,高温、极端pH 值和有机溶剂等环境均会严重影响酶的催化活力和稳定性[5-6]。因此,通过酶的固定化策略提高游离酶的表观活力及环境耐受性受到越来越多的关注[7]。但通过共价结合、吸附、包埋和交联等方法制备得到的固定化酶[8]存在固定方法繁琐、催化反应过程传质速率较差,以及由于固定过程中酶活性位点被封闭或酶构象发生变化而导致其活性丧失等缺点[9-10]。因此,迫切需要开发具有高催化活性和环境耐受性的酶固定化策略。
近年来,通过金属离子磷酸盐与蛋白质间的自组装作用形成的有机-无机杂化纳米花材料被广泛用于固定化酶的制备[11-12]。与传统制备方式相比,该方法制备条件温和,且杂化“纳米花”材料固有的大比表面积可有效降低传质阻力,制备得到的“纳米花”酶具有较好的酶活和化学稳定性[13-14]。前期工作中,本小组采用生物矿化策略制备了钙离子猪肝酯酶杂化“纳米花”酶(Ca3(PO4)2-PLE),并将其用于拟除虫菊酯农药的水解实验[15],但酶活仅为游离酶的169%,且制备的纳米花酶循环使用6次后,残余酶活仅为初始值的10%。有研究表明,多级层状结构自身的柔性会导致制备得到的蛋白-金属杂化纳米花酶在离心纯化过程中易被破坏,造成酶活力降低[16-17]。因此,进一步提高纳米花酶的机械强度有利于改善其贮存稳定性以及可重复利用性[18-19]。
本文在生物矿化策略的基础上,引入戊二醛作为交联剂,制备了交联型猪肝酯酶杂化“纳米花”酶(CL-PLE-NFs)。通过戊二醛交联,有效改善了纳米花酶的储藏稳定性、有机试剂耐受性以及可重复利用性。在优化交联杂化“纳米花”制备条件的基础上,进一步研究了其催化活性及短时间内对拟除虫菊酯类农药的水解性能,为构建基于酶水解法的拟除虫菊酯类农药残留快速检测方法提供了新的思路。
1 实验部分
1.1 仪器与试剂
Waters 1525 高效液相色谱仪(美国Waters 公司);Sepax HP-C18色谱柱(4.6 mm×250 mm,5 μm,美国赛分公司);Inspect F50扫描电子显微镜(美国FEI公司);JEM-2100高分辨透射电镜(日本电子株式会社);JiS5 傅里叶红外扫描仪(美国Nicolet 公司);MD200-2 氮吹仪(杭州奥盛仪器有限公司);恒温混匀仪(杭州米欧仪器有限公司)。
猪肝酯酶(PLE)、戊二醛(Sigma-Aldrich 公司);溴氰菊酯、氯氰菊酯、氟氯氰菊酯、氰戊菊酯、S-氰戊菊酯、高效氟氯氰菊酯、高效氯氟氰菊酯、联苯菊酯、氟胺氰菊酯、高效氯氰菊酯、甲氰菊酯等菊酯类农药(上海农药研究所);磷酸盐缓冲液(PBS,1X,pH 7.4);考马斯亮蓝G-250(生物级,生物工程上海股份有限公司);七水合硫酸钴(CoSO4·7H2O)、磷酸氢二钠、磷酸二氢钠、乙腈、甲醇、丙酮、乙醇、十二烷基硫酸钠(SDS)、乙酸-1-萘酯、固兰B及其他试剂(上海国药化学试剂有限公司)。所有试剂均为分析纯,实验用水为双蒸水。
1.2 CL-PLE-NFs的合成与交联
在6 mL 含0.25 mg/mL 猪肝脂酶的PBS(1X,pH 7.4)中,加入40 μL、500 mmol/L 的CoSO4·7H2O,反应过夜,然后加入20 μL、50 mmol/L 的戊二醛溶液,反应4 h 后,离心去除上清液,用超纯水水洗3次除去杂质,入0.6 mL 磷酸盐缓冲溶液(5 mmol/L,pH 8.4)混匀,4 ℃下保存备用。
1.3 酶活及包封率的测定
根据文献方法进行改进[20-21]:将猪肝酯酶和杂化“纳米花”以超纯水适当稀释备用,试管中先加入2 mL pH 6.4 的柠檬酸-柠檬酸三钠缓冲液,再加入0.5 mL 稀释后的酶液,最后加入50 μL 底物(125 mmol/L的乙酸-1-萘酯丙酮溶液)混合均匀,在30 ℃水浴反应5 min后,加入0.5 mL显色剂(0.4%固兰B的1.8%SDS溶液)混合均匀,再于30 ℃水浴反应5 min。以不加底物的反应液作空白,测定595 nm处的吸光度。1 U的定义为每分钟能水解10-6mol乙酸-1-萘酯的酶量。根据式(1)计算初始总酯酶活力:

其中,D为酶液的稀释倍数;A595为反应液在595 nm 处的吸光度(OD);K为对应pH 值条件下乙酸-1-萘酯标准曲线的斜率(10-6mol/OD);V为酶液总体积(mL)。
利用考马斯亮蓝法[22]对猪肝酯酶杂化“纳米花”的实际蛋白质含量进行测定。杂化“纳米花”中蛋白质含量与初始加入的猪肝酯酶蛋白质含量之比即为包封率(EY):

其中,m为杂化纳米花中猪肝酯酶的质量(mg);M为初始加入到溶液中的猪肝酯酶的质量(mg)。
1.4 CL-PLE-NFs的酶促动力学曲线[23]
将2 mL pH 6.4的柠檬酸-柠檬酸三钠缓冲液与0.5 mL猪肝酯酶置于10 mL试管中,加入50 μL不同浓度的底物,混匀后30 ℃水浴反应5 min。然后加入0.5 mL显色剂,再于30 ℃水浴反应5 min。以不加底物的反应液作空白,测定595 nm 处的吸光度。杂化“纳米花”的测定方法同上。根据米氏方程(3),计算米氏常数Km(mol/L)和最大反应速度Vmax(mol·s-1·mg-1)。

其中,V为初始反应速度(mol·s-1·mg-1);[S]为底物浓度(mol/L)。
1.5 拟除虫菊酯类农药水解性能的研究
取“1.2”制得的杂化“纳米花”溶液于玻璃管中(酶活力为44 742 U),分别加入200 μL、10 μg/mL 的11种菊酯农药,于45 ℃以800 r/min 振荡反应5 min进行水解,再用高效液相色谱检测剩余农药浓度。高效液相色谱分析:将5 mL乙腈和1 g NaCl加入到上述酶解反应液,于25 ℃下以1 200 r/min振荡10 min,静置分层后,取4 mL 上清液40 ℃氮吹至干,然后加入200 μL 乙腈复溶,用高效液相色谱检测。
液相色谱条件:色谱柱为Sepax HP-C18(4.6 mm × 250 mm,5 μm);流动相A 为乙腈,B 为超纯水,A 相∶B 相= 78∶22(体积比);流速为1 mL/min,进样量为20 μL,检测波长为230 nm,柱温25 ℃。农药水解率的计算公式如下:

式中,c0、c1分别为水解前、后菊酯类农药的质量浓度(μg/mL)。
2 结果与讨论
2.1 CL-PLE-NFs的制备条件优化
CL-PLE-NFs 的合成过程如图1 所示。不同的合成条件会对CL-PLE-NFs 的蛋白包封率和酶活力产生不同的影响,这主要与制备过程中酶的稳定性有关[24]。分别对猪肝酯酶的质量浓度以及交联剂戊二醛的浓度进行优化,并以相对酶活为指标,筛选出最优的制备条件。图2A 为不同质量浓度PLE 对交联杂化“纳米花”酶活的影响。当加入酶的质量浓度为0.25 mg/mL 时,酶活最高,为游离PLE 的195%,之后随着酶质量浓度的增加,相对酶活逐渐下降。这可能是因为溶液中Co2+和PLE 的成核位点所能固定的酶量一定,不会随着酶质量浓度的增加而增加。Wang 等[25]的研究表明,酶的质量浓度会对交联杂化“纳米花”的形态造成影响,当酶质量浓度从0.2 mg/mL 增加至2 mg/mL 时,所形成的固定化酶逐渐从花状结构变成平行六面体,且酶活随之降低。因此,选择猪肝酯酶的质量浓度为0.25 mg/mL。

图1 CL-PLE-NFs的制备Fig.1 The schematic of CL-PLE-NFs synthesis
如图2B 所示,随着戊二醛浓度的增加,酶活呈现上升趋势,当戊二醛的浓度为0.05 mol/L 时,酶活达到最高值,为游离PLE的224%。随着戊二醛浓度的进一步增加,酶活有所降低。这可能是因为戊二醛的浓度较低时,所能结合的蛋白质分子较少,表现为较低的酶活。但随着戊二醛浓度的增加,固定的PLE 越来越多,过多的酶会堵塞载体孔道,使酶的活性位点相互遮盖,导致酶活性降低。因此,选择0.05 mol/L作为戊二醛的最适浓度。
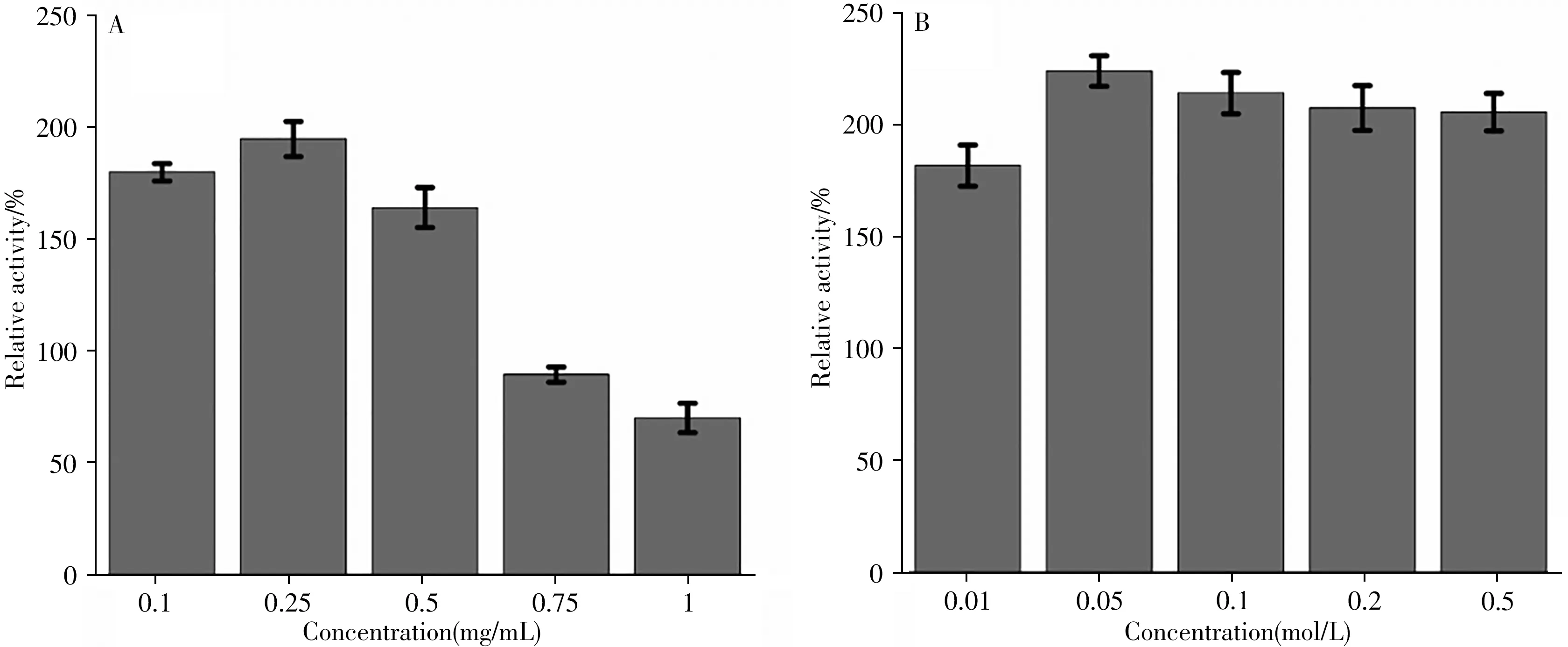
图2 猪肝酯酶质量浓度(A)与戊二醛浓度(B)对CL-PLE-NFs酶活力的影响Fig.2 Effects of porcine liver esterase mass concentration(A)and glutaraldehyde concentration(B)on the enzyme activity of CL-PLE-NFs
2.2 CL-PLE-NFs的红外光谱
为了证明游离PLE 已经成功负载,对CL-PLENFs 和游离PLE 进行红外光谱(FT-IR)分析。结果如图3 所示,575 cm-1和614 cm-1处为磷酸基团的面内弯曲振动;992 cm-1和1 078 cm-1处是P—O 和P===== O 的不对称伸缩振动,表明存在磷酸基团;从图中还可以发现1 620 cm-1和1 655 cm-1处存在明显的N—H 弯曲振动,表明杂化“纳米花”中存在氨基,证明了蛋白质的存在。这些结果均说明CL-PLE-NFs成功制备。
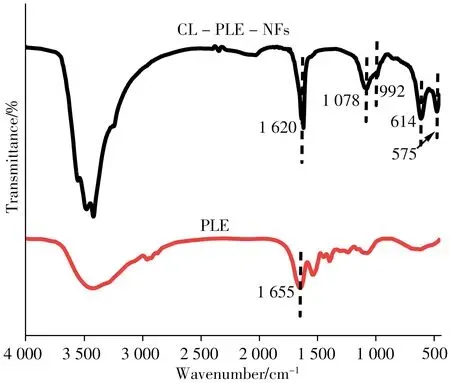
图3 PLE和CL-PLE-NFs的红外光谱图Fig.3 FT-IR spectra of PLE and CL-PLE-NFs
2.3 CL-PLE-NFs的酶活力与动力学研究
在最优的制备条件下,对游离PLE 和CL-PLENFs 的酶活进行测定和计算,得到游离PLE 的酶活为5 712 U/mg;CL-PLE-NFs 的酶活为13 232 U/mg,包封率为45.18%。与游离酶相比,CL-PLE-NFs 的酶活提高了231%。说明Co2+和组氨酸的配位结合选择性地驱动了矿化和戊二醛的交联作用,有助于“纳米花”的合成,并可以提高酶活力。进一步评估了CL-PLENFs 的催化活性,通过测定不同底物浓度下PLE 和CL-PLE-NFs 的酶活,对初始反应速率进行非线性曲线拟合,计算PLE 和CL-PLE-NFs 的动力学参数Km和Vmax。从图4可以看出,CL-PLE-NFs的Km值约为游离PLE的150%,可能是因为交联剂戊二醛的加入增加了传质阻力,造成纳米花酶与底物的亲和力降低。另外,由图4 插图可知,CL-PLE-NFs 的Vmax为游离酶的134%,可能是因为纳米花的比表面积大,增加了底物与活性位点碰撞的可能性。

图4 PLE和CL-PLE-NFs的米氏曲线Fig.4 Michaelis curves of PLE and CL-PLE-NFs
2.4 CL-PLE-NFs的稳定性分析
对CL-PLE-NFs 的pH 值(5.0 ~9.0)稳定性和温度(20 ~60 ℃)稳定性进行测定。图5A 为游离PLE和CL-PLE-NFs的pH值稳定性结果,可以发现在不同pH值下放置30 min之后,两种酶均可以保留64%以上的酶活,而且pH 值越高,酶活损失越少,说明碱性环境有利于酶的水解作用。除此之外,还发现CL-PLE-NFs在不同pH值条件下残余的酶活力均高于游离PLE,具有更好的pH值稳定性。从图5B可以看出,CL-PLE-NFs在40 ℃之前比较稳定,50 ℃时仍保留有65%的活性,而游离PLE 在大于30 ℃之后迅速失活。结果说明CL-PLE-NFs 具有良好的温度稳定性,这可能是因为CL-PLENFs的片层状花瓣结构对PLE具有保护作用,可以使其在实际应用中使用的温度范围更广。
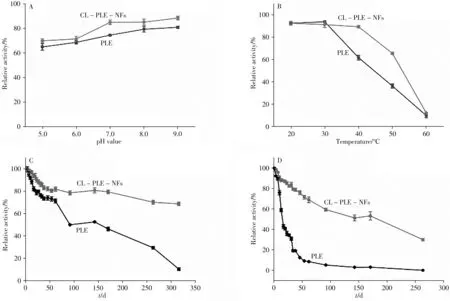
图5 pH值(A)、温度(B)对PLE和CL-PLE-NFs相对酶活的影响,以及4 ℃(C)、25 ℃(D)时PLE和CL-PLE-NFs的储藏稳定性Fig.5 The effects of pH value(A)and temperature(B)on the relative activity of PLE and CL-PLE-NFs,and the storage stability of PLE and CL-PLE-NFs at 4 ℃(C)and 25 ℃(D)
从图5C可以发现,CL-PLE-NFs在4 ℃下储藏320 d仍能保留70.85%的活性,而游离PLE 的酶活呈现逐渐下降的趋势,在20 d 之后,酶活已经不足80%,当储藏时间到达92 d 时,游离PLE 的酶活损失一半。图5D 也呈现类似的现象,CL-PLE-NFs 在25 ℃条件下储藏171 d 后依然能够保留59%以上的活性,且其稳定性远高于游离PLE。游离PLE 的酶活在储藏7 d后即开始急速下降;经过31 d后,酶活已不足20%;随着时间的进一步延长,当储藏时间达到92 d 时,游离PLE的酶活只有初始酶活的5%。表明经过交联杂化的PLE 的储藏稳定性远优于游离PLE。
2.5 CL-PLE-NFs的有机试剂耐受性
考察了CL-PLE-NFs对15%的甲醇、乙腈、乙醇、丙酮的耐受性。结果如图6所示,在分别含有上述4种常用有机试剂的环境中,CL-PLE-NFs的相对酶活分别为游离酶的4.5、1.75、2.4和5倍,表明CL-PLE-NFs对于有机试剂有着更好的耐受性。

图6 4种有机试剂对PLE和CL-PLE-NFs酶活力的影响Fig.6 The effects of four kinds of organic solvent on the activity of PLE and CL-PLE-NFs
2.6 CL-PLE-NFs对不同拟除虫菊酯类农药水解性能的研究
CL-PLE-NFs 在5 min 内对11 种拟除虫菊酯类农药的水解结果如图7 所示,其对Ⅰ型和Ⅱ型菊酯类农药的水解率均在55%以上,说明合成的CL-PLE-NFs 对菊酯类农药具有良好的水解性能。对于不同的拟除虫菊酯类农药,CL-PLE-NFs 的水解效率不同。这可能是因为农药分子的精细结构存在差异。对于Ⅱ型菊酯类农药,氯氰菊酯的水解效果最好,水解率达93.91%;对Ⅰ型菊酯类农药联苯菊酯的水解率达到了62.12%。

图7 CL-PLE-NFs对不同拟除虫菊酯类农药的水解率Fig.7 Hydrolysis rates of different pyrethroids by CL-PLE-NFs
2.7 CL-PLE-NFs的可重复利用性
为了验证CL-PLE-NFs 的可重复利用性,选取溴氰菊酯为对象进行循环水解实验,考察了不同重复利用次数条件下,CL-PLE-NFs对溴氰菊酯的水解性能。结果如图8 所示,CL-PLE-NFs 在循环使用8 次后仍保持80.52%的水解效率。随着循环次数的增加,CL-PLENFs 对于溴氰菊酯的水解率逐渐降低。经过12 次循环反应后,CL-PLE-NFs 对溴氰菊酯仍保持65.37%的水解率。以上结果表明,交联型杂化纳米花酶具有优异的重复利用性。

图8 CL-PLE-NFs在拟除虫菊酯农药水解实验过程中的可重复利用性Fig.8 Reusability of CL-PLE-NFs in pyrethroid pesticide hydrolysis experiment
3 结 论
本文制备了CL-PLE-NFs,其表观酶活为游离酶的231%,在4 ℃条件下贮藏320 d 后,仍能保留70.85%的酶活力;此外,该酶对Ⅰ型和Ⅱ型的菊酯类农药均有较好的水解能力,在5 min 内对11 种拟除虫菊酯农药的水解率均达55%以上。且循环使用12 次后,对溴氰菊酯农药的水解效率仍达65.37%。CLPLE-NFs有望用于酶法拟除虫菊酯农药快速检测试剂盒的开发与应用。
