miRNA-155-5p与近日节律基因Bmal1对小鼠骨髓间充质干细胞增殖、衰老的影响
2022-06-18郑佳雯1,2,赵青1,3,2

婆婆听了我的想法,考虑了一个晚上,最后郑重地告诉我:“孩子,我尊重你的选择,明天我们就去医院检查,如果没什么问题,你就去外地,我跟你去,陪在你身边照顾你!”
1 材料和方法
1.1 主要材料和试剂
胎牛血清(Gibco,美国);α⁃MEM 完全培养液(Gibco,美国);1%青链霉素双抗(Gibco,美国);嘌呤霉素(Biofroxx,德国);含EDTA 的胰酶消化液(Millipore,美国);HB⁃infusion TM 试剂盒(Thermo,美国);载体质粒(Promega,美国);引物序列(Invit⁃rogen,美国);Trizol(Invitrogen,美国);RIPA 裂解液(Millipore,美国);流式细胞仪(FACS Canto Ⅱ,BD,美国);实时荧光定量PCR 仪(Prism
7500,ABI,美国);高速冷冻离心机(CF1524R,Scilogex,美国);凝胶成像仪(GelDoc MP,Bio⁃Rad,美国)。CCK⁃8 试剂盒(Biolite,中国);β⁃半乳糖苷酶试剂盒(Biovision,美国);CD29、CD34 抗体(Abcam,英国)。
(3) 工程处治方案。清除坡面浮石、危岩,在贯通性张拉裂缝后部设置被动网,对崖顶后部缓坡地段的小型落石进行拦截;对崖顶倾倒体采用挂网喷混凝土和设置垫墩锚索进行预加固,防止倾倒体在风化和卸荷作用下稳定性进一步降低;在陡崖顶部锚固工程上部设置张口式导石网,对陡崖上部和陡崖坡面上分布的零星危岩进行防护;在坡脚桥墩部位设置拦石墙,利用废弃的G317国道形成落石槽,防止落石在坡脚直接冲击桥墩,并作为导石网拦截落石的停积场地。
书中指出,虽然和西方相比,中国语言哲学对概念的重视是滞后的,然而,言、象、意作为中国古典哲学和诗学的核心范畴,其关系定位代表了中国古代的语言哲学和诗学理念。作者指出,当中国古典诗歌被翻译为具有很强名思维特征的英语时,如何处理言象意的关系十分关键。译者必然会在翻译中体现出象表述取向或者言表述取向。作者以叶维廉的诗歌“模子论”具体说明了译者对中西诗歌之间异质性特征的体认,以及在目的语中的有效传达。
1.2 细胞培养与鉴定
加入PBS 清洗,1 000 rpm 离心3 min,去上清,重复3 次后,加入5 μL CD29、CD34 抗体和100 μL PBS,室温避光孵育30 min,补液至1 000 μL,流式细胞仪检测。
1.2.2 BMMSCs 表面标志物鉴定 取P3 代细胞,PBS 冲洗3 次,加入0.25%胰酶消化。待显微镜下观察到细胞悬浮变圆后,终止消化并适当吹匀,转移至干净培养基中,1 000 rpm 离心5 min,弃去上清。
1.2.1 BMMSCs 原代细胞提取及传代 本实验已取得四川大学华西口腔医院伦理委员会批准(审批号:WCHSIRB⁃D⁃2018⁃024)。选取1月龄C57BL/6雄性小鼠,购于四川大学华西实验动物中心(合格证号:SCXK(川)2009⁃009),断颈处死后置于75%酒精中浸泡3~5 min,取出后分离皮毛,小心剥离股骨及胫骨的肌肉组织,置于磷酸缓冲液(phos⁃phate buffer saline,PBS)中洗净。去除骨骺两端使其露红,用1 mL 注射器吸取少量完全培养基,从一端轻柔冲洗骨髓腔,至骨头呈半透明状。使用0.22 μm 滤器过滤冲洗液,置于15 mL 离心管中,1 000 rpm 离心5 min,弃上清,加入5 mL 完全培养基重悬。置于培养箱(37 ℃,5% CO
)中培养,24 h后进行半换液,48 h 后全换液,此后2~3 d 换液1 次。倒置显微镜下观察,当细胞融合率达到80%~90%时,用0.25%的胰蛋白酶进行消化传代,取第3 代细胞用于后续实验。
1.3 miR⁃155⁃5p 及Bmal1 过表达/干扰的BMMSCs稳转细胞系的构建及验证
一个月后,秀容月明投军去了。他上了战场,脑子里从没有“怕”字,拿起笔,家书、文书、奏章,什么都能写,还能给长官出谋划策,有了功劳,也不自居。十五年间,他先从步兵做起,然后是小队长、统领、统制、招讨使,直至枢密副使,战功赫赫,威震天下,百姓提起他,都叫他秀容元帅。

1.4 miR⁃155⁃5p 及Bmal1 过表达/干扰对BMMSCs增殖的影响
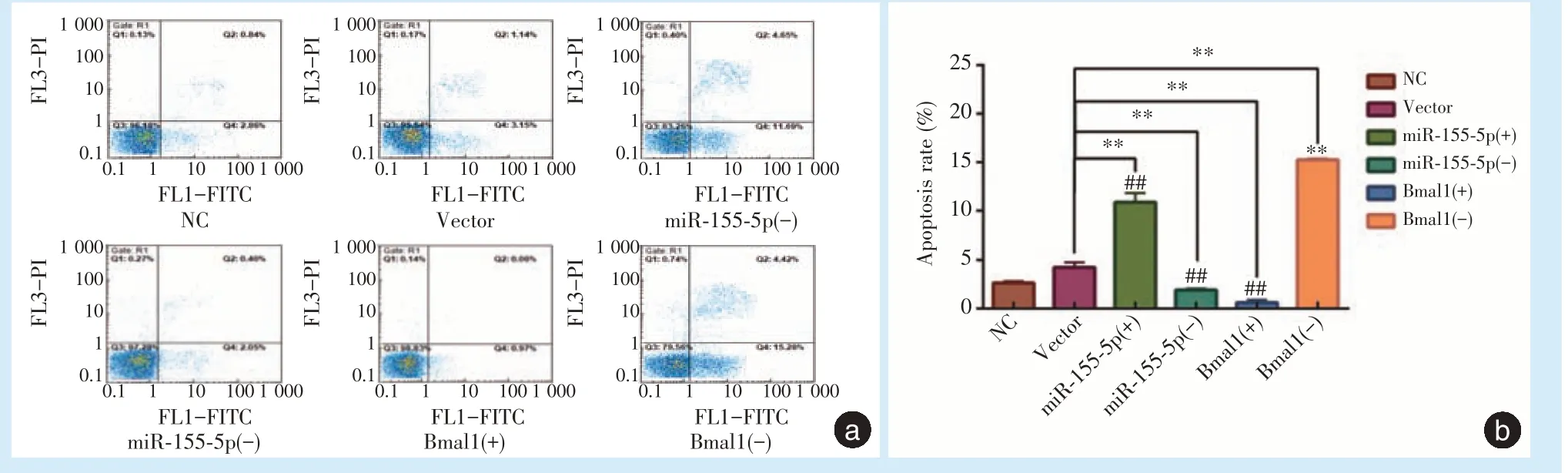
1.4.1 分组 共6组,①BMMSCs空白对照组(NC);②转染空病毒组(Vector);③miR⁃155⁃5p 过表达组[miR⁃155⁃5p(+)];④miR⁃155⁃5p 干扰组[miR⁃155⁃5p(⁃)];⑤Bmal1 过表达组[Bmal1(+)];⑥Bmal1 干扰组[Bmal1(⁃)]。
2.3.4 衰老相关基因P53、P16 的表达 正常培养与空病毒转染后的BMMSCs,P16、P53 mRNA 的表达基本一致,病毒转染对目标基因的表达无影响。miR⁃155⁃5p 过表达后,BMMSCs 中P16、P53 mRNA 表达均升高,差异有统计学意义(
<0.01);干扰miR⁃155⁃5p 的表达,P53、P16 mRNA 表达均显著降低。
(1)淬火能否正常落入水槽问题 根据淬火设备的优缺点,最终选用2#立喷淬火。在试吊期间,发现南立喷外环有5个外环管(4#、8#、9#、10#、19#)开度不够大,阻碍管板落入。针对以上问题,制造厂会同维修人员一起研究问题解决方案,经过1天时间,维修人员顺利对5根外环管全部矫直,矫直后再次进行试吊,管板可正常落入水槽(见图3)。
取生长状态良好的P3 代细胞,当细胞融合度为40%~50%时进行慢病毒转染,miR⁃155⁃5p 过表达和干扰慢病毒的靶序列分别为5’⁃CGATACAC⁃GAAGATTAGCATGGC ⁃ 3’,5’⁃ AACGCTTCAC⁃GAATTTGCGT⁃3’;Bmal1 过表达慢病毒和Bmal1 干扰慢病毒的靶序列分别为5’⁃GAGCAGTAATTC⁃TAGGCGATCGCTCGAG⁃3’,5’⁃AGCGGCCGCTCCG⁃CAATTAGCG⁃3’(汉恒,中国)。12 h 后更换为新鲜的完全培养基继续培养,48 h 后加入1 μg/mL 嘌呤霉素(Biofroxx,德国)筛选稳转细胞株,并进行传代。qRT⁃PCR 检测miR⁃155⁃5p 及Bmal1 的表达以验证慢病毒转染的效果。用PBS 冲洗细胞2~3 次,每孔细胞加入500 μL Trizol 裂解液,分离提取RNA,经逆转录为cDNA,用qRT⁃PCR 仪检测miR⁃155⁃5p 及Bmal1 基因的表达,引物序列见表1。
1.4.4 β⁃半乳糖苷酶实验 细胞培养72 h 后分组制备细胞悬液,计数后,以1×10
个/孔接种至6 孔板,去除细胞培养液,PBS 洗涤后,每孔加入1 mL染色固定液,室温下固定15 min。去除固定液,PBS 洗涤细胞3 次,每次3 min。去除PBS,每孔加入1 mL 染色工作液,用封口膜封住6 孔板,37 ℃孵育过夜。去除工作液,加入2 mL PBS 重悬,倒置显微镜下观察。
1.4.5 qRT⁃PCR 检测衰老相关基因的表达 细胞培养72 h后分组制备细胞悬液,计数后,以1×10
个/孔接种于12 孔板,加入PBS 洗涤2~3 次,每孔加入500 μL Trizol 裂解液,提取总RNA,逆转录为cD⁃NA,使用qRT⁃PCR 仪检测P16、P53 基因的表达,引物序列见表1。
1.5 统计学分析
软件应用采用结合我们院咨询项目和用户应用相结合的方法,典型工程包括武汉国际博览中心会议中心绿建咨询项目,上海虹桥商务区核心区一期绿建咨询项目,扬中园博园三馆建筑设计和能效评价项目,无锡太湖国际博览中心大酒店能效测评项目,徐州医学院附属医院病房楼能效测评项目,武进影艺宫能效测评项目等。
2 结 果
2.1 BMMSCs 的培养和鉴定
P0 细胞培养12 h 后,镜下可见部分贴壁,但大多为圆形,2 d 后呈现多形性,有圆形、纺锤形及不规则形态(图1a)。5 d 后融合率达80%~90%,呈现较均一的梭形(图1b)。传代后,30 min 即可见P1 代细胞贴壁,2 d 后融合80%~90%,呈梭形(图1c)。P3 代细胞中大多数造血干细胞已除尽,细胞呈漩涡状生长(图1d),胞体折光性较好,可用于后续实验。
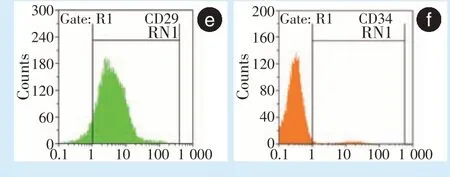
BMMSCs 表面标志物CD29 阳性率93.08%、CD34 阳性率2.49%(图1e、1f),分离培养的细胞来源于间充质干细胞,而非造血干细胞来源。

2.2 miR⁃155⁃5p 及Bmal1 过表达/干扰的BMMSCs稳转细胞系的构建及验证
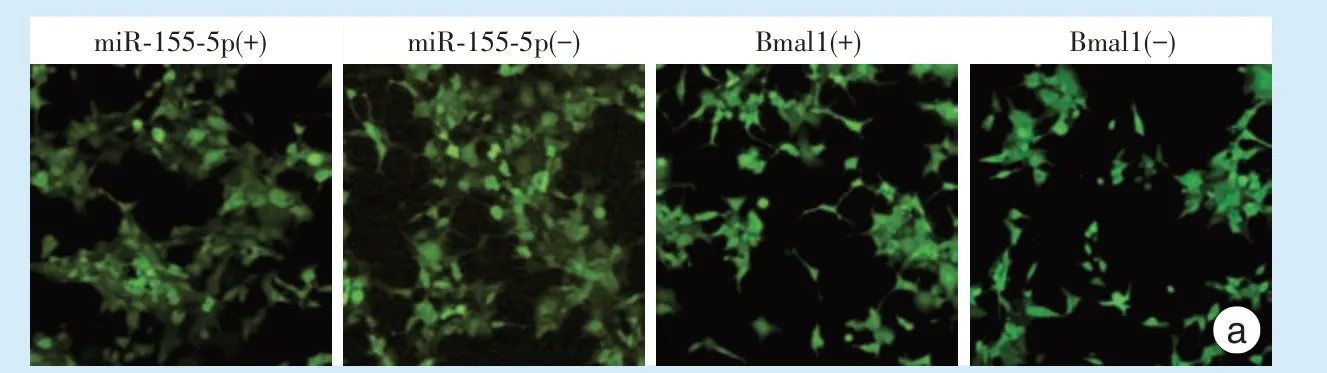
荧光显微镜下观察转染后各组ZsGreen 绿色荧光表达情况,miR⁃155⁃5p 过表达/干扰组、Bmal1过表达/干扰组中,成功转染的细胞,可观察到绿色荧光(图2a),而转染空病毒组和空白对照组未转染病毒,镜下无法观察到绿色荧光。
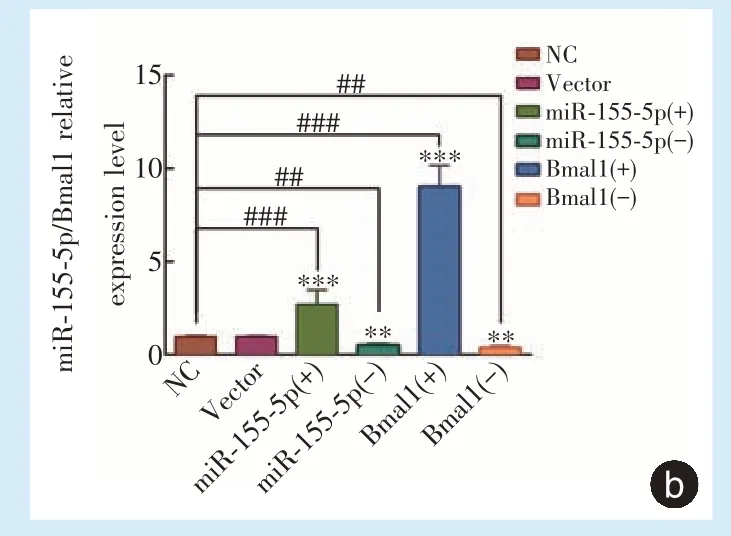
qRT⁃PCR 检测转染后miR⁃155⁃5p 及Bmal1 的表达变化,与转染空病毒组和空白对照组相比,miR⁃155⁃5p 及Bmal1 过表达组相应基因mRNA 的相对拷贝数明显升高,差异具有统计学意义(
<0.01),miR⁃155⁃5p 及Bmal1 干扰组相应基因mRNA的相对拷贝数明显降低(图2b),差异具有统计学意义(
<0.01)。上述结果表明慢病毒感染有效,稳转细胞系构建成功。
销售成本(主营业务成本)是利润表中影响利润总额的一项重要指标。由于发出存货计价方法的选择,最终要转入主营业务成本并直接影响当期损益。
2.3 miR⁃155⁃5p 及Bmal1 过表达/干扰对BMMSCs增殖及衰老的影响
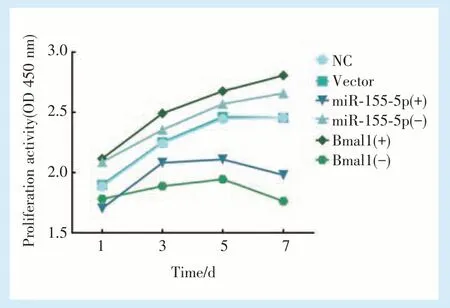
2.3.1 BMMSCs 增殖活性检测结果 CCK⁃8 结果显示,空病毒转染的BMMSCs 与正常培养的BMMSCs,细胞增殖活性无明显差异,可以证明慢病毒转染本身对细胞增殖活性没有影响。miR⁃155⁃5p 过表达的BMMSCs,增殖能力被抑制,增殖活性降低。相反,干扰miR⁃155⁃5p 的表达,细胞增殖活性明显增强。Bmal1 过表达的BMMSCs,增殖能力显著增强,干扰正常BMMSCs 中Bmal1 的表达,增殖活性降低(图3)。
1.4.3 流式细胞术检测细胞凋亡 细胞培养72 h后分组制备细胞悬液,计数,约1×10
个/mL。1 000 rpm 离心5 min 后,弃去培养液。用PBS 洗涤,1 000 rpm 离心5 min,弃去上清,加入70%乙醇,于4 ℃下固定2 h,离心弃去固定液,加入3 mL PBS 重悬5 min。使用400 目筛网过滤后,1 000 rpm离心5 min,去上清。用1 mL PI 染液染色,4 ℃避光30 min,上机检测。
2.3.2 凋亡率 miR⁃155⁃5p 过表达的BMMSCs,细胞早期凋亡率为11.69%,相比空病毒转染的BMMSCs 的凋亡率3.15%,明显升高,差异具有统计学意义(
<0.01)。干扰miR⁃155⁃5p 的表达,可以减少细胞的早期凋亡,BMMSCs 凋亡率为2.05%,与对照组相比,差异具有统计学意义。过表达Bmal1的BMMSCs,早期凋亡率显著降低,约为0.97%,而Bmal1 表达受到干扰的细胞,早期凋亡现象明显,凋亡率15.28%,差异具有统计学意义(图4)。
2.3.3 β⁃半乳糖苷酶活性检测结果 β⁃半乳糖苷酶在衰老细胞中活性显著增加。实验结果显示,过表达miR⁃155⁃5p 后,衰老细胞增多,β⁃半乳糖苷酶显色反应明显,干扰miR⁃155⁃5p 表达后,衰老相关的β⁃半乳糖苷酶活性降低。
过表达Bmal1 后,BMMSCs 中β⁃半乳糖苷酶活性降低,反之,干扰Bmal1 表达,BMMSCs 衰老特征显著,β⁃半乳糖苷酶活性增加(图5)。

1.4.2 CCK⁃8 检测细胞增殖活性 分组制备细胞悬液,计数后,细胞以1×10
个/孔接种至96 孔板,培养2~4 h(37 ℃,5%体积分数CO
)后,每孔加入10 μL CCK⁃8,轻敲培养板辅助混匀,继续培养4 h,测定450 nm 吸光度。

Bmal1 的效应与miR⁃155⁃5p 相反,即过表达Bmal1 后,衰老相关基因的表达被抑制,P16、P53 mRNA 表达水平降低;干扰Bmal1 的表达,P16、P53 mRNA 表达水平明显升高(图6)。


3 讨 论
提取小鼠BMMSCs 的方法有密度梯度离心法、全骨髓贴壁法、流式细胞仪法
。本实验采用全骨髓贴壁法,此法简单且对细胞损伤小,但早期提取的细胞中多有杂细胞。本实验结果证明,换液并传代至第三代后,BMMSCs 纯度较高(>90%),可用于后续实验,与其他BMMSCs 的相关研究结果基本一致
。BMMSCs 表面可表达生长因子、细胞因子及黏附因子受体,包括CD29、CD44、Sca⁃1 等,而不表达造血细胞的表面标志物,如CD34、CD14等
。为了排除细胞中过多的杂细胞对实验结果的影响,使用流式细胞仪对CD29 及CD34 进行鉴定,结果显示培养的P3 代细胞为高纯度的BMMSCs。
本课题组前期研究表明,Bmal1 在小鼠BMMSCs 中受到miR⁃155⁃5p 的负向调控,生物信息学网站的初步预测以及双荧光素酶实验均验证了miR⁃155⁃5p 与Bmal1 的靶向关系
。为了进一步探索二者对BMMSCs 增殖、衰老和凋亡的影响,构建了miR⁃155⁃5p 及Bmal1 过表达/干扰的慢病毒,对BMMSCs 进行转染并用1 μg/ mL 嘌呤霉素筛选出了稳转细胞株。
miR⁃155 宿主基因位于B 细胞整合簇(B⁃cell integration cluster,BIC)基因的外显子部分
,miR⁃155⁃5p 由其编码产生,在肿瘤形成、炎症发展、机体免疫等方面发挥重要作用
。研究表明,miR⁃155⁃5p 参与调控了细胞的成骨和破骨
。
哺乳动物近日钟基因的核心组成包括Bmal1(brain and muscle arnt⁃like 1)、Per(period)、Clock(circadian locomotor output cycles kaput)、Cry(cryp⁃tochrome)以及维甲酸受体相关孤儿受体α(reti⁃noid acid receptor related orphan receptor α,Rorα)和核受体Rev⁃erbα
,以上近日钟基因可以通过振荡器系统形成自我调节的负反馈网络来调控生物节律,而生物节律的紊乱不可避免地会导致机体出现衰老情况。轮班工作、睡眠不足和禁食都可能导致近日节律紊乱,继而导致骨改建失调,如连续24 周暴露在光照中的小鼠会出现早期骨质疏松的特征
。骨的增龄性改变源于BMMSCs 增殖能力和成骨分化能力的下降,并伴随成脂向分化的增加。不仅如此,多种骨、牙周重塑相关基因和骨代谢标志物受到近日节律的影响,呈节律性表达
。研究发现,哺乳动物核心近日钟基因Bmal1和Per2 参与BMMSCs 成骨分化能力和增殖能力的调控。本课题组的前期研究初步揭示了Bmal1 与骨衰老表型的关系,并且发现miR⁃155⁃5p 在衰老小鼠中可能参与了Bmal1 的负向调控
。然而miR⁃155⁃5p 对BMMSCs 增殖能力的影响,以及在衰老改变中扮演的角色,至今尚无文献报道。
CCK⁃8 实验表明,miR⁃155⁃5p 过表达的BMMSCs 细胞增殖及代谢能力受到抑制,活性降低。相反,干扰miR⁃155⁃5p 的表达,细胞增殖活性明显增强。Bmal1 过表达的BMMSCs,增殖能力显著增强,干扰BMMSCs 中Bmal1 的表达,其增殖活性降低。流式凋亡实验结果显示,过表达miR⁃155⁃5p 的BMMSCs,测得的凋亡率远高于正常培养的细胞,而过表达Bmal1 的BMMSCs,凋亡率显著降低,说明二者在影响BMMSCs 增殖、凋亡过程中的调控效应相反。研究显示,Bmal1 敲除的小鼠会出现早衰现象如毛发稀少、骨质疏松,而恢复Bmal1 的表达后,早衰现象明显缓解
,本研究的β⁃半乳糖苷酶实验验证了Bmal1 对骨衰老的抑制作用。P53 是一种序列特异性DNA 结合蛋白,参与细胞周期调控、DNA 修复、细胞凋亡和应激反应等,研究表明,衰老的启动和激活需依赖P53
。P16 基因是细胞衰老进程中的关键效应物,其蛋白是蛋白激酶⁃4(cyclin⁃dependentkinase 4,CDK4)的抑制因子,可通过p16⁃cyclin D/CDK⁃Rb 途径调控细胞周期,影响细胞寿命及端粒长度
。qRT⁃PCR 检测不同慢病毒转染后P53、P16 基因表达水平的变化,阐释了miR⁃155⁃5p 和Bmal1 对BMMSCs 衰老调控的相反作用。本实验揭示了Bmal1 及miR⁃155⁃5p 在BMMSCs中对细胞增殖、衰老的影响,增加Bmal1 的表达水平,细胞增殖活性明显增强,衰老相关基因表达下降;干扰Bmal1 的表达,细胞增殖能力减弱,衰老相关基因表达水平升高,BMMSCs 衰老特征显著,miR⁃155⁃5p 在上述过程中的效应与Bmal1 相反。结合前期研究,课题组认为miR⁃155⁃5p 可能作为Bmal1 的上游调控因子,通过影响近日节律基因Bmal1 的表达,进而调控BMMSCs 的增殖、衰老、凋亡,从而影响骨代谢。
周一,美国市场开市,中国还是假期,看到了雷曼破产,中投风控部工作人员,挨个打电话给自己的分布在全球的投资经理,尤其是帮助中投管理货币市场基金的经理,询问在他们的投资组合里,是否有雷曼的债券?果然,Primary的基金经理回复,他们资产池中有4%的仓位在雷曼债券上。该基金全称Reserve Primary Fund,在其持有人名单上,中投公司旗下的Stable Investment是最大持有人,持有份额折合市值约54亿美元。
综上所述,本实验探究了miR⁃155⁃5p 和Bmal1在小鼠BMMSCs 中对细胞增殖、凋亡和衰老的影响,结合课题组前期实验结果,推测二者可能存在相互调控机制,后续将通过动物实验进一步验证,并深入探究miR⁃155⁃5p 的上游调控因子及Bmal1下游的相关信号通路,完善miR⁃155⁃5p、Bmal1 在小鼠BMMSCs 中的调控网络,加深对骨衰老的理解。
[1] Yuan B, Li J, Zhao H, et al. Global population aging, national de⁃velopment level,and vulnerability to the pandemic[J].Risk Manag Healthc Policy,2021,14:705⁃717.doi:10.2147/RMHP.S292440.
[2] Xiao YZ,Yang M,Xiao Y,et al.Reducing hypothalamic stem cell senescence protects against aging⁃associated physiological decline[J]. Cell Metab, 2020, 31(3): 534⁃548. doi: 10.1016/j.cmet.2020.01.002.
[3] 左新慧,李君,韩祥祯,等.低氧诱导因子⁃1α 对骨髓间充质干细胞成骨分化与血管生成相关因子的影响[J].口腔疾病防治,2021,29(7):449⁃455.doi:10.12016/j.issn.2096⁃1456.2021.07.003.Zuo XH, Li J, Han XZ, et al. Effects of hypoxia inducible factor ⁃1α on osteogenic differentiation and angiogenesis related factors of bone marrow mesenchymal stem cells[J]. J Prev Treat Stomatol Dis,2021,29(7):449⁃455.doi: 10.12016/j.issn.2096⁃1456.2021.07.003.
[4] Hu H, Wang D, Li L, et al. Role of microRNA⁃335 carried by bone marrow mesenchymal stem cells⁃derived extracellular vesi⁃cles in bone fracture recovery[J].Cell Death Dis, 2021,12(2):156.doi:10.1038/s41419⁃021⁃03430⁃3.
[5] Burr DB. Changes in bone matrix properties with aging[J]. Bone,2018,120:85⁃93.doi:10.1016/j.bone.2018.10.010.
[6] Tomita T,Wadhwa R,Kaul SC,et al.Withanolide derivative 2,3⁃dihydro⁃3β⁃methoxy withaferin⁃a modulates the circadian clock
interaction with RAR⁃related orphan receptor α (RORa)[J]. J Nat Prod,2021,84(7):1882⁃1888.doi:10.1021/acs.jnatprod.0c01276.
[7] He Y, Lin F, Chen Y, et al. Overexpression of the circadian clock gene Rev⁃erbα affects murine bone mesenchymal stem cell prolif⁃eration and osteogenesis[J].Stem Cells Dev, 2015, 24(10): 1194⁃1204.doi: 10.1089/scd.2014.0437.
[8] He Y, Chen Y, Zhao Q, et al. Roles of brain and muscle ARNT⁃like 1 and Wnt antagonist Dkk1 during osteogenesis of bone mar⁃row stromal cells[J]. Cell Prolif, 2013, 46(6): 644 ⁃ 653. doi:10.1111/cpr.12075.
[9] Dexheimer PJ,Cochella L.MicroRNAs:from mechanism to organ⁃ism[J]. Front Cell Dev Biol, 2020, 8: 409. doi: 10.3389/fcell.2020.00409.
[10] Ambros V. The functions of animal microRNAs[J]. Nature. 2004,431(7006):350⁃355.doi: 10.1038/nature02871.
[11] 张成晓雪.小鼠骨髓间充质干细胞中miR⁃155⁃5p 与Bmal1 的交互作用及对Hippo通路的影响[D].成都:四川大学,2020.Zhang CXX.The interaction between miR⁃155⁃5p and Bmal1 and their influence on Hippo pathway in bone marrow stem cells of mice[D].Chengdu:Sichuan University,2020.
[12] Oryan A, Kamali A, Moshiri A, et al. Role of mesenchymal stem cells in bone regenerative medicine: what is the evidence?[J].CellsTissuesOrgans,2017,204(2):59⁃83.doi:10.1159/000469704.
[13] Tateishi K, Ando W, Higuchi C, et al. Comparison of human se⁃rum with fetal bovine serum for expansion and differentiation of human synovial MSC: potential feasibility for clinical applications[J]. Cell Transplant, 2008, 17(5): 549⁃557. doi: 10.3727/0963689 08785096024.
[14] Wang Y, Wang JW, Li Y, et al. Bone marrow⁃derived mesenchy⁃mal stem cells improve rat islet graft revascularization by upregu⁃lating ISL1[J]. Stem Cells, 2021, 39(8): 1033⁃1048. doi: 10.1002/stem.3378.
[15] Chen M, Wang F, Xia H, et al. MicroRNA⁃155: regulation of im⁃mune cells in sepsis[J]. Mediators Inflamm, 2021: 8874854. doi:10.1155/2021/8874854.
[16] Gottwein E,Mukherjee N,Sachse C,et al.A viral microRNA func⁃tions as an orthologue of cellular miR⁃155[J]. Nature, 2007, 450(7172):1096⁃1099.doi:10.1038/nature05992.
[17] Li B. MicroRNA regulation in osteogenic and adipogenic differen⁃tiation of bone mesenchymal stem cells and its application in bone regeneration[J]. Curr Stem Cell Res Ther, 2018,13(1): 26⁃30. doi:10.2174/1574888X12666170605112727.
[18] Khokhar M,Roy D,Bajpai NK,et al.Metformin mediates microR⁃NA⁃21 regulated circulating matrix metalloproteinase⁃9 in diabet⁃ic nephropathy: an in⁃silico and clinical study[J]. Arch Physiol Biochem,2021:1⁃11.doi:10.1080/13813455.2021.1922457.
[19] Ukai⁃Tadenuma M, Yamada RG, Xu H, et al. Delay in feedback repression by cryptochrome 1 is required for circadian clock func⁃tion[J]. Cell, 2011, 144(2): 268⁃281. doi: 10.1016/j.cell.2010.12.019.
[20] Lucassen EA,Coomans CP,van Putten M,et al.Environmental 24⁃hr cycles are essential for health[J].Current Biology, 2016,26(14):1843⁃1853.doi:10.1016/j.cub.2016.05.038.
[21] Redmond J, Fulford AJ, Jarjou L, et al. Diurnal rhythms of bone turnover markers in three ethnic groups[J]. J Clin Endocrinol Metab,2016,101(8):3222⁃3230.doi:10.1210/jc.2016⁃1183.
[22] Ong ALC, Ramasamy TS. Role of Sirtuin1⁃p53 regulatory axis in aging, cancer and cellular reprogramming[J]. Aging Res Rev,2018,43:64⁃80.doi:10.1016/j.arr.2018.02.004.
[23] He S, Sharpless NE. Senescence in health and disease[J]. Cell,2017,169(6):1000⁃1011.doi: 10.1016/j.cell.2017.05.015.
