脂联素介导SIRT1/PGC-1α信号通路对大鼠脑缺血损伤后的影响
2022-06-17尹晓新冯海松杨涛朝浩
尹晓新,冯海松,杨涛,朝浩
缺血性脑卒中是一类常见的缺血性脑血管病,具有较高的发病率、致残率及致死率,且发病率及病死率呈现逐年上升的趋势[1]。缺血性脑卒中是由于局部脑组织缺血、缺氧造成的脑组织血液供应不足引起的脑细胞缺血或坏死,并引起一系列神经系统症状[2]。氧化应激反应是缺血性脑卒中发生及发展过程中重要的发病机制,以往的研究表明,脂联素在脑缺血再灌注损伤中发挥着重要作用[3-4],本研究拟通过构建脑缺血损伤模型探究脂联素在脑缺血损伤中的具体作用及机制,报道如下。
1 材料与方法
1.1 实验材料 (1)实验动物:SPF级新生7日龄雄性SD大鼠60只由武汉科技大学动物实验中心提供,动物许可证号:SYXK(新)2016-003,合格证号:SCXK(新)2016-0002。全部大鼠饲养在(22±2)℃的房间内,相对湿度50%~65%。本实验经过武汉科技大学伦理委员会批准同意。(2)主要试剂:SIRT1抑制剂Sirtonol购自美国Selleck公司;氧化因子(ROS、MDA、SOD)检测试剂盒购自上海碧云天生物技术有限公司;苏木素、伊红购自武汉博士得生物有限公司;BCA蛋白定量及SDS-PAGE凝胶制备试剂盒购自赛默飞世尔科技有限公司;PGC-1α抗体购自美国Santa公司,SIRT1抗体购自美国CST公司。(3)主要仪器:切片机购自上海斯欧医疗器械有限公司;酶标仪购自美国Thermo公司;电泳仪购自美国Bio-Rad公司;凝胶成像仪购自美国Protein Simple公司。
1.2 实验方法 2019年10月—2020年12月于武汉科技大学动物实验中心进行实验。模型构建:60只大鼠采用随机数字表法分为空白对照组、模型组、脂联素组、Sirtonol组及脂联素+Sirtonol组,每组12只。模型制备方法参照文献[5],大鼠腹腔注射2.5%戊巴比妥麻醉,行颈正中切口分离右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),结扎CCA近心端,ECA和 ICA近分叉处打活结,在CCA近分叉处剪一倒“V”型切口,插入线栓,于插入线栓处用备用线结扎(以不出血为度),松开ICA处活结,缓慢推送线栓,线栓进入ICA后调整线栓头端向内向上,有阻力时停止推进,此时线栓头端正好处于大脑中动脉(MCA)起始部,造成阻断,缺血2 h后轻柔拔出线栓。空白对照组分离右侧颈总动脉但不插入线栓。脂联素组造模后30 min在大鼠的侧脑室注入APN(剂量为1 μg/g)。Sirtonol组及脂联素+Sirtonol组在模型组及脂联素组基础上给予SIRT1抑制剂Sirtonol,同样通过侧脑室注入Sirtonol(浓度剂量为2 μl/100 g)。
1.3 观测指标及方法
1.3.1 观察大鼠脑组织损害程度:造模24 h后分离各组大鼠大脑组织,常规脱水、透明、石蜡包埋,组织切片后行HE染色,显微镜下采集数据并拍照。
1.3.2 ELISA法检测氧化因子水平:造模后24 h取大脑组织并提取蛋白质,BCA定量法测定蛋白后备用。用蛋白裂解液将提取的蛋白稀释至浓度为1 mg/ml的悬液,取50 μl悬液加入反应液,酶标仪定量检测并读取相应的吸光度值,并计算出各样本的氧化因子ROS、MDA、SOD水平。
1.3.3 免疫印迹法检测SIRT1及PGC-1α蛋白表达:造模后24 h取大脑组织,裂解组织后提取总蛋白。取等量的蛋白(20 μg)用10%SDS-PAGE凝胶电泳分离,然后转至PVDF膜。用含5%脱脂牛奶的TBST封闭后,在4℃与特定的抗体(包括SIRT1及PGC-1α)一起摇床孵育过夜;次日用TBST将膜洗涤3次,并用对应的二抗孵育1 h,用TBST洗涤3次后配制ECL发光反应液,置于凝胶成像系统中观察蛋白的表达情况。

2 结 果
2.1 各组大鼠脑组织损害程度比较 与空白对照组比较,模型组脑组织损伤严重,神经元细胞排列散乱,间质有明显水肿,胞质中有空泡形成,细胞核固缩或溶解消失;与模型组比较,脂联素组脑组织损伤程度明显减轻,神经元细胞形态较规则,排列较有序,仅为轻度缺血,见图1。
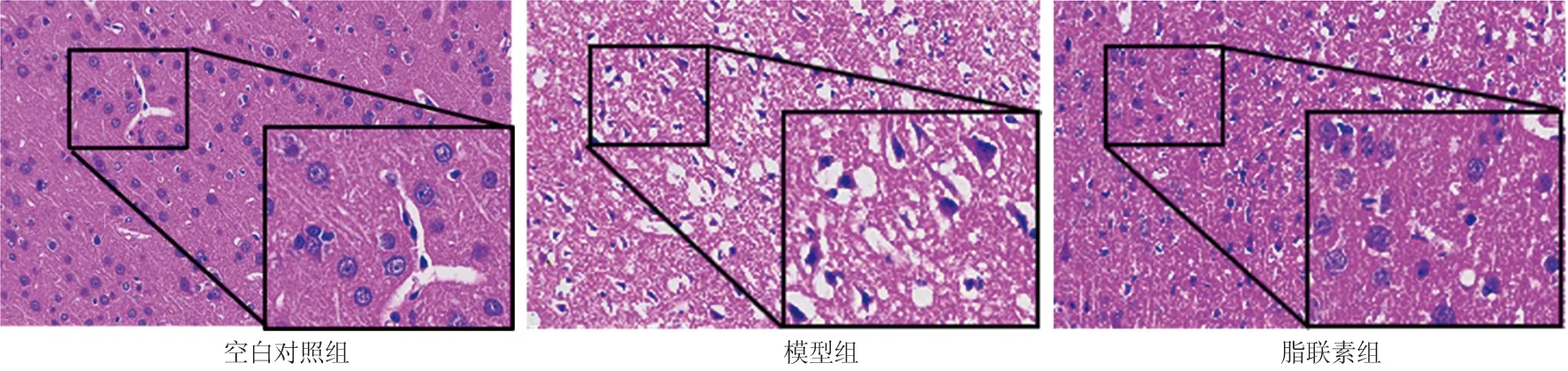
图1 各组大鼠脑组织细胞病理变化比较(HE染色,×200)
2.2 各组大鼠脑组织氧化应激指标比较 与空白对照组比较,模型组氧化因子ROS、SOD水平升高,MDA水平降低(P<0.01);与模型组比较,脂联素组大鼠氧化因子ROS、SOD水平降低,MDA水平升高(P<0.01),见表1。

表1 各组大鼠脑组织氧化应激指标比较
2.3 各组大鼠脑组织SIRT1及PGC-1α蛋白表达比较 与空白对照组比较,模型组大鼠脑组织SIRT1及PGC-1α的蛋白表达减少(t/P=22.764/<0.001、28.645/<0.001);与模型组比较,脂联素组大鼠脑组织SIRT1及PGC-1α的蛋白表达均显著增加(t/P=20.089/<0.001、27.937/<0.001),见图2。
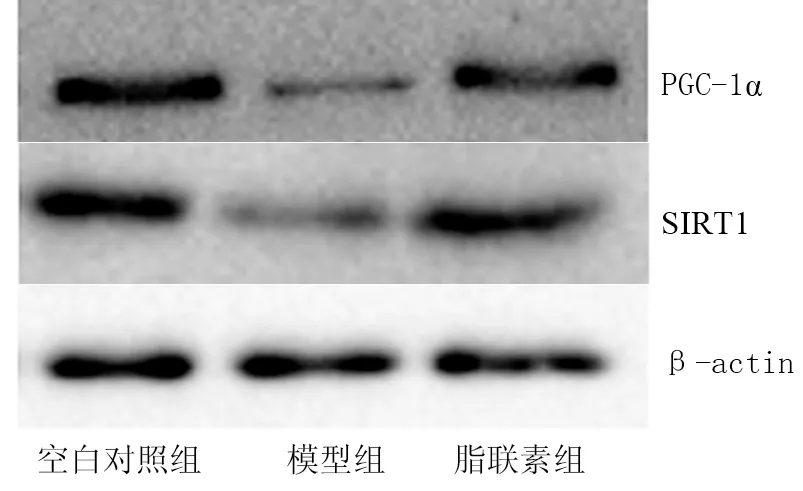
图2 各组大鼠脑组织SIRT1及PGC-1α蛋白表达的比较
2.4 脂联素通过SIRT1/PGC-1α信号通路发挥作用 为进一步确认脂联素是否通过SIRT1/PGC-1α信号通路发挥抗氧化作用,添加SIRT1抑制剂Sirtonol检测相关氧化因子的表达。与模型组比较,Sirtonol组氧化因子ROS、SOD水平升高,MDA水平降低(P<0.01);与脂联素组比较,脂联素+Sirtonol组氧化因子ROS、SOD水平升高,MDA水平降低(P<0.01),见表2。

表2 各组大鼠脑组织氧化应激指标比较
3 讨 论
缺血性脑卒中是由于脑动脉狭窄或阻塞导致供血脑组织缺血坏死引起神经系统功能障碍的一类脑血管疾病。在缺血过程中各种病理机制相互关联、彼此交错,氧化应激损伤贯穿于整个过程[6]。脑组织缺血损伤后过量的氧自由基不能被清除,氧化还原的动态平衡被打破[7]。因此采取及时有效的措施阻止氧化应激反应的发生成为治疗缺血性脑卒中的关键。本研究通过线栓栓塞颈动脉方法构建了缺血性脑卒中模型,探讨了脂联素在脑缺血损伤中的作用并初步探讨其作用机制。
脂联素是由脂肪细胞分泌的一种激素蛋白,是脂肪组织中表达最丰富的基因[8]。已有研究表明,脂联素能够提高外周组织对胰岛素的敏感性,具有抗动脉粥样硬化及抗糖尿病的作用。此外有很多证据表明,脂联素在脑缺血再灌注损伤中发挥着重要作用[3-4]。由于脂联素的分子量大很难通过血脑屏障,即使通过了血脑屏障在脑组织中的浓度也很低,很难发挥作用[9]。本研究拟通过侧脑室注射脂联素的方式探讨脂联素在脑缺血损伤中的作用,结果显示,与模型组比较,脂联素组脑细胞排列较均匀,坏死脑细胞较前减少,提示脂联素具有减轻缺血性脑卒中大鼠脑组织损伤程度的作用。脂联素除了具有胰岛素增敏、抗炎、抗凋亡作用外,还能通过抑制氧化应激诱导的自噬相关通路提高心肌的抗氧化损伤,提高线粒体的生物合成功能,改善高糖高脂诱导的氧化应激损伤[10-13]。本研究结果显示,与空白对照组比较,模型组氧化因子ROS、SOD水平升高,MDA水平降低,而在给予脂联素干预后氧化因子ROS、SOD水平降低,MDA水平升高,可知脂联素具有抗氧化应激损伤作用。缺血性脑卒中组织产生ROS的能力增加而清除ROS的能力下降,组织中这种动态平衡被打破导致大量的ROS在组织内蓄积,最终导致细胞的氧化应激损伤[14-16]。MDA是自由基作用下脂质过氧化的终产物,其水平反映了脂质过氧化及细胞的损伤程度[17-18]。SOD是一种内源性的抗氧化酶,可对抗氧自由基对细胞的损伤,是评价氧化应激损伤的另一重要指标。有研究显示,脂联素多肽能够减轻谷氨酸盐处理的HT22细胞的氧化应激损伤[19],这与本研究结果相符,表明脂联素具有抗氧化应激损伤的作用。
此外,本研究中发现模型组大鼠脑组织SIRT1及PGC-1α的蛋白表达减少,而在给予脂联素干预后大鼠脑组织SIRT1及PGC-1α的蛋白表达增加,表明脂联素在缺血性脑卒中大鼠脑组织中有助于上调SIRT1及PGC-1α的蛋白表达。SIRT1属于sirtuin家族,是一种依赖于烟酰胺去嘌呤二核苷酸的去乙酰化酶,在心、脑等组织中表达增加,因其在氧化应激方面的作用而受到广泛关注[20]。miR-29c通过调控SIRT1表达影响动脉粥样硬化进程中的氧化应激反应[21];SIRT1还能通过影响ROS的产生及抗氧化酶的活性从而调节阿尔茨海默病的大脑应激损伤[22]。PGC-1α是SIRT1的下游蛋白,通过增强线粒体的生物合成功能增加组织的氧化代谢。在缺血性脑卒中发生后SIRT1及PGC-1α的蛋白表达水平减少,提示脑组织中氧化及抗氧化功能失衡,从而导致ROS、SOD水平升高,MDA水平降低,进而引发脑组织的功能障碍[1]。因此缺血性脑卒中通过增加SIRT1/PGC-1α表达进而影响ROS、SOD及MDA的活性,增强脑组织的抗氧化能力,减轻氧化应激引起的脑组织损伤。本研究为了进一步确认脂联素是否通过SIRT1/PGC-1α信号通路发挥抗氧化作用,为此添加SIRT1抑制剂Sirtonol检测相关氧化因子的表达。与脂联素组比较,脂联素+Sirtonol组阻断了脂联素对脑组织的抗氧化作用。这些研究结果提示,脂联素通过调节SIRT1/PGC-1α蛋白表达影响氧化因子水平进而发挥抗氧化应激损伤的作用。
综上所述,脂联素减轻缺血性脑卒中大鼠的氧化应激损伤主要是通过调节SIRT1及PGC-1α的蛋白表达来实现的,为临床治疗缺血性脑卒中患者氧化应激损伤提供了理论支持,但脂联素不能通过血脑屏障限制其在临床的进一步推广,其在临床的应用价值还需进一步的探讨。
利益冲突:所有作者声明无利益冲突
作者贡献声明
尹晓新:课题设计及文章撰写;冯海松:数据获取及统计分析;杨涛:收集资料及论文修改;朝浩:课题指导
