H3N8亚型马流感病毒样颗粒的免疫防治效果评价
2022-06-17于海英孙艺学秦佳仪张鹏举丛彦龙
于海英,孙艺学,秦佳仪,王 玮,张鹏举,丛彦龙*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.长春大学 吉林省生物医学工程研发中心,吉林 长春 130022; 3.吉林省农业科学院 动物生物技术研究所,吉林 长春 130033)
马流感是由正黏病毒科α流感病毒属的A型流感病毒引起马属动物的一种常见呼吸系统传染病[1],是OIE法定报告动物疫病之一。该病传播迅速,在欧洲、北美洲、南美洲、大洋洲、亚洲、非洲等30多个国家均有报道[2],表现出全球性流行趋势,发病率接近100%,病死率为2%[3]。近年来,随着马术赛事等相关行业的蓬勃发展以及养马业的逐渐兴起,马流感的公共安全问题得到了广泛关注。
马流感病毒(equine influenza virus,EIV)包括H7N7和H3N8 2个血清亚型,分别于1956年在捷克布拉格[4]和1963年在美国迈阿密[5]首次分离或报道。自20世纪70年代末以来,H7N7亚型EIV已经在马群中消失,而流行于世界各国马群中的主要是H3N8亚型EIV[6]。在系统发育进化树上,H3N8 EIV分化出欧亚谱系和美洲谱系。欧亚谱系毒株在2007年后几近消失[7];而美洲谱系演化出Florida、Kentucky和South America 3个亚系。其中,Florida亚系又进一步分化出2个具有明显抗原差异的进化分支[8]。基于全球的EIV流行病学数据,OIE建议自2010年起,马流感疫苗应当包括Florida 2个分支的毒株[9]。疫苗接种是限制H3N8 EIV感染的最有效措施[10]。目前,已有多种市售马流感疫苗,包括灭活疫苗、亚单位疫苗、冷适应株减毒活疫苗和金丝雀痘病毒活载体重组疫苗[2,9-11]。
病毒样颗粒(virus-like particles,VLPs)是一种由病毒结构蛋白组装而成的纳米级多聚蛋白复合体。它不含有任何遗传物质,其形态、大小类似天然病毒粒子,具有稳定的结构。绝大多数VLPs都含有功能性的病毒膜蛋白或糖蛋白,可以被树突状细胞等抗原递呈细胞优先加工递呈,进而有效激活免疫应答[12-14]。由于缺乏感染性核酸,无复制和感染能力,因此VLPs已经成为亚单位疫苗的一种理想形式。相比于传统灭活疫苗,VLP疫苗具有更好的免疫原性;而相对于弱毒疫苗,VLP疫苗则具有良好的安全性。此外,VLPs比常规的亚单位或者重组蛋白具有更好的免疫原性,能够同时激发机体的体液免疫和细胞免疫。与此同时,VLPs具有自体佐剂功效,无需添加佐剂即可刺激有效的免疫应答[13,15]。目前,世界上已经有4种VLP疫苗获得批准生产,分别是乙肝疫苗、多价人乳头瘤病毒疫苗、H1N1流感病毒疫苗以及猪圆环病毒2型疫苗[13]。我国的戊型肝炎VLP疫苗也于2012年10月27日正式上市,由此显示出VLPs作为疫苗的广阔应用前景。
流感病毒M1蛋白是形成病毒粒子的主要驱动力,而HA和NA是A型流感病毒的主要保护性蛋白,因此常见的流感VLPs通常包含M1、HA和/或NA蛋白[14]。到目前为止,组装VLPs的系统主要有细菌、酵母、哺乳动物细胞、植物和昆虫细胞-杆状病毒等表达系统。其中,昆虫细胞-杆状病毒表达系统具有生长快,可以大规模培养,翻译后修饰功能与哺乳动物细胞类似,有利于VLPs的正确包装,安全性好等优势,因而被广泛用于VLPs的实验室研究和工业化规模生产。以昆虫细胞-杆状病毒表达系统制备有囊膜的VLPs已经成为当前的主流技术[16]。在本研究,利用昆虫细胞-杆状病毒表达系统包装出含有H3N8亚型EIV毒株的HA、NA和M1蛋白的VLPs,并且以VLPs作为免疫原免疫马匹,以小鼠模型评价马抗H3N8亚型EIV高免血清的预防和治疗效果,以期为研制H3N8亚型马流感VLP疫苗提供技术和数据支撑。
1 材料与方法
1.1 重组杆状病毒的制备与鉴定在Madin-Darby犬肾(MDCK)细胞中制备A/equine/China/JL126/2018 (H3N8)(MW264992)病毒储液。利用表1所列的基因特异性引物通过RT-PCR扩增病毒的HA、NA和M1基因。然后,根据文献[17]所报道的方法进行重组杆状病毒的制备。具体步骤简述如下:将扩增的基因与pFastBac1于25℃连接30 min。将连接产物转化至E.coliDH5α中,分别提取HA、NA和M1重组穿梭质粒。将重组穿梭质粒转化至E.coliDH10Bac,通过蓝白斑筛选获得3种重组杆粒。以2 μg的剂量将3种重组杆粒分别溶解于100 μL无血清昆虫培养基Sf-900ⅡSFM(Gibco,USA),加入8 μL X-treme GENE HP DNA Transfection Reagent(Roche,USA),充分混匀后室温放置20 min,然后缓缓滴加至70%贴壁率的Sf9细胞中,27℃培养4 d后,获取第1代重组杆状病毒,盲传至第4代(p4),将P4代杆状病毒分别命名为rBV-HA、rBV-NA和rBV-M1。

表1 H3N8亚型EIV基因扩增引物
将P1代重组杆状病毒以1%浓度感染贴壁的Sf9细胞,27℃培养72 h,显微镜观察细胞病变情况。取P4代杆状病毒感染后的细胞上清进行Western blot分析,一抗采用本研究室制备的抗H3N8亚型EIV鸡高免血清(1∶500),4℃孵育过夜后加入HRP标记的羊抗鸡酶标二抗(1∶5 000),期间以PBST清洗3次,室温孵育1 h后通过ECL显色观察。
1.2 VLPs的组装与鉴定将rBV-HA、rBV-NA、rBV-M1分别以MOI=5同时接种2×106个/mL的Sf9悬浮细胞,于27℃ 120 r/min培养4 d。将收集的培养上清经4℃ 3 500 r/min离心20 min以去除细胞及其碎片;上清经4℃ 30 000 r/min离心1 h,弃上清,将沉淀用pH 7.2的PBS重悬并溶解过夜;将1 mL沉淀悬液加入至60%蔗糖与30%蔗糖的梯度中,24 000 r/min离心1.5 h,吸取白色云雾层经去蔗糖处理后于-80℃保存备用。取纯化后的VLPs利用血凝试验[18]鉴定其血凝活性,并通过Western blot分析VLPs的蛋白组分[19]。同时,利用免疫电镜观察VLPs的形态特征。具体步骤为:将纯化的VLPs滴置于封口膜表面,取铜网正面吸附样品,静置3 min,用滤纸从侧面吸干后,以点滴方式在铜网表面加入1∶100稀释倍数的鸡高免血清,室温孵育1 h后吸去溶液并用PBS清洗3次,每次5 min;以点滴方式在铜网表面加入1∶50稀释倍数的胶体金标记二抗,室温孵育1 h,同样吸去溶液后用PBS清洗1次,在80 kV,4万倍视野下经透射电镜扫描观察VLPs的形态特征。
1.3 马高免血清的制备将VLPs稀释后,按照佐剂∶VLPs=1∶2~1∶3的比例加入弗氏完全佐剂进行乳化以制备免疫原。选择2匹4~6岁马匹进行背部皮下多点免疫,共免疫5次,每次间隔7~14 d。第1,7,14,28和42天注射免疫原的剂量依次为0.5,1.5,2.0,3.0和5.0 mg/匹。当HI抗体效价达1∶2 560以上时,按16 mL/kg采血,无菌制备高免血清。
1.4 马高免血清的预防效果评价为了验证马高免血清对H3N8亚型EIV的预防效果,将6~8周龄BALB/c小鼠随机分成7组,分别为病毒对照组、正常对照组、高剂量早期组、高剂量中期组、高剂量晚期组、中剂量组、低剂量组。高、中、低剂量预防组分别按0.4,0.2,0.1 mL/只经小鼠腹腔注射高免血清进行预防。其中,高剂量早期组在攻毒前8 d注射血清,高剂量中期组在攻毒前4 d注射血清,高剂量晚期以及中剂量、低剂量各组均在攻毒前1 d注射血清,全程仅注射1次。病毒对照组与正常对照组均在攻毒前1天腹腔注射无菌生理盐水,0.2 mL/只。采用氯胺酮和甲苯噻嗪麻醉后以滴鼻方式进行攻毒,攻毒剂量为106TCID50。攻毒当天记为第0天,攻毒后连续观察14 d,每天记录小鼠精神状态、活动能力、体质量变化等指标。攻毒后第14天后测定小鼠肺指数。简言之,每组小鼠在麻醉后被安乐死并称重。采集其肺脏,经PBS洗涤后,用滤纸吸干水分后称重。根据文献[20]的方法计算作为肺部水肿指标的肺指数,其计算公式为:肺指数=(肺质量/体质量)×100%。将试验结果合并以GraphPad Prism v8.0.2.263统计软件进行统计分析。
1.5 马高免血清的治疗效果评价为了评价马高免血清对H3N8亚型EIV的治疗效果,将6~8周龄BALB/c小鼠随机分成12组,分别为病毒对照组、正常对照组、高剂量早期组、高剂量中期组、高剂量晚期组、中剂量早期组、中剂量中期组、中剂量晚期组、低剂量早期组、低剂量中期组、低剂量晚期组及达菲治疗组。除正常对照组外,每只小鼠攻毒剂量均为106TCID50,攻毒后开始治疗。其中,早期组、中期组及晚期组分别在攻毒后24,48和72 h注射血清,高、中、低剂量治疗组分别按0.8,0.4和0.2 mL/只注射血清,全程仅注射1次;达菲治疗组在攻毒后24 h开始给药,每天0.2 mg/只,连续给药7 d;病毒对照组与正常对照组均在攻毒后24 h腹腔注射无菌生理盐水,0.2 mL/只。攻毒当天记为第0天。攻毒后第7天将采集的小鼠肺脏研磨后接种MDCK细胞,72 h后收集细胞上清利用血凝实验测定肺脏的病毒感染滴度。
2 结果
2.1 重组杆状病毒的鉴定将重组杆状病毒rBV-HA、rBV-NA和rBV-M1分别感染Sf9细胞,27℃培养72 h后,观察细胞的病变情况。如图1A可见,与正常细胞相比,感染重组杆状病毒的细胞出现细胞变大、变圆,增殖明显变慢甚至不增殖,细胞发生脱落、裂解等病变现象。取重组杆状病毒感染后的细胞上清经Western blot鉴定分析目的蛋白的表达情况。如图1B所示,HA、NA和M1蛋白条带分别约为65,55和26 kDa,均与预期大小相符,说明所构建的重组杆状病毒感染的Sf9细胞中有H3N8病毒蛋白的表达。

A.重组杆状病毒感染后Sf9细胞病变效应;B.重组杆状病毒目的蛋白Western blot鉴定结果
2.2 VLPs的鉴定将rBV-HA、rBV-NA、rBV-M1分别以MOI=5接种悬浮Sf9细胞,于27℃ 120 r/min培养4 d。对收集的培养上清进行超速离心纯化,并利用血凝试验、Western blot和免疫透射电镜分别鉴定VLPs的血凝活性、目的蛋白的表达情况以及VLPs的形态结构。如图2A所示,纯化后的VLPs的血凝效价可达9log2,表明HA蛋白已经展示于VLPs表面。Western blot所检测到的HA、NA和M1蛋白条带也均与预期大小相符,说明HA、NA和M1蛋白利用杆状病毒表达后成功组装成了VLPs(图2B)。在透射电镜下,可见VLPs形态为椭球形,直径约为100 nm,且表面附有胶体金标记的糖蛋白纤突(图2C)。
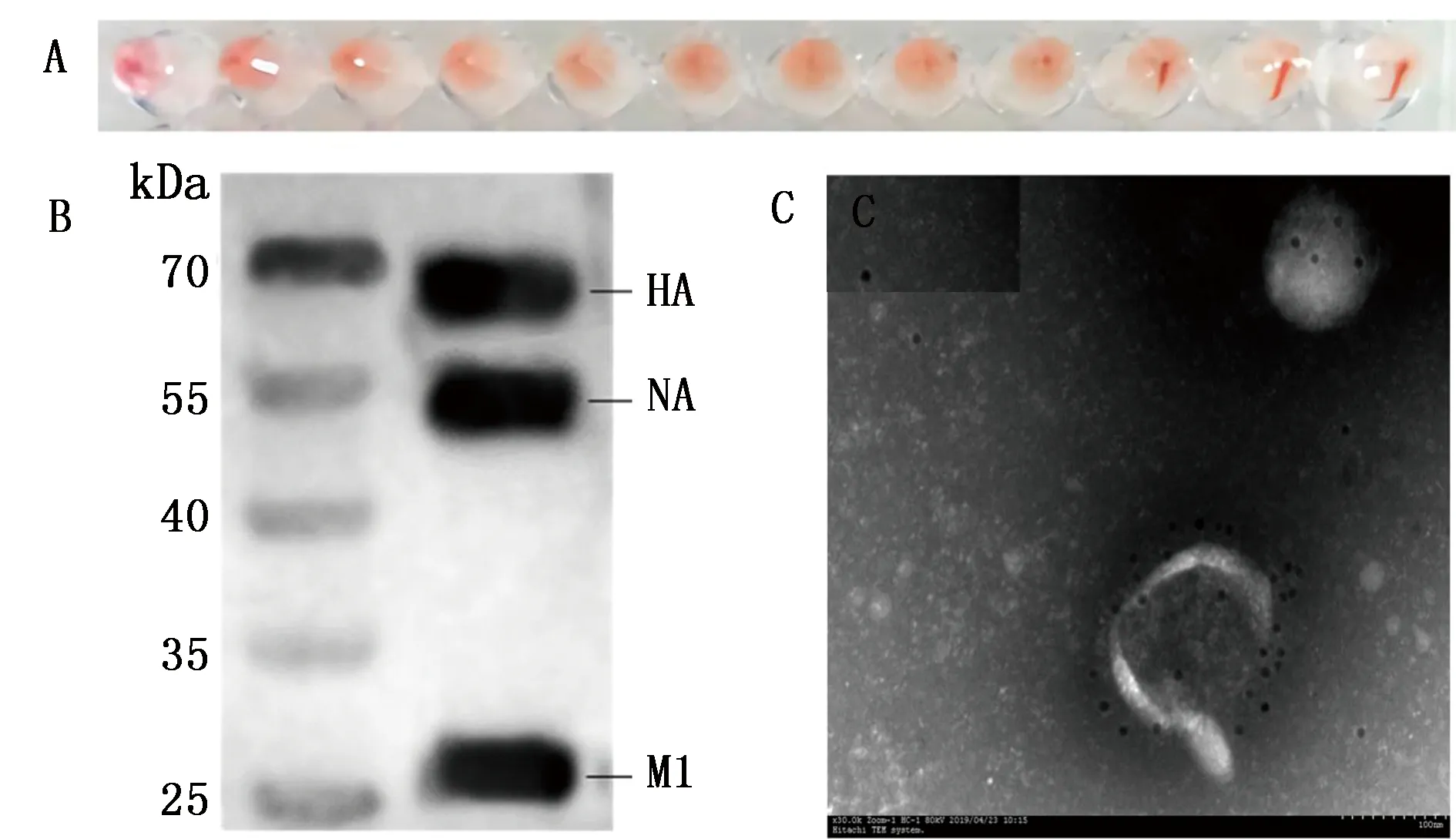
A.VLPs血凝试验结果;B.VLPs中HA、NA、M1蛋白的Western blot鉴定结果;C.免疫电镜下VLPs的形态
2.3 马高免血清HI抗体滴度将VLPs免疫马匹后,分别在免疫后第7,14,28,42和56天收集马匹血清,利用血凝抑制试验测定血清中的HI抗体效价。由图3可知,随着免疫次数的增加,至免疫后第56天,HI抗体效价可达1∶2 560以上,达到了预期免疫效果。

图3 H3N8 VLPs免疫马匹后血清中HI抗体效价
2.4 马高免血清对试验感染小鼠的预防效果评价为了鉴定所制备的马高免血清抵御EIV感染的能力,在给小鼠注射不同剂量的高免血清后于不同时间点进行攻毒试验,通过观察小鼠发病和肺脏指数来评价高免血清的预防效果。由表2结果可知,高剂量中期组、高剂量晚期组和中剂量组小鼠的发病率为0。病毒对照组在攻毒后第3天小鼠开始出现发病状况,至攻毒后第5天病毒对照组小鼠全部发病。高剂量早期组和低剂量组小鼠分别在攻毒后第9和7天开始出现发病状况。至攻毒后第14天,高剂量早期组有2只小鼠发病,低剂量组共有4只小鼠发病。

表2 血清预防试验各组小鼠病毒感染后不同时间的发病情况(发病数/动物总数)
采集各组小鼠的肺脏进行组间平均肺指数差异比较。由表3可知,各组小鼠的肺指数从大到小依次为病毒对照组>低剂量组>高剂量早期组>高剂量中期组>中剂量组>高剂量晚期组>正常对照组。将各试验组的肺指数与病毒对照组肺指数进行两两方差分析,结果具有统计学意义(P<0.01)。结合血清预防组小鼠的发病状况及其小鼠肺指数的组间差异,各试验组的预防效果依次为高剂量晚期组、中剂量组和高剂量中期组。

表3 血清预防试验各组小鼠肺指数
2.5 马高免血清对试验感染小鼠的治疗效果评价为了评价所制备的马高免血清对EIV感染的治疗效果,在给小鼠攻毒后于不同时间注射不同剂量的高免血清,攻毒后第7天将各组小鼠肺脏研磨后接种MDCK细胞以测定肺脏病毒感染滴度。由表4可知,低剂量晚期组小鼠的病毒检出率为33.3%,平均病毒滴度为2.4log2,其他血清治疗组的小鼠肺脏没有引起细胞病变,而达菲治疗组病毒检出率为83.3%,平均病毒滴度为4.5log2。

表4 血清治疗试验小鼠肺脏病毒检出情况
3 讨论
马流感已经成为威胁养马业及相关产业发展的最重要的传染病之一[21]。疫苗接种是预控马匹急性呼吸道感染的最有效方法,许多马术当局和进口国都实施了对马匹急性呼吸道传染病的强制性疫苗接种[22]。目前,商业化的马流感疫苗主要是传统的灭活疫苗[23-25]和减毒疫苗[26-27]。但是,灭活疫苗诱导的免疫应答与病毒自然感染诱导的应答存在一定差异,这表明灭活疫苗的设计还需要改进。虽然减毒疫苗在免疫后可以模拟自然感染,可以诱导体液、细胞和黏膜免疫反应,达到优异的保护效果,但是减毒疫苗存在安全性问题。此外,疫苗效力取决于疫苗种毒和流行毒株之间的抗原匹配性。抗原漂移是疫苗接种失败的重要原因之一,解决这个问题的有效途径就是要定期更新疫苗种毒。然而,流感疫苗的更新过程可能需要数年时间,并且成本较高。所以,选择合适的疫苗类型是降低疫苗更新周期的考虑因素之一。目前,只有非复制性金丝雀痘病毒活载体重组马流感疫苗可以及时更新[28]。但是,病毒载体疫苗也存在一些缺点,即载体对特异性免疫的干扰。因此,开发绿色、安全、高效、可以适时更新的疫苗是当前疫苗研发的重要考虑要点。
鉴于VLPs具有和天然病毒相同的构象,能够通过和病毒感染同样的途径递呈给免疫细胞,诱导机体产生和病毒感染相同强度和类型的免疫保护反应,使当前VLPs的研究已经广泛应用于各种疾病疫苗制备[29]。本研究利用昆虫细胞-杆状病毒表达系统包装出含有H3N8亚型EIV的HA、NA和M1蛋白的VLPs,经电镜观察,所构建的VLPs具有与天然病毒粒子相似的形态和大小,并且具有血凝活性。将纯化VLPs免疫马匹,获得了马源高免血清,并利用小鼠模型,探讨了马高免血清对H3N8马流感的预防和治疗效果。虽然由于给药时间和剂量的不同,防治效果达不到100%,但是VLPs免疫马高免血清确实起到了中和病毒的作用。这表明本研究所制备的H3N8 VLPs不仅具有良好的免疫原性,而且防治效果良好。因此,本研究充分说明了研制马流感VLP疫苗是切实可行的。
然而,本研究还处于初步阶段。首先,在制备马高免血清过程中,本研究的免疫次数过于密集;其次,尽管弗氏佐剂能够有效刺激细胞介导的免疫应答,并增强辅助T细胞功能[30],但是由于其副作用较大,不适合实际疫苗的开发;再者,用来制备VLPs的EIV毒株不属于OIE推荐的两个Florida EIV分支。今后,还需充分考虑这些因素。不过,已经走上了开发马流感VLP疫苗的正确道路。
