基于生物信息学结合实验验证的常春藤皂苷元抗肝癌机制研究
2022-06-17崔文超刘明远关宝生田亚妮邓仲修
崔文超,刘明远,关宝生,曾 佳,田亚妮,邓仲修,白 雪*
1.佳木斯大学基础医学院,黑龙江 佳木斯 154007
2.佳木斯大学公共卫生学院,黑龙江 佳木斯 154007
肝癌是世界上最常见的癌症之一,其死亡原因大多以转移为主[1]。肝癌的主要危险因素是慢性乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)感染,且由于肝癌复发率较高,患者的生存率普遍很低[2-3]。因此,探寻一种针对肝癌行之有效的治疗药物至关重要。常春藤皂苷元(hederagenin,HD)最初主要从五加科常春藤属植物中华常春藤Hedera nepalensisK.Koch var.sinensis(Tobl.) Rehd.中提取出来。研究显示,HD在体外和体内具有抗癌[4]、抗炎[5]和抗动脉硬化[6]的活性。本课题组多年来一直致力于HD的抗肝癌作用研究,前期研究显示,HD通过线粒体途径和死亡受体途径在体内发挥抗肝癌作用[7]。因此,在前期工作基础上,本研究应用生物信息学与实验相结合的方法,进一步分析常春藤皂苷元抗肝癌的作用机制。
1 材料
1.1 细胞株
人肝癌HepG2细胞购自中国医学科学院肿瘤研究所细胞库。
1.2 药品与试剂
HD(批号465-99-6,质量分数为99%)购自成都瑞芬思生物技术有限公司;DMEM培养基(批号2203194)购自美国Gibco公司;胰蛋白酶(批号C0201-100 mL)、Western及IP细胞裂解液(批号P0013)和RIPA强裂解液(批号P0013B)购自上海碧云天生物技术有限公司;胎牛血清(批号20120703)购自浙江天杭生物科技股份有限公司;PVDF膜(批号46273700)购自西格玛奥德里奇(上海)贸易有限公司;BCA试剂盒(批号MA0082-2-Aug-20G)、ECL发光液(批号MA0186-Apr-29G)、MTT细胞增殖及细胞毒性试剂盒(批号MB4698-1)购自大连美仑生物技术有限公司;白细胞介素-6(interleukin-6,IL-6)抗体(批号WL02841)、细胞分裂周期蛋白 25A(cell division cycle 25A,CDC25A)抗体(批号WL04650)、CDC25B抗体(批号WL02958)、雌激素受体1(estrogen receptor 1,ESR1)抗体(批号WL00940)、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)抗体(批号WL01750)、雄性激素受体(androgen receptor,AR)抗体(批号WL00223)购自万类生物科技有限公司;β-actin抗体(批号AC-15)、HRP标记的羊抗兔二抗(批号BA1039)购自武汉博士德生物工程有限公司。
1.3 仪器
全自动多功能酶标仪(美国伯腾仪器有限公司),电泳仪(德国Biometra公司);激光近红外成像仪(美国Azure Biosystems公司);5804R型多功能离心机(德国Eppendorf公司);CO2细胞恒温培养箱(赛默飞世尔科技有限公司)。
2 方法
2.1 生物信息学分析
2.1.1 鉴定HD/肝癌交集基因 通过UCSC Xena网站获取肝癌患者的高通量RNA-seq数据,基因表达谱通过归一化和基于log2转化进行定量。之后,通过R软件中的“Limma”包对肝癌高通量RNAseq数据进行差异基因筛选。差异基因筛选标准:log2转换倍数变化(FC)的绝对值≥1且校正后的P值(Padj)<0.05。通过SwissTargetPrediction数据库检索HD作用靶点,对肝癌差异基因和HD作用靶点进行比对,以获得二者的交集基因。最后使用Uniprot数据库中的审查(Swiss-Prot)确定最终候选的交集基因。
2.1.2 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)的构建及其核心基因分析 使用String数据库下载HD/肝癌交集基因的PPI数据,后将数据以txt文档格式输入Cytoscape_3.9.0软件中,使用Cytoscape_3.9.0软件中的Cytohubba插件根据节点度值大小筛选前8个核心基因。
2.1.3 分子对接 通过PubChem数据库获取HD的分子结构,PDB数据库获取IL-6、CDC25A和PTGS2蛋白的3D结构,使用ChemBioOffice软件中的ChemBio3D绘图模块对HD药物结构进行力场优化,使用Autodock Vina软件的辅助工具MGLTools 1.5.6对IL-6、CDC25A和PTGS2蛋白进行处理和氢化,将原始的蛋白pdb文件格式转换为Autodock Vina程序认可的pdbqt格式。此外,通过Autodock Vina软件中的网格盒功能,在合理设置对接参数的情况下,根据均方根差(root-mean-square deviation,RMSD)筛选最佳HD结合位点。Pymol软件绘制HD与IL-6、CDC25A和PTGS2蛋白的结合位点。
2.2 实验验证
2.2.1 HD对HepG2细胞增殖的影响 将HepG2细胞以5000个/孔接种至96孔板中,在培养箱中培养24 h后,分别给予30、60、120 μg/mL的HD处理HepG2细胞24、48 h,对照组加入不含药物的培养基。每孔加入20 μL MTT(5 mg/mL),于37 ℃继续孵育4 h;加入150 μL二甲基亚砜终止孵育,使用酶标仪测定各孔在570 nm处的吸光度(A)值。
2.2.2 HD对HepG2细胞形态的影响 在6孔板内放入细胞爬片,将HepG2细胞以5×105个/mL接种至6孔板中,在细胞培养箱中孵育,待细胞融合度达到80%以上,分别给予30、60、120 μg/mL的HD处理24 h,干预24 h后取出爬片,固定后进行苏木素-伊红(HE)染色,于光学显微镜下观察并拍照。
2.2.3 Western blotting法检测CDC25A、CDC25B、IL6、AR、ESR1和PTGS2蛋白表达
(1)HD对HepG2细胞CDC25A、CDC25B、IL-6、AR、ESR1和PTGS2蛋白表达的影响 收集HD干预24 h后HepG2细胞,加入Western及IP细胞裂解液提取总蛋白,使用BCA试剂盒检测蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶封闭后,加入一抗,4 ℃孵育过夜;加入二抗,37 ℃孵育1.5 h,使用ECL化学发光试剂盒显影,采用Image J软件进行分析。
(2)HD对H22荷瘤小鼠瘤体组织CDC25A、CDC25B、IL-6、AR、ESR1和PTGS2蛋白表达的影响 取本课题组前期研究[7]中对照组、环磷酰胺(25 mg/kg)组和HD(100、200、400 mg/kg)组的H22荷瘤小鼠瘤体组织,剪碎后加入RIPA强裂解液提取总蛋白。采用Western blotting法检测瘤体组织CDC25A、CDC25B、IL-6、AR、ESR1和PTGS2蛋白表达情况。
2.3 统计分析
采用R软件和GraphPad Prism 8.0软件(GraphPad Software Inc)进行绘图和分析,实验结果以表示,两组独立样本采用t检验分析,多组样本采用One-away ANOVA分析。
3 结果
3.1 生物信息学分析
3.1.1 HD/肝癌交集基因的鉴定 如图1-A所示,通过R软件“Limma”包筛选得到了6962个肝癌相关的差异基因。如图 1-B 所示,经SwissTargetPrediction数据库中预测发现75个HD的潜在作用靶点。如图1-C所示,对2个基因集进行比较,发现了29个HD/肝癌交集基因。

图1 HD/肝癌交集基因的鉴定Fig.1 Identification of HD/hepatocellular carcinoma crossover genes
3.1.2 PPI网络构建及核心基因分析 如图2-A所示,使用String数据库构建了HD/肝癌交集基因的PPI网络。如图2-B所示,通过使用Cytoscape_3.9.0软件中的Cytohubba插件筛选了PPI网络中前8个核心基因,分别为AR、ESR1、PTGS2、IL-6、孕酮受体(progesterone receptor,PGR)、性激素结合球蛋白(sex hormone-binding globulin,SHBG)、细胞色素P450酶17A1(cytochrome p450 family 17A1,CYP17A1)和CYP19A1。
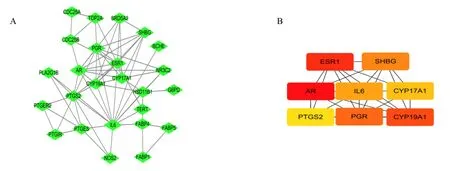
图2 HD/肝癌交集基因PPI网络图中核心基因的鉴定Fig.2 Identification of core genes in PPI network of HD/hepatocellular carcinoma crossover genes
3.1.3 分子对接 采用分子对接预测了HD与IL-6、CDC25A和PTGS2蛋白的结合位点。如图3所示,HD分别与IL-6蛋白上65号位的LYS氨基酸残基、CDC25A蛋白379号位PHE氨基酸残基、PTGS2蛋白34号与133号ASN和ASP氨基酸残基形成氢键。

图3 HD与IL-6 (A)、CDC25A (B) 和PTGS2 (C) 蛋白的结合位点Fig.3 Binding sites of HD with IL-6 (A), CDC25A (B) and PTGS2 (C) proteins
3.2 实验验证
3.2.1 HD对HepG2细胞增殖的抑制作用 本课题组前期通过Hoechst 33342荧光单染、AO/EB荧光双染和Annexin V-FITC染色已证实HD诱导HepG2细胞的凋亡[7]。本研究通过使用MTT法检测不同质量浓度(30、60、120 μg/mL)HD干预后HepG2细胞的增殖情况,如图4-A所示,与对照组(0 μg/mL)相比,各给药组细胞活力显著降低(P<0.05、0.01),且呈剂量和时间相关性。使用HE染色法检测不同质量浓度(30、60、120 μg/mL)HD干预后HepG2细胞的形态变化,如图4-B所示,与对照组相比,HD组细胞密度呈降低趋势,细胞膜与核膜出现皱缩。
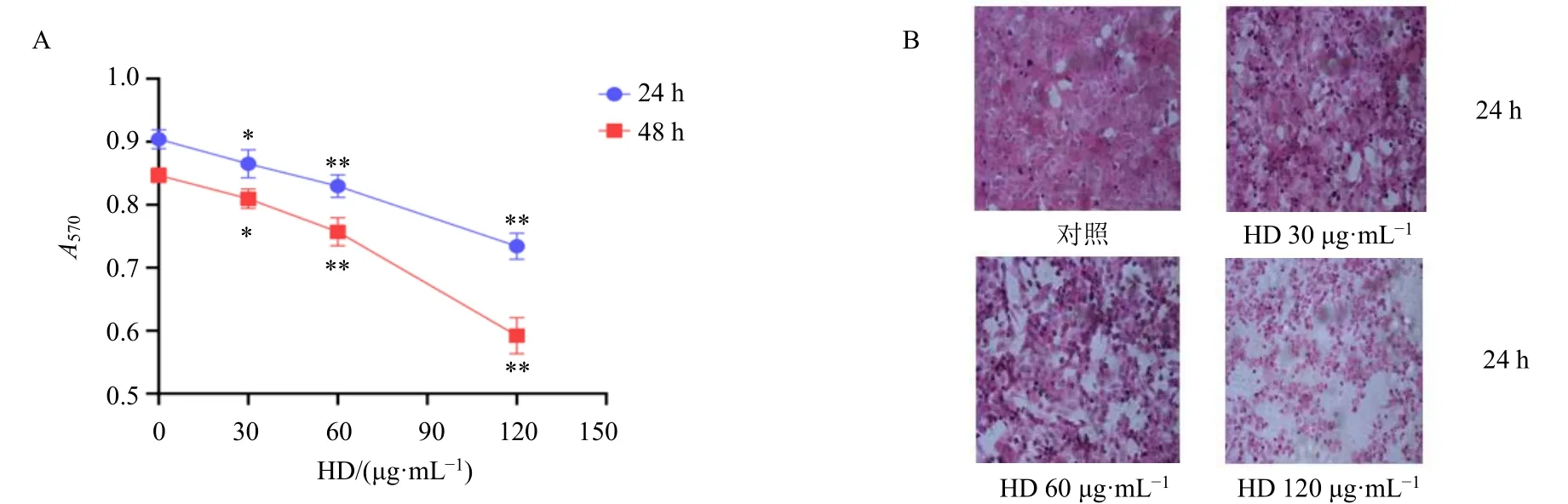
图4 HD对HepG2细胞增殖 (A) 和细胞形态 (B) 的影响 (HE, ×200)Fig.4 Effect of HD on proliferation (A) and morphology of HepG2 cells (HE, × 200)
3.2.2 HD对HepG2细胞IL-6、CDC25A、PTGS2、AR、CDC25B和ESR1蛋白表达的影响 通过对HD/肝癌交集基因的PPI网络进行分析,确定IL-6、AR、ESR1和PTGS2为核心靶点。同时,细胞周期调控因子CDC25A和CDC25B在HD/肝癌交集基因中,考虑到它们的重要性,本研究将其纳入分析,推测HD可能通过作用于IL-6、CDC25A、PTGS2、AR、CDC25B和ESR1,从而发挥抗肝癌的作用。为了证实分析的正确性,通过体外培养HepG2细胞,应用Western blotting法检测HD(30、60、120 μg/mL)干预后HepG2细胞内IL-6、CDC25A、PTGS2、AR、CDC25B和ESR1蛋白表达情况。如图5所示,与对照组比较,各给药组HepG2细胞IL-6、CDC25A、ESR1和PTGS2蛋白表达水平均显著降低(P<0.01),HD(30、60 μg/mL)组AR蛋白表达水平显著升高(P<0.01),HD(60 μg/mL)组CDC25B蛋白表达水平显著升高(P<0.01)。

图5 HD对HepG2细胞IL-6、CDC25A、PTGS2、AR、CDC25B和ESR1蛋白表达的影响 ( , n = 3)Fig.5 Effect of HD on expressions of IL-6, CDC25A, PTGS2, AR, CDC25B and ESR1 proteins in HepG2 cells (, n = 3)
3.2.3 HD对H22荷瘤小鼠瘤体IL-6、CDC25A、PTGS2、AR、CDC25B和ESR1蛋白表达的影响 本课题组前期通过构建H22荷瘤小鼠模型,应用HE染色分析了HD对H22荷瘤小鼠肝脏和肾脏组织形态学的影响。结果表明,HD对小鼠肝脏和肾脏无明显毒副作用。此外,本课题组还分析了HD对H22荷瘤小鼠肿瘤组织的形态学影响,结果表明,与对照组相比,经HD治疗的小鼠肿瘤细胞团块中央出现大面积坏死灶,伴有炎性细胞浸润,肿瘤细胞数明显减少,同时部分肿瘤细胞出现了核固缩、破裂和溶解的现象[7]。因此,本研究将对照组、HD组和环磷酰胺组的H22荷瘤小鼠瘤体组织纳入分析,采用Western blotting检测各组H22荷瘤小鼠瘤体中IL-6、CDC25A、PTGS2、AR、CDC25B和ESR1蛋白表达。如图6所示,与对照组相比,各给药组IL-6、CDC25A、PTGS2、CDC25B和ESR1蛋白表达水平均显著降低(P<0.01),HD(200、400 mg/kg)组和环磷酰胺组AR蛋白表达水平显著升高(P<0.01)。
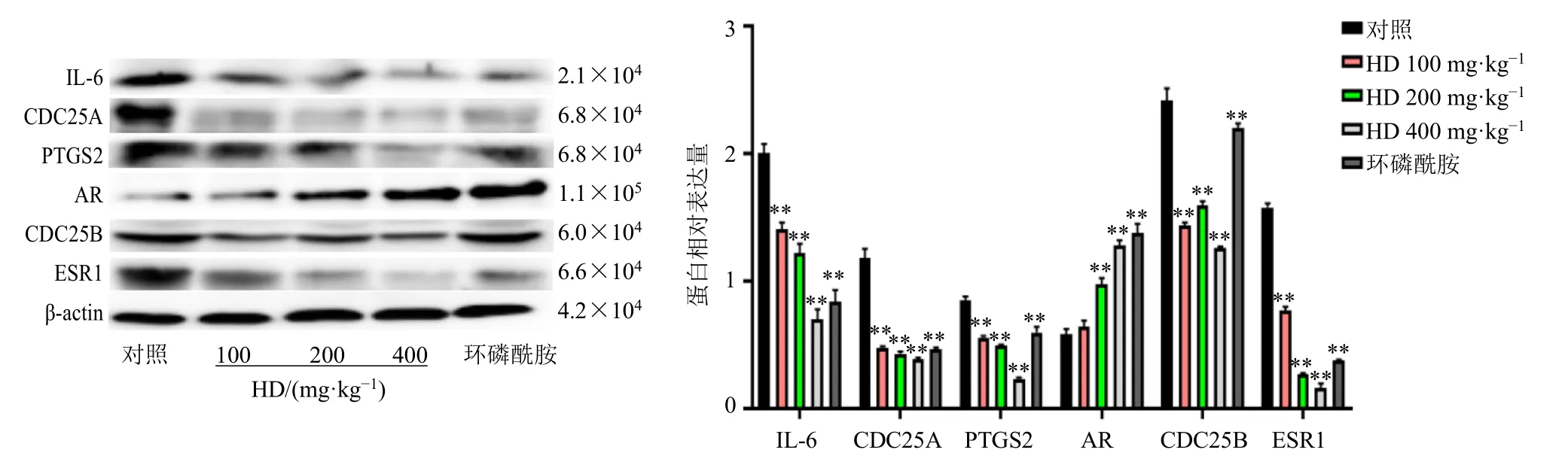
图6 HD对H22荷瘤小鼠瘤体IL6、CDC25A、PTGS2、AR、CDC25B和ESR1蛋白表达的影响 ( , n = 3)Fig.6 Effect of HD on expressions of IL-6, CDC25A, PTGS2, AR, CDC25B and ESR1 proteins in tumor of H22 tumor-bearing mice ( , n = 3)
4 讨论
全世界每年大约有84万肝癌新发病例、78万人死于肝癌,患者5年平均生存率不到10%[8]。手术切除、肝移植、局部应用放疗以及综合治疗是肝癌的主要治疗方案[9]。但由于肝癌发病的隐匿性和缺乏特异的早期标志物,导致大多数患者往往被诊断为肝癌晚期,不适合手术治疗,生存时间一般只有6个月[10]。由此可见,迫切需要开发一种靶向性强的、毒性小和不良反应少的抗肝癌药物以提高肝癌患者生存率。在前期研究中,本课题组通过体内和体外2个途径证明HD具有明显的抗肝癌作用,但具体机制尚不明确。因此,在前期工作基础上,本研究应用生物信息学与实验相结合的方法,进一步揭示HD抗肝癌的作用机制。
本研究应用生物信息学手段,通过对HD/肝癌交集基因进行PPI分析,发现CDC25A、IL-6和PTGS2为HD潜在靶点。CDC25A是一种双特异性蛋白磷酸酶,是最关键的细胞周期调节剂之一,能够清除周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)如CDK2、CDK4和CDK6等的抑制性磷酸化,并对CDKs的活性进行正向调节,从而影响细胞周期的进展[11]。CDC25A在肿瘤细胞的周期、凋亡、代谢和转移中起关键作用[12-14]。过表达的CDC25A与肿瘤相关因子[如核因子-κB(nuclear factor-κB,NF-κB)、信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)、中心体相关激酶2(NIMA related kinase 2,NEK2)、丙酮酸激酶M1(pyruvate kinase isozymes M1,PKM1)和叉头框转录因子1(Forkhead box O1,FOXO1)]相互作用,共同促进了肿瘤的进展[15-17]。此外,CDC25A在肝癌中高表达,与肝癌患者门静脉血栓形成、肝外转移和肝癌分化程度等临床病理参数呈正相关[18]。IL-6是典型的促肿瘤细胞因子,调节STAT3介导的多种致癌过程[19-21]。IL-6能够增强与细胞周期和细胞生存相关基因的转录诱导,如G1/S特异性细胞周期蛋白D1(G1/S-specific cyclin-D1,Cyclin D1)、原癌基因MYC、细胞凋亡抑制剂survivin(baculoviral IAP repeat containing 5,BIRC5)[22-24]。此外,IL-6还可促进与肿瘤细胞侵袭和转移相关基因的转录诱导,如低氧诱导因子-1α(hypoxia iducible factor-1α,HIF-1α)、基质金属蛋白酶2/7/9(matrix metalloproteinase 2/7/9,MMP2/7/9)和血管内皮生长因子(vascular endothelial growth factor,VEGF)[25]。研究发现,癌细胞具有以下功能:生长信号自给自足、对生长抑制信号不敏感、逃避细胞程序性死亡、无限复制潜力、持续血管生成以及组织侵袭和转移[26]。事实上,抑制PTGS2蛋白的表达已被证明干扰了这些功能中的大部分,这为治疗多种恶性肿瘤提供了一种很有前途的方法[27-29]。此外,在绝大多数关于PTGS2抑制剂对肝癌细胞影响的体外研究中,发现使用PTGS2抑制剂处理后,肝癌细胞存活率均显著降低[30-33]。因此,考虑到CDC25A、IL-6和PTGS2在肝癌发生和发展中的重要性,推测HD可能主要通过作用于CDC25A、IL-6和PTGS2,从而起到抗肝癌的作用。从分子生物学角度,本研究通过体内外途径检测了HD对CDC25A、IL-6和PTGS2蛋白表达的影响。结果表明,与对照组相比,HD组CDC25A、IL-6和PTGS2蛋白表达水平均显著降低。提示HD可能通过调控CDC25A蛋白表达水平,进而影响肝癌细胞的增殖周期;通过调控IL-6蛋白表达水平,导致肝癌细胞的侵袭和转移能力降低;调控PTGS2蛋白表达水平,从而影响肝癌细胞的程序性死亡,最终导致肝癌细胞的增殖受到抑制。
综上所述,本研究采用生物信息学与实验相结合的方法,发现HD可能主要通过作用于CDC25A、IL-6和PTGS2,从而起到抗肝癌的作用。
利益冲突所有作者均声明不存在利益冲突
