RNA内切酶CPSF3受E3D泛素连接酶UBE3D调控
2022-06-16郑煜芳
鲁 月,罗 婧,颜 璐,吴 宇,郑煜芳,
(1.复旦大学 生命科学学院,上海 200438; 2.复旦大学附属妇产科医院,上海 200011)
泛素化是一种重要的翻译后修饰。泛素分子在一系列特殊酶的作用下特异性修饰到靶蛋白上。其过程主要涉及E1、E2和E3三种酶[1]。E1是泛素激活酶,负责在ATP供能的条件下激活泛素并将激活的泛素分子转移到E2酶上。E2是泛素结合酶,负责结合被激活的泛素分子并通过E3呈递给底物蛋白。E3是泛素连接酶,负责将泛素从E2转移到底物蛋白上[2]。在这3种酶中,只有E3酶能对底物进行特异性识别,因此E3泛素连接酶是泛素化过程中最重要的3个酶之一。确定E3泛素连接酶与其特异底物之间的作用一直是这一领域研究的热点和难点[3]。
E3D泛素连接酶(Ubiquitin protein ligase E3D, UBE3D)基因UBE3D又名Ube2cbp,编码的蛋白UBE3D在人和小鼠中具有78.5%的同源序列。E3酶按照特殊的结构域主要分为3种: 带一个RING结构域,带一个HECT结构域,或者带两个RING结构域。UBE3D蛋白序列中有一区域与经典的E3泛素连接酶E6AP上的HECT结构域有31%相似度,故UBE3D被认为可能是一种HECT型E3泛素连接酶[4]。现有报道显示Ube3d的突变与老年性黄斑病变相关,且Ube3d纯合敲除的小鼠胚胎致死[5],提示UBE3D在胚胎发育过程中具有重要作用。但因为目前UBE3D的底物未知,无法深入探索其功能。本研究利用高通量互作组学的方法筛选了UBE3D的候选底物。
最常用的高通量筛选蛋白互作的方法是酵母双杂交(Yeast two-hybrid, Y2H)筛选和亲和纯化质谱法。酵母双杂交系统是一种利用酵母内转录调控系统检测蛋白质互作的方法[6-7],将待研究的两种蛋白质分别融合到表达转录激活因子的DNA结合结构域和转录激活域上,构建成融合表达载体,转化酵母细胞,从酵母的表达产物分析两种蛋白质是否相互作用[8-9]。亲和纯化质谱(AP-MS)是利用固定在亲和柱上的诱饵蛋白捕获其相互作用的猎物蛋白,纯化和洗脱后,对洗脱后的蛋白进行质谱分析,在实验结果中扣除对照组中的蛋白,即可鉴定出与诱饵蛋白互作的蛋白,是一种大规模识别蛋白质-蛋白质相互作用(PPI)的标准方法[10-11]。本研究通过酵母双杂交实验和分析Bioplex2.0数据库(http:∥bioplex.hms. harvard.edu/bioplexDisplay/index.php#)筛选出来两个UBE3D的候选底物: 微管相关蛋白1S(Microtubule-Associated Protein 1S, MAP1S)和切割与聚腺苷酸化特异因子3(Cleavage and Polyadenylation Specific Factor 3, CPSF3)。实验结果显示,MAP1S的蛋白表达水平不受UBE3D影响。而CPSF3可以与UBE3D互作并且蛋白表达量受UBE3D调控。因此,CPSF3可能是UBE3D的底物,受UBE3D的调控参与其对发育的调控作用。
1 材料与方法
1.1 菌株与细胞系
大肠杆菌E.coliDH5a购于碧云天生物技术研究所。293T细胞菌株购于中国科学院上海细胞库。
1.2 pCMV-Flag-UBE3D及pcDNA3.0-Myc-CPSF3表达质粒的构建

表1 用于扩增UBE3D及CPSF3的PCR引物
UBE3D,基因ID: 90025.CPSF3,基因ID: 51692.为了在293T中表达UBE3D和CPSF3,我们构建了pCMV-Flag-UBE3D(下文简写为UBE3D-Flag)、pcDNA3.0-Myc-CPSF3(下文简写为CPSF3-Myc)质粒。首先,通过PCR从全基因组中克隆出带有KpnⅠ和ApaⅠ酶切位点的UBE3D的cDNA,之后用KpnⅠ和ApaⅠ限制性内切酶双酶切UBE3D片段和pCMV载体,回收后进行双片段连接,转化E.coliDH5a感受态,然后涂板,挑克隆,最后测序筛选出pCMV-Flag-UBE3D阳性克隆。同理,通过RT-PCR从全基因组中克隆出带有KpnⅠ和EcoRⅠ酶切位点的CPSF3片段,酶切后克隆入pcDNA载体,测序筛选出pcDNA3.0-Myc-CPSF3阳性克隆。
1.3 抗体
本文所用的抗体信息见表2。
表2 Western blot及Co-IP实验的抗体信息
1.4 酵母双杂交及酵母基因组DNA提取
首先利用同源重组法进行pGADT7-Rec-UBE3D重组质粒的构建与鉴定,并制备酵母感受态细胞,将融合DNA结合结构域(GAL4-bd)的重组UBE3D质粒在感受态酵母菌株中进行诱饵菌的转化,比较试验组与对照组OD600值,进行诱饵重组质粒的自激活活性检测。将文库菌与诱饵菌进行杂交,与UBE3D具有相互作用的的另一基因则融合到转录激活域,蛋白质间的相互作用使得转录因子重建导致相邻的报道基因LacZ表达,从而用酵母质粒小抽试剂盒(AXYGEN公司#AP-MN-P-250)提取变蓝的克隆进行阳性克隆的鉴定。对于鉴定出来的阳性克隆,扩增阳性的酵母菌落,用山梨醇法提取酵母菌的基因组DNA提取,用Nano Drop检测DNA浓度。
1.5 质粒抽提
向30 μL液态的E.coliDH5α细胞加目的质粒进行转化,冰上30 min后热激90 s,冷却5 min。无菌环境下用150 μL无抗生素LB液态培养基稀释滴加到培养皿上,37 ℃潮湿环境中培养16 h。挑单克隆到氨苄西林抗性液体培养基中,37 ℃ 300 r/min低速摇床摇16 h。根据菌液量选择抽提试剂盒(QIAGEN公司#10023),按照步骤进行抽提,用Nano drop检测DNA浓度,注意OD260/OD280的范围应该在1.8~2.0之间,OD260/OD230大于2.0.否则证明有RNA或蛋白污染。将质量浓度合适的质粒保存在-20 ℃,或者短期内(不超过3个月)可直接保存在4 ℃冰箱内,进行下一步使用。
1.6 细胞培养与转染
细胞的培养环境为37 ℃含5% CO2的Thermo细胞培养箱,高糖培养基添加10%胎牛血清+1%青链霉素混合液。细胞复苏将融化的细胞转移至1.5 mL LEP管内,室温低速离心,冻上清冻存液留细胞。加培液重悬细胞,转移到10 cm细胞培养皿内,再加培液至总体积为10 mL,37 ℃培养箱内培养。对于需要转染的细胞前一天传代,按实验设计需要将细胞接种到相应类型的细胞培养皿中,次日待细胞密度到60%左右进行转染。每孔转染试剂和质粒比例为2∶1,并用OPTI-MEM分别进行稀释混匀,混合稀释后的质粒和脂质体核酸转染试剂,室温孵育20 min,将溶液用枪头均匀滴加到细胞培养皿中,随后轻柔地适当混匀细胞培液。标明转染时间和质粒后,将细胞放回37 ℃培养箱中培养,24 h后收样。
1.7 免疫共沉淀(Co-IP)和免疫印迹(Western blot)
转染方法同上,在10 cm皿中加4 μg CPSF3-Myc和4 μg UBE3D-Flag质粒,收样前4 h,加终浓度为20 μmol/L的蛋白酶体抑制剂MG-132(溶剂为二甲基亚砜)弃培液,并用1×PBS清洗两遍,加1 mL的NP-40裂解液,冰上裂30 min。用预冷好的的细胞刮板把裂解好的细胞刮下来,转移到干净的1.5 mL EP管内。4 ℃冷冻离心机内以12 000 r/min转速离心15 min。去管底部的沉淀,留上清,按IP实验中所需抗体稀释比例加对应的抗体。4 ℃翻转摇床上缓慢翻转摇动过夜。每管加30 μL充分上下颠倒重悬后的Protein A+G Agarose beads,放到4 ℃翻转摇床上缓慢翻转摇动3 h。离心后,吸去上清,用0.5 mL预冷的PBS重复洗4~5次沉淀,加60 μL 1×SDS-PAGE电泳上样缓冲液,离心把beads离心至管底。95 ℃金属浴5 min,上清即蛋白样品,接下来进行Western blot。
取部分细胞裂解液,与电泳上样缓冲液混合后95 ℃金属浴5 min,再进行电泳跑胶和转膜,转好的膜进行5%牛奶(以PBS+0.1%Tween溶解)封闭后,加入一抗4 ℃过夜。第二天用预冷的PBS+0.1% Tween溶液清洗3次后加入对应的二抗室温孵育2 h后进行化学发光显影。
1.8 qRT-PCR
首先用TRIzol法进行RNA的提取,提取后的RNA按照TaKaRa公司提供的反转录酶产品。接着按照康为世纪公司SYBY Green Supermix试剂盒进行操作,引物序列见表 3。每个样品重复3个孔,采用管家基因β-actin作为内参,每种样品中某一基因的表达量用相对定量的方式进行比较。
表3 用于UBE3D-CPSF3的qRT-PCR引物列表
1.9 泛素化
将带HA标签的泛素表达质粒、UBE3D-Flag及CPSF3-Myc质粒分别转染293T细胞。根据不同组别进行转染,转染质粒24 h后收样,并于收样前4 h加入蛋白酶体抑制剂(MG-132)处理。收集处理后的细胞,用免疫共沉淀法使用的裂解液裂解细胞,用外源的Myc抗体孵育过夜,以下步骤与外源性表达的免疫共沉淀相同,Western blot检测泛素等表达。
2 结果与分析
2.1 酵母双杂交和蛋白互作数据库筛选UBE3D候选底物
之前报道根据序列推测UBE3D可能是一种E3泛素连接酶[4]。为了筛选UBE3D的候选底物,我们分别使用酵母双杂交实验和Bioplex蛋白互作数据库两种方法筛选UBE3D可能的底物蛋白。通过酵母双杂交实验,我们一共获得了337个阳性克隆,其中326个在NCBI上有对应的基因序列,去除测序结果中结合区段非CDS的基因,共获得了286个候选互作底物。将在酵母双杂交筛选中出现频次大于3的候选底物共17个,按照出现频次从高到低依次排序,结果如图1(a)所示。同时,根据哈佛大学团队利用大规模亲和纯化质谱技术建立的蛋白互作预测网站Bioplex Display筛选出UBE3D可能存在21个互作蛋白(图1(b))。其中,CPSF3同时出现在酵母双杂交实验和Bioplex数据库预测的结果中(图1(c))。所以我们选定CPSF3为UBE3D候选底物蛋白。同时,我们也将酵母双杂交实验中出现频次最多的阳性克隆MAP1S作为候选底物蛋白进行检测。

图1 利用酵母双杂交和Bioplex 2.0数据库筛选UBE3D的候选底物Fig.1 The candidate substrates of UBE3D were screened by using yeast two-hybrid and Bioplex 2.0 database(a) 酵母双杂交筛选出的出现频次大于3的UBE3D候选底物蛋白;(b) Bioplex 2.0数据库中UBE3D的可能互作蛋白;(c) 酵母双杂交实验结果与Bioplex 2.0数据库比对结果的交集.
2.2 UBE3D不影响MAP1S的蛋白表达水平
因为泛素化修饰后的靶蛋白可能被降解或者被转移到细胞及细胞外的特定部位[1],靶蛋白的表达量是否受E3泛素酶调控是一个关键实验。所以我们对酵母双杂交实验中出现频次最高的候选底物MAP1S首先进行细胞实验,检测其蛋白表达是否受到UBE3D的量的调控。我们在293T细胞中共转染相同浓度的MAP1S-Flag质粒和不同浓度梯度的UBE3D-Myc质粒,转染24 h后收获细胞。用内源性抗体分别检测细胞质中MAP1S和UBE3D的蛋白表达水平,结果发现UBE3D的蛋白表达量的确随质粒转染量显著增加,但MAP1S蛋白的表达没有显著变化(图2)。因此,MAP1S的蛋白表达量不受UBE3D调控。

图2 UBE3D质粒浓度的改变不影响MAP1S蛋白的表达Fig.2 The change of UBE3D plasmid concentration did not affect the expression of MAP1S protein共转染不同浓度的UBE3D-Myc和MAP1S-Flag质粒.3组实验中MAP1S-Flag质粒量保持每个12孔板单孔转染0.125 μg,与之进行共转染的UBE3D-Myc质粒量按照单孔内不加该质粒,加0.125 μg和加0.25 μg进行递增.为保证单孔转染的质粒总量一致,用UBE3D-Myc质粒对应的空载Pcmv-Myc质粒将单孔总质粒量补齐至0.375 μg.共转染24 h后,图(a)为Western blot图片,图(b)为Western blot统计分析结果.(用VINCULIN做内参进行标准化,n=3).所有统计数据均表示为平均值±标准误差,n.s.表示不显著,*表示P<0.05.
2.3 UBE3D调控CPSF3的蛋白表达水平
接下来我们重点测试了CPSF3是否是UBE3D的底物。类似于MAP1S,我们也检测了UBE3D是否会影响CPSF3的表达量。我们在293T细胞中共转染相同浓度的CPSF3-Myc质粒和不同浓度梯度的UBE3D-Flag质粒,转染24 h后收获细胞。然后通过Western blot和qRT-PCR实验分别检测UBE3D对CPSF3蛋白和CPSF3 mRNA表达的影响,结果显示过表达UBE3D可以显著上调CPSF3蛋白的表达量,但不影响其mRNA的表达量(图3(a))。我们也检测了下调UBE3D表达后,CPSF3的表达量变化情况。在293T细胞中转入特异性的siRNA敲低UBE3D,转染24 h后收获细胞。然后通过Western blot和qRT-PCR实验分别检测UBE3D和CPSF3的表达水平。结果显示,siRNA显著下调了UBE3D蛋白的表达。同时,CPSF3的蛋白量也随UBE3D表达量下调而显著下降,其mRNA表达水平没有显著变化(图3(b))。上述结果表明UBE3D可以正向调控CPSF3的蛋白表达,具有稳定CPSF3蛋白的作用。
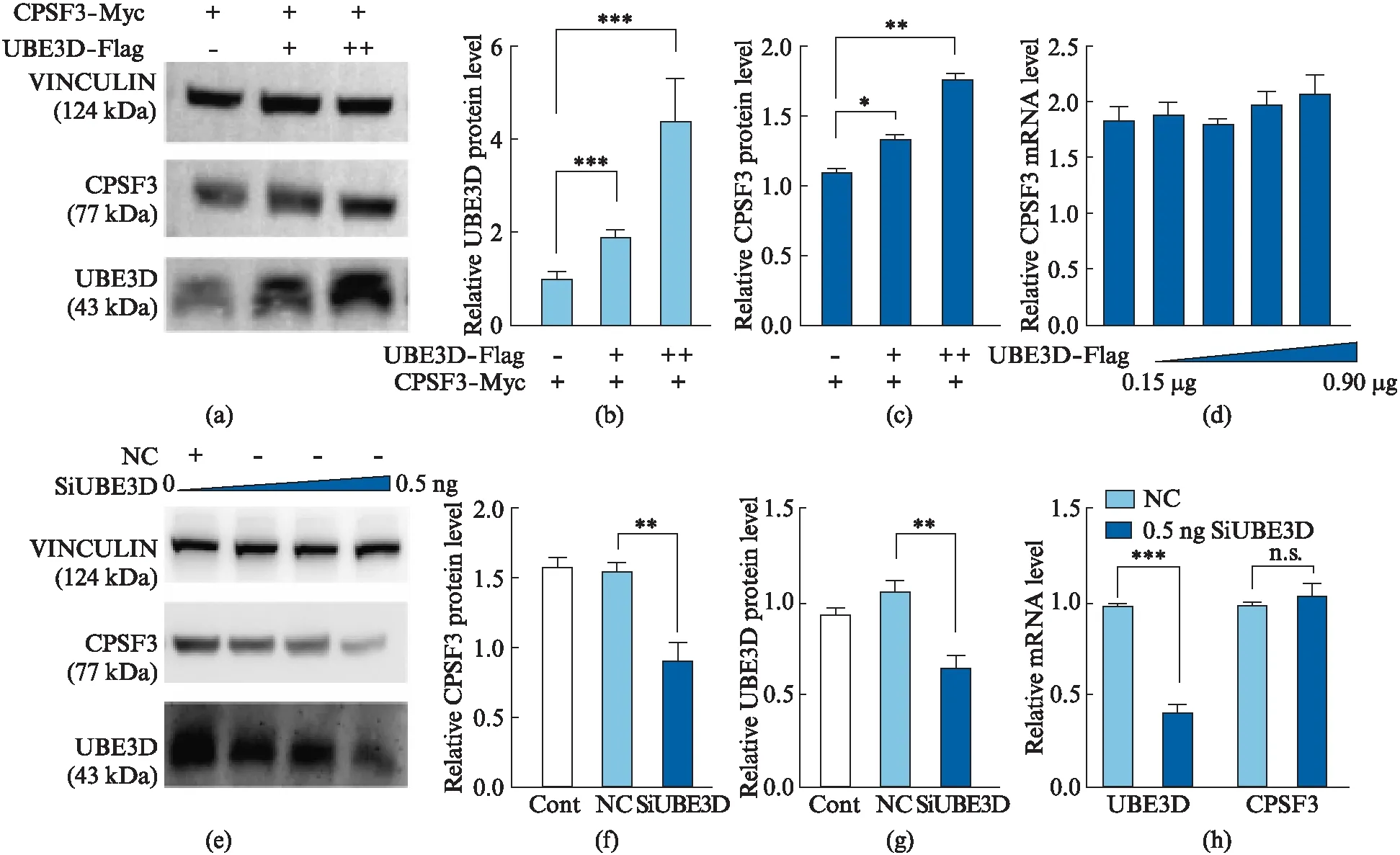
图3 UBE3D调控CPSF3的蛋白表达水平Fig.3 Protein expression level of CPSF3 regulated by UBE3D共转染不同浓度的UBE3D-Flag和CPSF3-Myc质粒,三组实验中CPSF3-Myc质粒量保持每个6孔板单孔转染0.25 μg,与之进行共转染的UBE3D-Flag质粒量按照单孔内不加该质粒,加0.25 μg和加0.50 μg进行递增.共转染24 h后,分别提蛋白和RNA通过Western blot以及qRT-PCR实验验证其转录和翻译水平.图(a)为代表性印迹,用内源性抗体检测UBE3D和CPSF3的蛋白表达水平.图(b)和(c)分别为UBE3D和CPSF3蛋白表达量的统计分析(用VINCULIN做内参进行标准化,n=4).图(d)为CPSF3的mRNA相对表达水平.图(e)为转染不同浓度的UBE3D的siRNA时的免疫印迹,并设置转染ShNC作为对照组,加入siRNA的量每个6孔板单孔转染0.15 μg、0.30 μg、0.50 μg进行梯度递增.最终选用0.50 ng的UBE3D siRNA进行图(f~h)的实验,并同时设置空转和转染非特异siRNA的对照组NC.转染24 h后,提蛋白通过Western blot检测翻译水平,图(f)和(g)分别为CPSF3和UBE3D蛋白量的统计分析,图(h)为CPSF3的mRNA相对表达水平(用VINCULIN做内参进行标准化,n=4).所有统计数据均表示为平均值±标准误差.N.S,表示不显著,*表示P<0.05,**表示P<0.01,***表示P<0.001.
2.4 Co-IP显示UBE3D和CPSF3之间存在相互作用
验证了CPSF3表达量受UBE3D调控后,我们进一步用Co-IP验证了CPSF3和UBE3D之间的相互作用。在293T细胞中共转染了带Myc标签的CPSF3和带Flag标签的UBE3D表达质粒,分别利用外源Myc和Flag抗体和内源的CPSF3抗体做Co-IP,由WB检测IP结果。如图4显示,用CPSF3或Myc抗体IP,可以免疫共沉淀UBE3D;用Flag抗体IP,可以免疫共沉淀CPSF3.这一结果表明CPSF3和UBE3D之间确实存在互作。

图4 CO-IP显示UBE3D和CPSF3之间存在相互作用Fig.4 CO-IP shows the interaction between UBE3D and CPSF3在10 cm皿培养293T细胞内共转染4 μg UBE3D-Flag和4 μg CPSF3-Myc质粒(对照组加对应的空载),转染20 h后(收样前4 h)加终浓度为20 μmol/L的蛋白酶体抑制剂MG-132,培养24 h后收细胞.图(a)用CPSF3质粒上带的Myc做Co-IP,用二者内源抗体分别检测UBE3D和CPSF3的表达;图(b)用UBE3D质粒上带的Flag做Co-IP,用二者内源性抗体检测蛋白表达水平,n>4.
2.5 UBE3D不改变CPSF3的多聚泛素化水平
根据UBE3D可能是一个E3泛素连接酶的功能背景[4],下一步我们检测了UBE3D对于CPSF3泛素化水平的影响。为了排除内源蛋白的影响,我们在293T细胞中转入带Myc标签的CPSF3表达质粒。同时转入带HA标签的泛素表达质粒和表达UBE3D的质粒。转染24 h,在收样前4 h,加入MG132.然后通过Myc抗体免疫共沉淀富集CPSF3,用Western blot检测HA标记的泛素表达量。与对照组相比,CPSF3的多聚泛素化水平(77 kDa)没有显著变化(图5)。
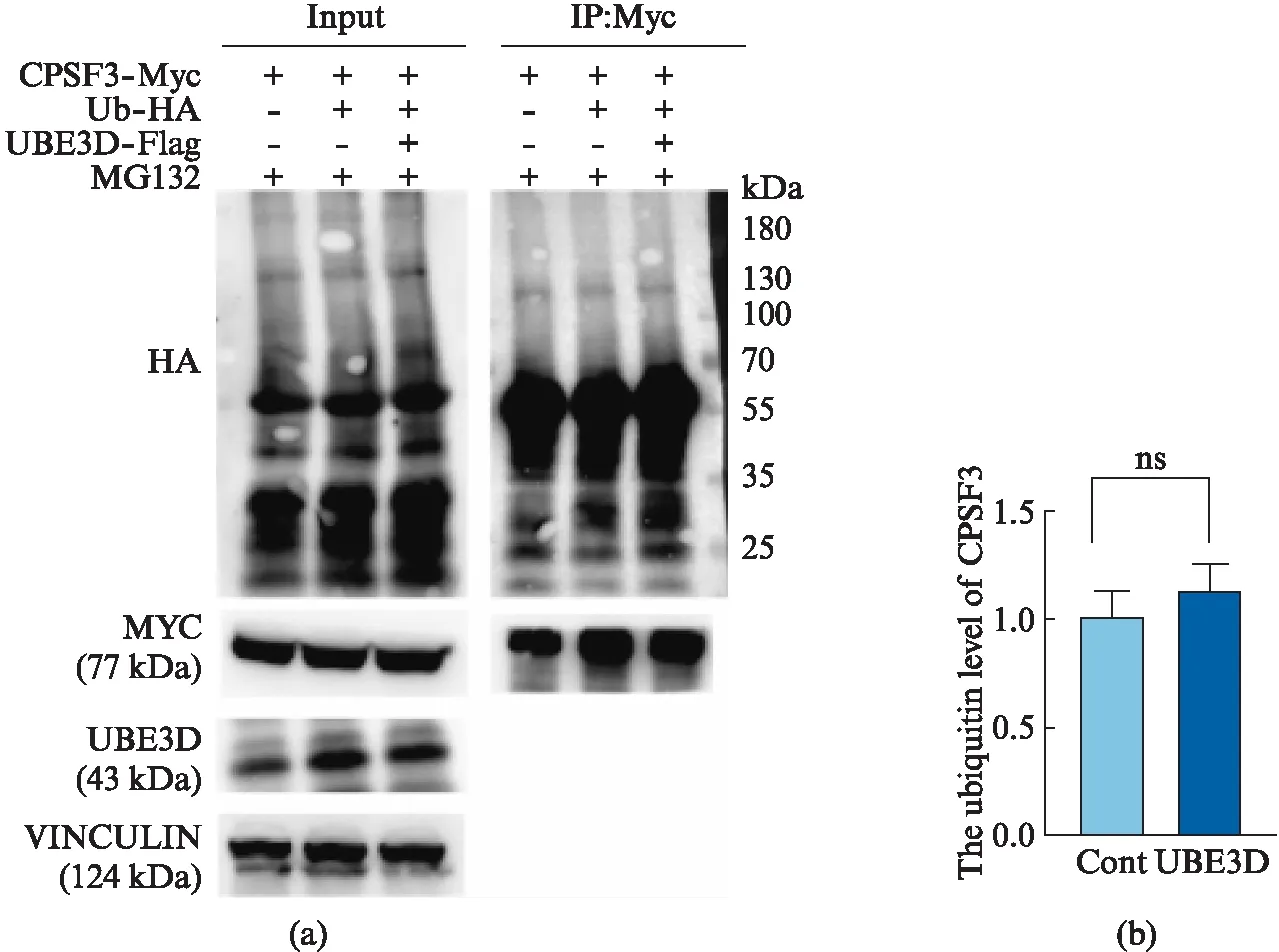
图5 UBE3D不改变CPSF3的多聚泛素化水平Fig.5 UBE3D does not change the ubiquitin level of CPSF3在10 cm皿培养293T细胞内转染UBE3D的特异性siRNA,转染20 h后(收样前4 h)加终浓度为20 μmol/L的蛋白酶体抑制剂MG-132,培养24 h后收细胞.用CPSF质粒上带的Myc做IP,用泛素抗体检测泛素化水平,图(a)为代表性Western blot图,图(b)为CPSF3多聚泛素化的统计分析(用Input及对照组做内参进行标准化,n=3).所有统计数据均表示为平均值±标准误差.ns表示不显著,*表示P<0.05,**表示P<0.01,***表示P<0.001.
3 总结与讨论
E3泛素酶功能研究的重点之一就在于深寻找并鉴定其底物。本研究主要针对UBE3D可能是一个E3泛素连接酶的功能背景,寻找其特异性的底物进行研究。通过酵母双杂交实验,筛选出的17个候选底物中,首先挑选了MAP1S进行研究,发现UBE3D对MAP1S没有调控作用,不影响MAP1S的蛋白表达水平。这可能由于酵母双杂交在活酵母菌中受复杂的环境影响,一定程度上会出现假阳性的情况。而我们根据酵母双杂交和大规模亲和纯化质谱数据库Bioplex两种方法的交集筛选的CPSF3的表达的确受UBE3D的调控。这表明高通量筛选数据中易出现假阳性,所以多种筛选方法的联用是必须的。
我们的实验验证了CPSF3与UBE3D之间的相互作用。值得注意的是,UBE3D具有正向调控CPSF3的蛋白表达的功能,即UBE3D起到了稳定CPSF3的作用。这与经典的泛素化参与蛋白质降解过程调控的功能不同。泛素化是真核生物中主要的胞浆蛋白水解系统[12-13]。常见的是泛素-蛋白酶体的蛋白质分解途径。然而近年来研究发现,泛素化修饰后并非一定会导致被修饰蛋白的降解[14],也有泛素偶联的底物在去泛素酶作用下不发生降解[15]。泛素化修饰可以分为单泛素化、多泛素化和多聚泛素化3种类型。前两种都是指泛素分子以单体形式结合底物蛋白的赖氨酸残基对其进行泛素化修饰,差别在于被修饰位点数目。这两种泛素修饰多与DNA修复、蛋白定位有关[15]。第3种多聚泛素化,则是由于泛素分子自身携带的7个赖氨酸残基(K6、K11、K27、K29、K33、K48、K63)[16],以及N端甲硫氨酸(M1)[17]都可以被其他游离的泛素分子修饰,从而形成多聚泛素链。在不同类型的多聚泛素链修饰中,K48、K11修饰介导的经典的降解途径,被这两种多聚泛素化修饰的底物蛋白最终会进入蛋白酶体发生降解。M1和K63介导的则属于非降解修饰,主要用于辅助底物蛋白复合物的组装和信号转导[18],其他位点的多聚泛素化链修饰的功能尚缺乏了解。我们的泛素化实验结果中没有检测到CPSF3的多聚泛素化水平有明显变化。但是,UBE3D对于CPSF3是否存在单个位点的泛素化或者多泛素化作用,则需要后续实验深入探索。
CPSF3是切割和聚腺苷酸化特异性因子的73 kDa亚基,该亚基是金属-β-内酰胺酶家族的成员,具有核酸内切酶的作用,该酶识别pre-mRNA的3′切割位点AAUAAA,进行切割,然后pre-mRNA发生多聚腺苷酸化形成新的末端[19]。因此,CPSF3对于mRNA的成熟具有重要的作用,其稳定的表达,对于基因的表达至关重要[20]。相关报道中发现,抑制CPSF3的表达,可以使HCT-116细胞中TGFβ2蛋白和磷酸化的SMAD3水平下降,从而抑制TGF-β信号通路[21],我们推测CPSF3对TGF-β信号通路的调控功能在胚胎发育中也有重要作用。UBE3D可能通过与CPSF3相互作用,参与调控早期胚胎发育的各个过程。此外已知E3泛素连接酶和底物之间并非一对一的关系,即一个E3泛素连接酶可能对应多种底物,一种底物也可以受到多种E3泛素连接酶的作用[22-24]。因此,后续对于UBE3D是否存在其他底物也需要进一步深入探索。
