纤维素降解菌种的筛选测定及其对秸秆的降解
2022-06-16黄青盈吕嘉昕何秋愉刘明秋
黄青盈,吕嘉昕,何秋愉,武 全,刘明秋
(复旦大学 生命科学学院 上海工业菌株工程研究中心, 上海 200438)
纤维素在自然界分布广泛,是世界上最丰富的可再生生物质资源之一。秸秆是主要的农业废弃物,富含可利用的纤维素资源,同时亦存在难降解和难以资源化的问题。我国秸秆资源丰富,每年产量超过9亿吨,但秸秆及其副产物综合利用率平均不到40%[1]。秸秆的主要成分有灰分、纤维素、半纤维素、木质素等,在自然条件下降解缓慢。因此,传统方法主要将其焚烧处理,该方法效率低、耗能大且会造成较为严重的环境污染。我国也出台了对焚烧秸秆的禁令,但要从根本上解决秸秆处理问题,重点在于使用更有效且环保的处理方式,使之分解成为可利用的生物质能源、肥料、易消化的饲料及制造原料。禾本类造纸传统技术是加入碱液蒸煮,会产生大量黑液造成严重环境污染,我国从90年代末就全面关停所有草类造纸项目。随着国家禁止洋垃圾的进口和禁塑令的实施,结合国内草多木少的国情,很多研究都把目光集中在水稻、小麦秸秆上。考虑到环保需求,需要采用生物方法与机械方法结合,用生物方法对秸秆进行制浆预处理,去除部分木质素,熟化秸秆,提高后续步骤效率[1]。纤维素水解还可生成多种产物如乙醇、烷烃、琥珀酸、乳酸乙酯等,可作为新能源生产和资源化利用的重要原料[2]。
降解纤维素的方法包括物理法、化学法和生物法。物理法主要是使用高温热降解,化学法则较多使用酸碱试剂和氧化剂,这两种方法不仅耗能大、成本高,而且处理过程会造成环境污染,产生有害副产物[3]。生物法则是利用能够产生纤维素降解酶的细菌、真菌、放线菌等微生物来进行处理[4],耗能少、成本低,且环境友好[5],因此受到广泛关注,也取得了一定成果[6]。降解纤维素和木质素的微生物有细菌、真菌和假单胞菌、链霉菌等放线菌[7]。真菌产纤维素酶的能力很强[8],而细菌具有更强的环境适应性,生长更快,能够产生特异性更高的多酶复合物[9]。刘晓飞等[10]从赛地黑土中筛选出一株能高效降解纤维素的放线菌,滤纸酶活性(FPA)达到(11.94±0.51)U/mL,最优条件下对玉米秸秆5 d降解率可达23.54%;孟建宇等[11]从大兴安岭森林土壤中获取了能降解纤维素的真菌,两株真菌羧甲基纤维素(CMC)酶活性可分别达到103.89 U/mL和158.36 U/mL;江高飞等[12]研究了能够在高温好氧堆肥中保持高度热稳定性并降解纤维素的菌株,在55~65 ℃和75 ℃条件下依旧能发挥较高的效用;张必周等[13]在低温条件下寻找能高效降解纤维素的复配菌,在15 ℃模拟环境培养下滤纸酶活性(FPA)为32.96 U/mL。
为了避免物理和化学方法处理纤维素的弊端,挖掘更多更有效的纤维素处理的微生物资源,本研究拟从多种环境中分离具有降解纤维素潜力的菌种,对其进行驯化、筛选,并测定其降解纤维素和产多种与纤维素和木质素有关酶的能力。将这些菌种用于降解水稻秸秆,考察单菌及不同混合菌种的降解效果和最佳降解条件,此外还尝试将其用于造纸原料秸秆的预处理,为秸秆的生物处理和资源化利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种与秸秆样品
菌种分离自复旦大学食堂厨余垃圾、餐厨垃圾处理厂的废水及处理厂周围被废水浸润的土壤。
002A为实验室已鉴定的自研混合菌剂,主要为枯草芽孢杆菌和地衣芽孢杆菌,常用于养牛场牲畜粪便及餐厨垃圾处理,用于丰富菌种,增加混合菌剂效用。
秸秆于2020年9—10月采自浙江平湖市和江苏盐城市水稻田,晾干切成2~3 cm小段,置于阴凉干燥处储存备用。
1.1.2 材料以及仪器
酵母粉、蛋白胨购自英国Oxoid公司;葡萄糖购自华大公司;氯化钠购自福晨化学公司;硫酸镁、磷酸氢二钾购自上海文旻生化科技有限公司;明胶、琼脂、微晶纤维素购自生工生物工程(上海)股份有限公司;刚果红购自天津市大茂化学试剂场;羧甲基纤维素钠购自湖南佰欧泰医药有限责任公司;分光光度计为上海菁华科技仪器有限公司产品;扫描电镜为TESCAN公司产品,型号VEGA3。
1.2 培养基
驯化富集培养基的配制参考文献[14],通过梯度减少有机成分使细菌逐渐适应,以加入的滤纸片作为碳源,同时观察驯化期间滤纸片是否发生了崩解。LB培养基配制: 酵母粉5 g,蛋白胨10 g,NaCl 5 g,加水定容至1 000 mL,使用5 mol/L的NaOH溶液调节pH至7左右,121 ℃ 15 min灭菌。无机培养基配制: KH2PO43 g,MgSO4·7H2O 3 g,加水定容至1 000 mL,121 ℃ 15 min灭菌。第1次驯化培养基配制: 50 mL LB培养基中加入滤纸片1 g,121 ℃ 15 min灭菌。第2次驯化培养基配制: 25 mL LB培养基,25 mL无机培养基,加入滤纸片1 g,121 ℃ 15 min灭菌。第3次驯化培养基配制: 10 mL LB培养基,40 mL无机培养基,加入滤纸片1 g,121 ℃ 15 min灭菌。筛选培养基的配制参考文献[15]: 微晶纤维素10 g,KH2PO41 g,酵母粉1 g,蛋白胨2 g,MgSO40.5 g,NaCl 0.5 g,琼脂15 g,加水定容至1 000 mL,121 ℃ 15 min灭菌。验证性质培养基配制采用孟建宇等[11]的方法: K2HPO40.5 g,微晶纤维素1.88 g,MgSO40.25 g,明胶2 g,刚果红0.2 g,琼脂1.4 g,加水定容至1 000 mL,121 ℃ 15 min灭菌。产酶培养基的配制参考文献[16]: 羧甲基纤维素钠15.0 g,酵母粉5.0 g,KH2PO42.0 g,121 ℃ 15 min灭菌。秸秆发酵培养基的配制参考文献[17]: 100 mL LB培养基中加入秸秆条3 g,121 ℃ 15 min灭菌。
1.3 菌种驯化分离鉴定
将各来源菌种分别依次接种纤维素富集培养基驯化3次,每次驯化时于摇床中220 r/min 30 ℃培养7 d,并观察培养基变化[18]。
将第3次驯化后锥形瓶中的菌稀释涂布于筛选培养基中,将涂布后形态结构不同的菌落进行分离纯化,在平板纯化3次后挑单克隆接入液体LB培养基中培养24 h,置于4 ℃冰箱备用[19]。
菌种鉴定: 将分离得到的菌种接种于液体LB培养基中培养过夜,各取1 mL菌液加入离心管中。按照诸葛诚祥[20]的方法提取DNA进行测序鉴定。引物27F: 5′-AGAGTTTGATCCTGGCTCAG-3′,引物1492R: 5′-GGTTACCTTGTTACGACTT-3′,PCR反应条件: 94 ℃变性3 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,30次循环后,于72 ℃下最后延伸10 min,使反应产物扩增充分,目标片段1 500 bp。PCR产物由上海擎科生物进行测序。
1.4 降解纤维素验证
于含有刚果红的纤维素验证培养基上三点接种分离到的各菌种。30 ℃培养箱培养1 d后观察是否有脱色圈。由于刚果红可与纤维素形成红色复合物,当纤维素被菌种分泌的酶分解后就会产生以菌落为中心的透明圈,以此定性验证菌种对纤维素的降解能力[21]。
1.5 酶活力测定
采用文献[22]的所有实验重复3次: 菌株活化后以1%(体积比)接种量接入10 mL发酵产酶培养基中培养3 d,于4 ℃、10 000 r/min条件下离心5 min,取上清液即粗酶液加蒸馏水稀释5倍测定酶活力[23]。
纤维素酶活力的测定采用DNS法,酶活力单位(U/L)定义为: 实验条件下1 L酶液1 min催化底物生成1 μmol葡萄糖的量。
葡萄糖标准曲线绘制: 分别配制浓度为0.05、0.1、0.2、0.5、1 mg/mL的葡萄糖溶液,在每根试管中加入各浓度梯度葡萄糖溶液0.5 mL和pH 4.8 0.05 mol/L的K2HPO4-柠檬酸溶液各2 mL、0.5 mL DNS试剂,沸水浴5 min后迅速冷却,540 nm处测定其OD值,作出标准曲线。
羧甲基纤维素酶活力的测定底物为质量分数1%羧甲基纤维素钠的柠檬酸缓冲液(0.05 mol/L pH 4.4),外切葡聚糖酶活底物为质量浓度1%的微晶纤维素溶液;β-葡聚糖酶活力的测定底物为质量浓度1%的水杨苷溶液;纤维素相关酶的总酶活的测定底物为1 cm×6 cm的新华滤纸1条。
在2 mL底物溶液中准确加入已稀释的粗酶液0.5 mL,50 ℃条件下水浴30 min后加入0.5 mL DNS,沸水浴5 min后取出并立即冷却,摇匀后在波长540 nm处测定吸光度值,对照葡萄糖标准曲线用吸光度值求出还原糖的含量然后计算出酶活力[24]。
1.6 木质素有关酶活力测定
由于秸秆中含有的木质素也是影响其降解的重要因素,因此也采用文献[25]的方法探究其余木质素有关的酶活力,所有实验重复3次。
木质素过氧化物酶活性测定: 底物为加入1 mmol/L白藜芦醇的醋酸钠缓冲液(pH 4.5,1 mmol/L)2 mL,设空白对照,水浴预热至60 ℃后加入稀释5倍后粗酶液0.5 mL,用1 mmol/L H2O20.5 mL启动反应。在波长310 nm处测定体系内吸光度的增加值,1个酶活力单位(U)定义为每分钟每毫升滤液吸光值增加0.1[26]。
锰过氧化物酶活性测定: 底物为加入1 mmol/L MnSO4为底物的醋酸缓冲液(pH 4.6,1 mmol/L)2 mL,设空白对照,水浴预热至60 ℃后加入稀释5倍后粗酶液0.5 mL,用1 mmol/L H2O20.5 mL启动反应。在波长270 nm处测定体系内吸光度的增加值,1个酶活力单位(U)定义为每分钟每毫升滤液吸光值增加0.1。
漆酶活性测定: 底物为1 mmol/L ABTS(2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate))的醋酸钠缓冲液(pH 4.5,1 mmol/L)2 mL,设空白对照,水浴预热至60 ℃后加入稀释5倍后粗酶液0.5 mL。在波长420 nm处测定体系内吸光度的增加值,1个酶活力单位(U)定义为每分钟每毫升滤液吸光值增加0.1。
1.7 秸秆降解及条件优化
将初筛效果较好的菌株接种于LB培养基培养24 h,接种5%(体积比)菌液于100 mL秸秆发酵培养基中,对照加相同体积无菌水。分别置于30 ℃、220 r/min恒温培养7 d后将发酵后的秸秆残渣从锥形瓶倒出并用无菌水冲洗干净,然后置于高温烘箱中65 ℃烘干8 h至恒重,取出烘干后的秸秆称重并计算秸秆相对降解率=(W0-W)/W0×100%,W0为对照秸秆残渣干重,W为降解后秸秆残渣干重,每株菌重复3次[27]。
选取部分效果较好的菌种,LB培养基培养24 h后测定OD600,以其中最低的一组为标准,其余各组稀释至OD600相同后以等比例混合,组成多种混合菌剂以5%的接种量分别接种秸秆发酵培养基,发酵后测定相对降解率选出最佳组合,重复3次。
选取最佳效果的混合菌种,分别置于3组单一条件变量的情况下测定不同条件变化对于秸秆降解率的影响,重复3次: 发酵前菌种培养初始pH分别为5、6、7、8、9;培养基碳源含量分别为1、2、3、4、5 g/L;发酵温度分别为20、25、30、35、40 ℃[28]。
1.8 扫描电镜观察
将最佳纤维素降解菌发酵处理后的秸秆和原始秸秆在4 ℃条件下用2.5%戊二醛固定液液浸泡1 d,然后用浓度为50%、60%、70%、80%、90%、100%的乙醇溶液依次处理10 min,放入冷冻干燥仪中脱水处理1 d。干燥好的秸秆细条经过喷金处理后在扫描电子显微镜下观察秸秆在处理前后表面的差异[29]。
1.9 秸秆造纸制浆预处理
以002A及本实验筛选得到的菌种为实验菌种,每组各取100 g秸秆装入杯中,菌液接种量为秸秆重量的10%,加水700 mL浸没秸秆翻搅均匀,放入培养箱,40 ℃培养,第3、5、7天观察并送样至造纸厂检测[30]。后续使用20%接菌量和100 mL LB培养基加10%接菌量以改进效果。
2 结果与分析
2.1 菌种分离鉴定
驯化过程中观察到滤纸条的崩解。经过多次驯化和筛选,分离出单菌落后进行16S rRNA鉴定,得到以下11个菌株: X1(Bacilluscereus)、X2(Bacillusthuringiensis)、X3(Alcaligenesfaecalis)、X4(Bacilluscereus)、Y1(Bacilluscereus)、Y3(Alcaligenesfaecalis)、X5(Bacilluscereus)、X8(Bacillussp.)、X9(Bacilluscereus)、X10(Klebsiellaoxytoca)、X11(Citrobacterfreundii),其相似度如表1所示。进一步使用Mega软件构建系统发育树分析Bacilluscereus属的5个菌株(X1、X4、X5、X9、Y1)以及与它们类似的模式菌株,结果如图1所示。

表1 各菌株鉴定结果

图1 B.cereus属的5个菌株系统发育树分析Fig.1 Phylogenetic analysis of five B.cereus strains
2.2 降解纤维素验证
由于刚果红可与纤维素形成红色复合物,当纤维素被菌种分泌的酶分解成小分子糖等物质后就会产生以菌落为中心的透明圈,以此验证菌种对纤维素降解能力,11个菌株在验证培养基上的透明圈直径见表2,降解较好的菌种为X1、X2、X4、X8、Y1。
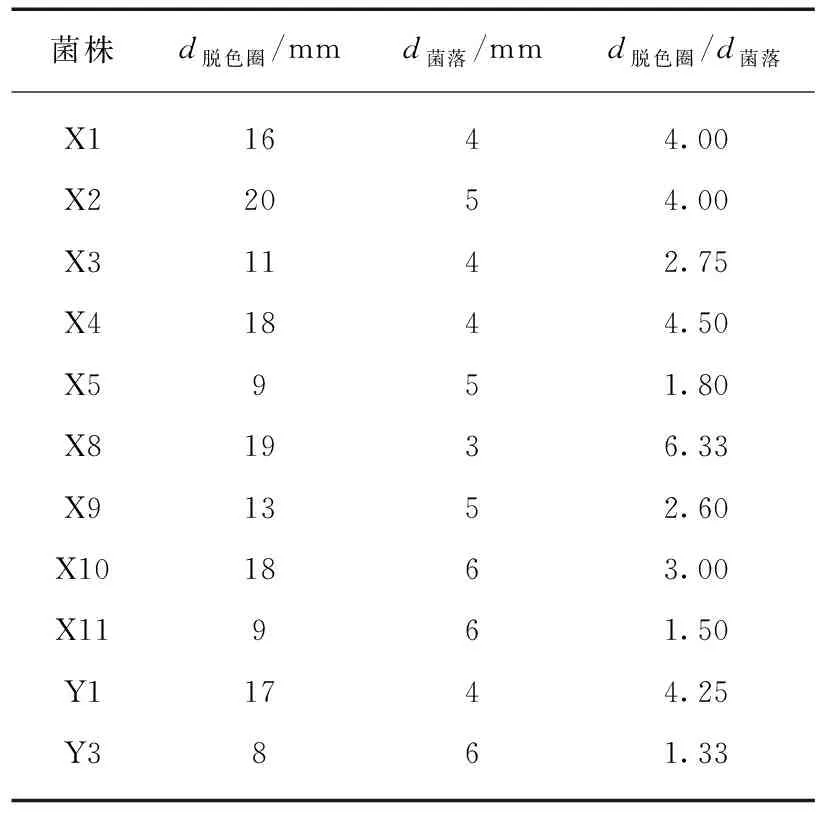
表2 各菌株脱色圈直径和菌落直径比值
2.3 纤维素有关酶活测定
将所得菌种活化后接种发酵培养基培养3 d后离心获得粗酶液,进一步测定这些菌种产生的与纤维素有关的酶活力来定量衡量其降解纤维素的能力,结果如图2所示: 羧甲基纤维素酶活力最高的菌株为Y1,酶活力达到了331.79 U/L,除此之外,X2、X8、Y1的羧甲基纤维素酶活力也较高,均达到300 U/L以上。外切葡聚糖酶活力最高的菌株为X8,酶活力达到了314.85 U/L,除此之外,外切葡聚糖酶活力较高的菌株还有X2、X5,均达到300 U/L以上。X10的β-葡聚糖酶酶活力最高,达到了307.91 U/L,X3、X5、Y3的β-葡聚糖酶酶活力也达到了290 U/L以上。滤纸酶活力最高的菌株为Y1,酶活力达到了370.52 U/L,另外超过320 U/L的菌株有X1、X2、X10、Y1。前3种酶均为纤维素降解过程中共同作用的酶,滤纸酶活力则代表纤维素相关酶总酶活力,因此选取各种酶活力都相对较高的X1、X2、X5、X8、X10、Y1、Y3组成1号混合菌种参与后续的秸秆降解混合菌实验。
2.4 木质素有关酶活的测定
将粗酶液稀释5倍后测定与木质素有关的酶活力,设空白对照计算其吸光度增加值,1个酶活力单位(U)定义为每分钟每毫升滤液吸光值增加0.1,结果如图3所示。木质素过氧化物酶活力较高的菌株有X2、X3、X5,其中最高的是X2,酶活力达到1 388 U/mL,其余的也均在1 000 U/mL以上;锰过氧化物酶活力较高的菌株有X2、X3、X5、X11、Y3,其中最高的是X2,酶活力达到316 U/mL,其余也均在200 U/mL以上;漆酶活力较高的菌株有X2、X3、X5,其中最高的是X2,酶活力达到696 U/mL,其余也均在300 U/mL以上。因此选取X2、X3、X5这3种与木质素有关的酶活力均较高的菌株组成2号混合菌种参与后续的秸秆降解混合菌实验。
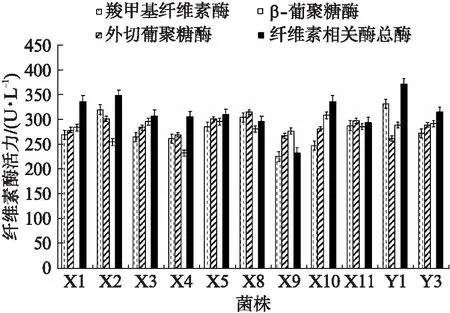
图2 菌株纤维素酶活力Fig.2 Cellulase activity of each strain底物分别为羧甲基纤维素钠、微晶纤维素、水杨苷和滤纸,DNS法测定酶活力.

图3 菌株木质素有关酶活力Fig.3 Lignin-related enzyme activities of each strain底物分别为白藜芦醇、MnSO4、ABTS,分光光度法测定酶活力.
2.5 秸秆降解及条件优化
将11个菌株接种至加入秸秆条的培养基中,以无菌水为对照,称量培养7 d后秸秆剩余干重并计算降解率,结果如图4所示。对秸秆降解效果最好的菌株为X2,达到21.64%,除此之外超过15%的菌株还有X1、X4和X5。将本实验筛选得到的混合菌(筛选混,包括X1、X2、X3、X4、X5、X8、X9、X10、X11,Y1、Y3)、2.3节中提到的1号混合菌、2.4节中提到的2号混合菌以及所有菌株混合(ALL混,包括筛选混合菌和002A,002A用于丰富菌种和改进降解效果)作为4组混合菌种,进行秸秆发酵,培养7 d后计算相对降解率,使用R分析对这4组混合菌的降解率进行统计学分析,得到结果为F=31.1>F0.05(3,8)=4.07,P=0.000 9<0.05,因此秸秆相对降解率差异显著,即这4种菌对于秸秆降解能力有差异。平均相对降解率见表3,所有菌种混合(ALL混合)降解秸秆效率最高,降解率达到了23.86%。选取最佳混合菌种即所有菌种混合菌剂,测定3种不同条件变量即发酵前菌种培养初始pH(发酵pH仍为正常值即pH=7以避免秸秆被酸性或碱性溶液腐蚀影响实验效果)、发酵温度和培养基碳源含量对秸秆降解效率的影响。菌种培养pH对秸秆降解率有显著影响,F=268.6>F0.05(4,10)=3.48,P<0.000 1,结果如图5所示。秸秆的降解率在菌种活化培养条件呈酸性和碱性的时候明显降低,随着pH值的上升,降解率先降后升,pH=7时降解效率最佳,为23.92%。碳源含量对秸秆降解率有显著影响,F=5.887>F0.05(4,10),P=0.010 6<0.05,碳源量为1 g/L 时降解率最高为24.61%。发酵温度对秸秆降解率有显著影响,F=74.21>F0.05(4,10),P<0.000 1,随着发酵温度的上升,秸秆的降解率逐渐上升然后下降,35 ℃时达到最高降解率25.08%。因此,秸秆降解的最佳条件为发酵液pH为7,发酵温度为35 ℃,培养基碳源量为1 g/L。
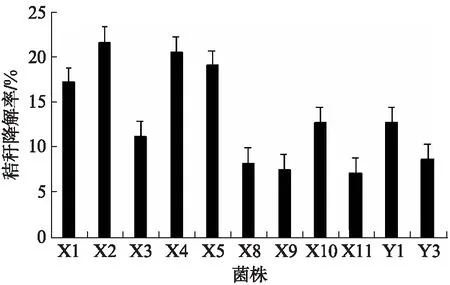
图4 菌株秸秆降解率Fig.4 Straw degradation rate of each strain
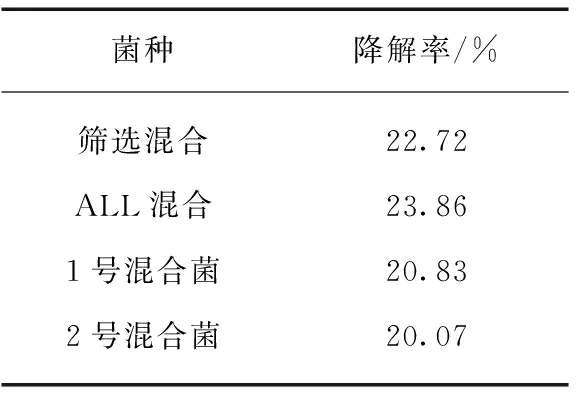
表3 混合菌秸秆降解率
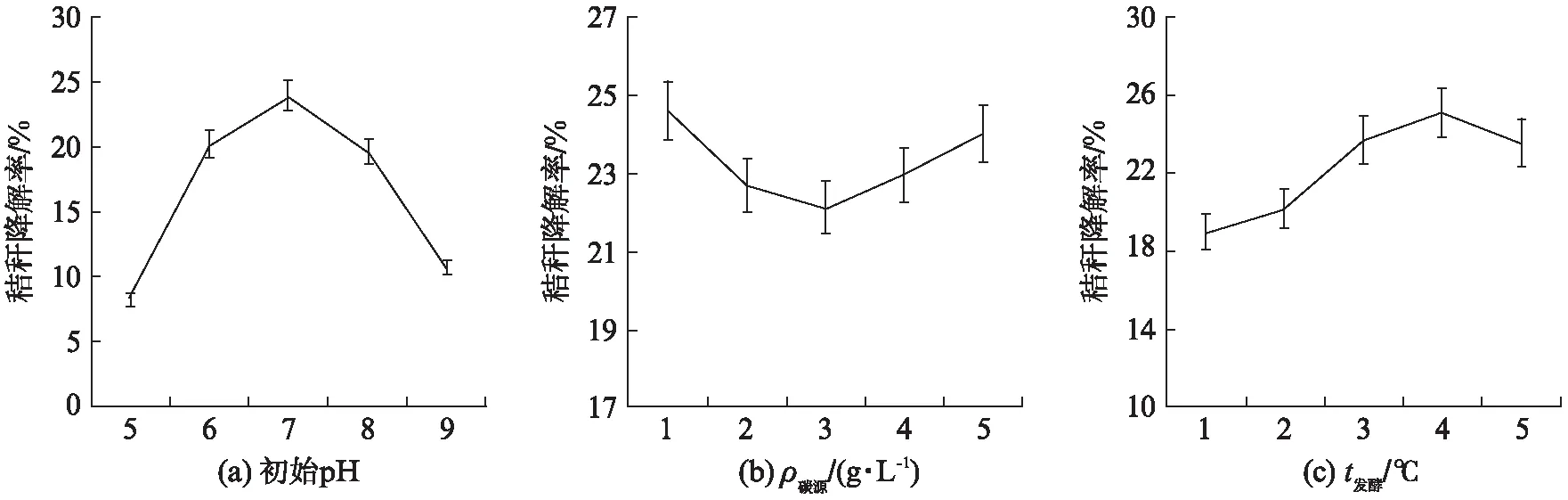
图5 3种条件变量对秸秆降解率的影响Fig.5 The influence of three condition variables on straw degradation rate发酵前菌种培养初始pH(发酵pH仍为正常值即pH=7以避免秸秆被酸性或碱性溶液腐蚀影响实验效果)分别为5,6,7,8,9;培养基碳源含量分别为1,2,3,4,5 g/L;发酵温度分别为20,25,30,35,40 ℃.
2.6 扫描电镜观察
比较最佳条件下混合菌剂发酵前后秸秆经固定干燥喷金处理后在扫描电子显微镜下的图像,尺度为200 μm,放大200倍,结果见图6.可以发现发酵前秸秆结构较为完整,表皮光滑,发酵后秸秆发生了缺刻断裂,可以看到混合菌剂对于秸秆结构具有一定的破坏能力,体现了其降解能力。
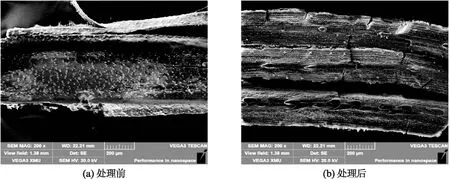
图6 发酵前后秸秆扫描电镜图像Fig.6 SEM images of straw before and after fermentation注: 尺度200 μm,放大200倍.
2.7 秸秆造纸制浆预处理
要达到后续机械操作的条件,需要将纤维细胞的细胞壁打破,让细胞吸水至饱和,使纤维比重近似于水,可以悬浮在水中。以10%浓度接种量处理大量秸秆时,所有降解秸秆混合菌种5 d处理效果最好,达到了一定的软化且并未过度腐烂。该混合菌剂后续增加接入浓度至20%或接种量10%并加入100 mL LB培养基3 d后接近接种量10%的样本6 d的效果,缩短了处理时间。目前可以达到以下处理效果: (1) 熟化秸秆,样本手感相对柔软;(2) 粉碎成造纸需要的长度后,在水中搅拌,样本有5%~10%左右的纤维悬浮在水中;(3) 20%浓度的样本搅拌后,所排出的水相对洁净。经机械处理后,接菌量为10%和20%的秸秆所制作的粗浆样本如图7所示,接菌量20%的样本较为细腻,孔隙较小,耐折度达到5~6次,灰废不超过15%,能够作为后续机械操作的原料使用。

图7 不同接菌量预处理的秸秆粗浆制片Fig.7 Preparation of coarse straw pulp pretreated with different inoculation amounts
3 讨 论
本研究采用梯度营养培养基驯化的方法来强化筛选能够降解纤维素的菌种,菌种来源于含有丰富纤维素的厨余垃圾及被其污染的水和土壤,本文实验中主要将其用于降解高纤维素含量的秸秆。微生物降解秸秆相比物理和化学方法对于环境的影响最小,符合目前环保发展的需求,避免了处理过程中造成更大的次生污染。本研究所筛选菌种均属于细菌,虽然很多真菌比如白腐真菌等降解纤维素能力很强[31],但是细菌具有环境适应能力强、数量多、种类丰富、易于获取等优势,后续还可以考虑进行遗传修饰构建工程菌株进一步提高其降解能力。本研究筛选出的菌株具有产纤维素酶及产木质素酶的能力,也可作为酶制剂的来源。
考虑到秸秆难降解的原因主要是含有纤维素和木质素,因此,将部分酶活力较高的单菌混合来处理秸秆,最终发现降解效果最佳的是所有菌种混合得到的菌剂。可能是菌种多样性提高使菌群结构更加丰富、均匀,且碳水化合物的代谢通路丰度提高,改善了其生长和产酶能力。不同的降解菌对纤维素中不同成分降解具有一定的特异性,多种菌株混合可以通过酶系互补达到产酶周期缩短、产酶能力增强、提高降解效率的效果[28],但不同菌种之间可能存在合作促进作用也可能存在竞争拮抗作用,本研究由于研究周期限制未对此作出深入探讨,但不同菌种酶系的相互作用和整体混合菌群的生态特点也可以作为后续研究的一个方向[32]。考虑到复合菌系之间的拮抗作用,一些促进秸秆降解微生物增殖的营养液作为秸秆助腐剂也能使秸秆降解效率有所提升,成为秸秆降解研究的另一出路[33]。
也有很多学者对产纤维素酶的菌种培养条件(包括碳源、氮源、金属盐、培养温度、pH值、金属离子影响、接种量和诱导物质量浓度等)进行了研究[34-36]。对秸秆降解条件的测定结果表明,培养时过酸或者过碱均会严重影响菌种生长,导致秸秆降解效果急剧下降,自然条件下混合菌剂效果最佳;适当升高温度有助于菌种快速生长和秸秆熟化降解,但是温度过高也可能影响菌种生长,降低降解效率,但是也保持在一个比较高的效率水平,在大规模堆肥处理秸秆过程中也可以考虑使用本实验得到的菌种进行辅助处理;碳源充足时,细菌生长较快因此降解秸秆效率也比较高,而适当减少碳源量会使细菌增加对秸秆的利用,因此可以实现减少资源消耗而获得较高降解效率的目的。本研究所使用混合菌剂处理秸秆的发酵条件并不苛刻,可以在自然状态下投入使用且效果较好。
本研究将纤维素降解菌初步应用于造纸制浆预处理,发现可以在较短时间内实现对于秸秆的熟化,使其吸收更多液体,纤维更符合后续机械处理的要求,也为秸秆处理应用作为造纸原料[37]提供了新的可能性。
