富贵竹过氧化物酶全长基因的克隆与表达分析
2022-06-16陈春花张松陈苗胡汉桥薛迎斌
陈春花 张松 陈苗 胡汉桥 薛迎斌

摘要 [目的]克隆富贵竹全长POD 基因,检测富贵竹感染斯氏泛菌( Pantoea stewartii )后该基因的表达。[方法]用PCR克隆富贵竹( Dracaena sanderiana )POD部分基因,用hiTAIL-PCR扩增该基因左右两侧序列。通过RT-PCR和qPCR确定POD基因在病原物侵染时的表达。[结果]获得一个长度为3 419 bp的序列,登录号为MZ450796。经基因结构预测,该序列包含1个转录起始位点、加尾信号和4个外显子。进化树分析表明,该基因编码的氨基酸序列与芦笋POD的氨基酸序列一致性最高。接种 P.stewartii 后,POD基因的表达上调,3 d达最大值。[结论]克隆了富贵竹全长POD基因,确定了POD基因在富贵竹叶片中表达和结构预测的正确性;POD基因被 P.stewartii 诱导上调表达。
关键词 富贵竹;过氧化物酶;hiTAIL-PCR;斯氏泛菌
中图分类号 Q943.2 文献标识码 A 文章编号 0517-6611(2022)11-0089-05
doi:10.3969/j.issn.0517-6611.2022.11.023
開放科学(资源服务)标识码(OSID):
Molecular Cloning and Expression Patterns of Full-length Peroxidases Gene from Dracaena sanderiana
CHEN Chun-hua1, ZHANG Song1, CHEN Miao1,2 et al
(1.College of Coastal Agricultural Sciences of Guangdong Ocean University, Zhanjiang, Guangdong 524088;2. South China Branch of National Saline-Alkali Tolerant Rice Technology Innovation Center, Zhanjiang, Guangdong 524088)
Abstract [Objective]Peroxidase (POD) plays an important role in the resistance of plant disease. The full-length POD gene was cloned and the expression of the gene was determined after Dracaena sanderiana was infected by Pantoea stewartii . [Method]The partial POD gene of D. sanderiana was cloned by PCR. HiTAIL-PCR was used to amplify the left and right parts of the POD gene. The expression of the gene was determined by RT-PCR and qPCR. [Result]A 3 419 bp sequence was obtained, the accession number was MZ450796. The sequence contained a transcription start site, a polyadenylation signal and four exons after the gene structure prediction. Phylogenetic tree analysis showed that the amino acid sequence encoded by this gene had the highest identity with that of Asparagus officinalis POD. The expression of the POD gene of D. sanderiana was up-regulated by P. stewartia and reached the maximum after 3 days. [Conclusion]The full-length POD gene is obtained. The POD gene expresses in the leaf of D. sanderiana and the predicted gene structure is correct. The expression of the POD gene of D. sanderiana was induced by P. stewartia.
Key words Dracaena sanderiana ;Peroxidase;hiTAIL-PCR; Pantoea stewartii
植物在生长过程中难免会遭遇病虫害、干旱、盐渍、机械损伤、高温、低温等逆境胁迫。生物或非生物胁迫会使植物产生活性氧物质,活性氧的过量积累会对植物体内的蛋白质、DNA与脂质等造成氧化,从而破坏其生物膜的结构和功能,对植物造成一定的伤害[1-2]。过氧化物酶(peroxidase,POD)属于一个超家族包含3种不同类型的POD:细胞内I类、真菌释放的Ⅱ类和分泌的Ⅲ类植物POD[3]。最常见的是Ⅲ类分泌型POD,其生物学功能是一种很好的活性氧清除剂,参与多种不同的生理功能,如细胞壁的合成、组织愈伤和生长素的合成与代谢等,以提高植物的抗逆性等[4-6]。POD活性与植物对细菌的抗病性具有相关性[7-9]。目前已从多种作物中克隆了POD基因,如水稻[10]、芋头[11]、甘蔗[12]、棉花[13]和烟草[14]等。B38838FF-7371-4061-8A06-23ACEAFF21C7
富贵竹( Dracaena sanderiana Sander),龙舌兰科,龙血树属,是常见常绿小乔木观赏植物,是湛江重要的花卉出口产品之一[15-16]。富贵竹叶片枯萎病是由斯氏泛菌产吲哚亚种( Pantoea stewartii subsp.Indologenes)引起的一种严重病害[16]。由于POD在植物抗病虫害、抗逆过程中起着重要作用,因此有必要对富贵竹POD基因展开相关研究。然而,有关克隆富贵竹POD基因鲜见报道。CODEHOP(consensus-degenerate hybrid oligonucleotide primer)可以根据近缘物种基因保守的氨基酸序列,并根据物种的密码子使用频率在线设计简并引物,再用PCR方法克隆未知基因[17-18],然而利用简并引物只能获得基因部分序列。高效热不对称交错PCR(high-efficiency thermal asymmetric interlaced PCR,hiTAIL-PCR),可用于扩增已知序列两侧的未知序列[19]。因此,将CODEHOP和HiTAIL-PCR结合起来,就能克隆出全长的未知基因,为研究基因的功能奠定基础。笔者通过设计簡并引物,利用PCR及hiTAIL-PCR技术,克隆富贵竹POD基因的全长序列,并用生物信息学分析该基因的序列特征,利用RT-PCR检测POD基因在富贵竹叶片中的表达特性,以期揭示该基因在叶片中的调控作用,为富贵竹的抗病研究提供理论基础。
1 材料与方法
1.1 材料
田间种植富贵竹,取新鲜嫩叶。用CTAB法提取基因组DNA;富贵竹种植于试验盆中,生长到5~7叶期时,按Zhang等[16]方法接种病原物斯氏泛菌( P.stewartii ),接种后1、2、3、4和5 d分别取每株富贵竹上最嫩叶片,立即置于液氮中,于-80 ℃保存备用,用于提取RNA。
1.2 方法
1.2.1 POD 全长基因的克隆。
利用POD基因的简并引物icode-POD-A2和icode-POD-C16(表1)[11],从富贵竹基因组DNA中扩增目标基因,克隆到pMD-18T载体(TaKaRa公司)上,测序后得到POD基因的部分序列。根据POD基因部分序列,设计反向引物POD-0a、POD-1a和POD-2a以及POD-0b、POD-1b和POD-2b,采用hiTAIL-PCR技术分别扩增富贵竹POD基因两侧的DNA。所用的引物见表1。将两侧的DNA分别克隆到pMD-18T载体(TaKaRa公司)上,测序后得到POD基因的两侧序列,经拼接后得到POD基因的全长序列。
1.2.2 基因序列的生物信息学分析。
用DNAstar软件对所克隆的基因片段进行拼接,获得了全长POD基因,用NCBI(http:∥www.ncbi.nlm.nih.gov)网站进行Blast分析。在Softberry(http://www.softberry.com/)中选择植物基因组基因预测软件,并选择单子叶植物作为参考基因组,预测基因的结构。利用NCBI中BLASTP工具查找POD同源蛋白氨基酸序列,利用Mega 6.0软件对不同生物的POD同源基因编码氨基酸序列进行多重序列比对,构建系统发育树。
1.2.3 RNA的分离及RT-PCR分析。
用TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa)提取总RNA。用PrimeScriptTM RT-PCR Kit(Takara)进行RT-PCR检测。POD-2F、POD-3R和POD-3F、POD-4R引物用于POD基因检测在叶片中的表达及预测基因结构是否正确。用SYBR Premix Ex TaqTM II kit(Takara)进行基因的荧光定量分析POD基因在病原物感染后表达情况。18S rRNAF和18S rRNAR作为qPCR的参考基因[20],POD-3F和POD-4R用作检测POD基因的表达量,RT-PCR及qPCR所用的引物见表1。采用2-ΔΔCt方法计算基因的相对表达量[21],重复3次。POD基因表达的差异性检验使用最小显著差异LSD( P <0.05)。
2 结果与分析
2.1 POD 全长基因的克隆
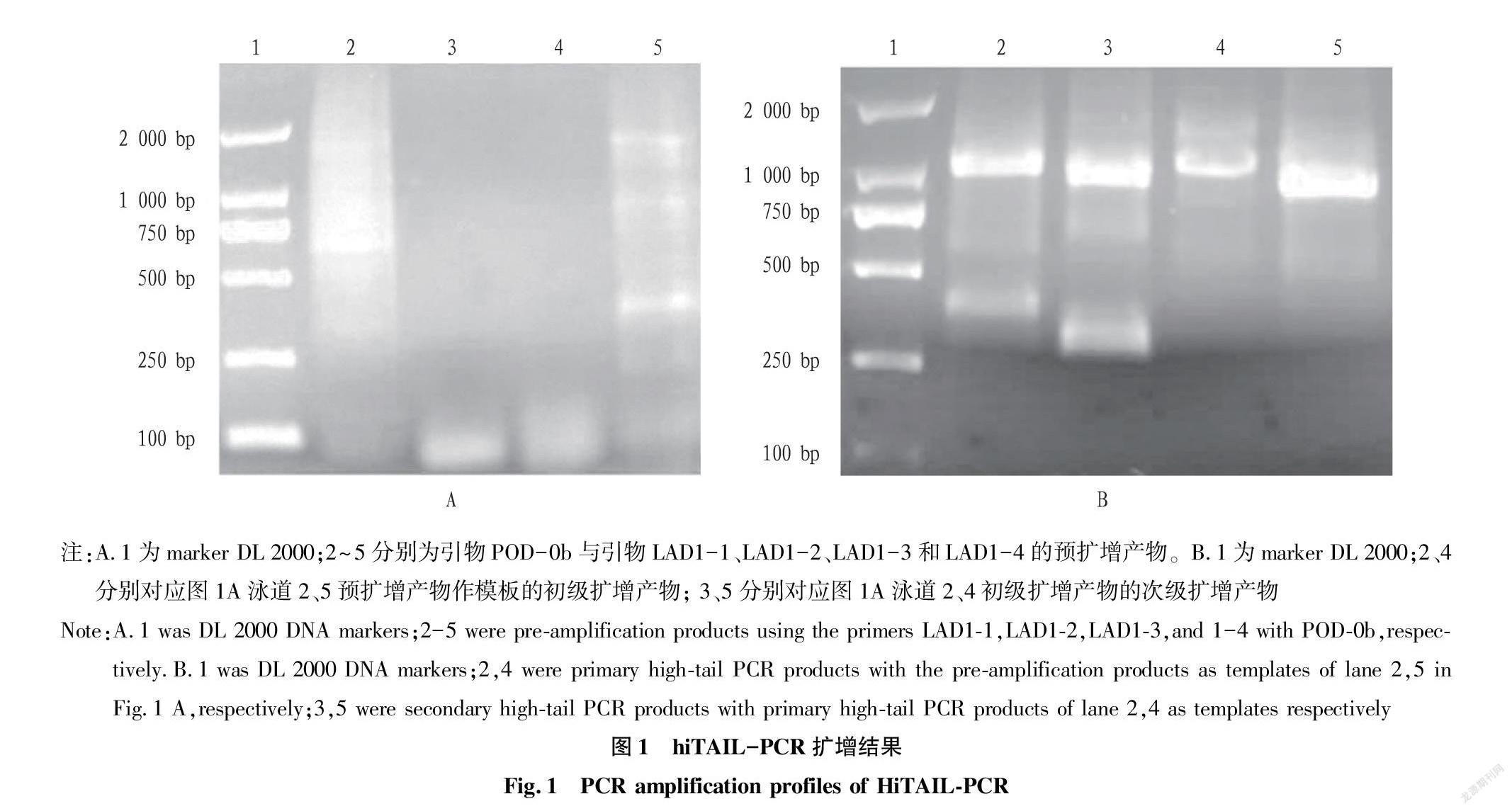
利用简并引物icode-POD-A2和icode-POD-C16从富贵竹的基因组中扩增出约1 500 bp的产物。克隆到载体后,得到1 501 bp的序列。将基因的核苷酸序列进行Blast同源性分析,结果表明:在2%覆盖率下,与大麦POD基因的核苷酸序列有97.22%的一致性;在15%的覆盖率下,与短柄草POD基因的核苷酸序列有71.79%的一致性。说明克隆到的序列为富贵竹的POD基因,但与其他物种的POD基因序列差异较大。为了克隆出富贵竹POD基因的全长序列,利用基因的部分序列设计hiTail-PCR引物,扩增该基因的左右两侧DNA。POD-0b与LAD1-1和LAD1-4引物的组合进行预扩增,扩增出拖带DNA,其间有弱的DNA条带(图1A)。将预扩增产物稀释后作为模板,用POD-1b引物分别与AC1引物进行初级扩增,经检测后均出现条带;将初级扩增产物稀释后作为模板,用POD-2b和引物AC1进行次级扩增,经检测后出现特异性条带。POD-2b扩增产物的大小比POD-1b扩增的条带小,与预期设计引物的结果相符合(图1B)。将图1B中3和5的次级扩增产物分别克隆到T载体中,筛选阳性菌,提取重组质粒测序。POD基因的序列能与简并引物扩增基因的序列拼接到一起,说明克隆出POD基因的一侧基因。同样用POD-0a、POD-1a和POD-2a成功地克隆了基因另一侧,所获得的序列与简并引物扩增基因的序列拼接到一起,经拼接后得到一个长度为3 419 bp的序列。经Blast同源性分析,在覆盖率5%的情况下,该全长基因与芦笋的POD基因序列一致性为79.80%,表明该序列为POD基因。B38838FF-7371-4061-8A06-23ACEAFF21C7
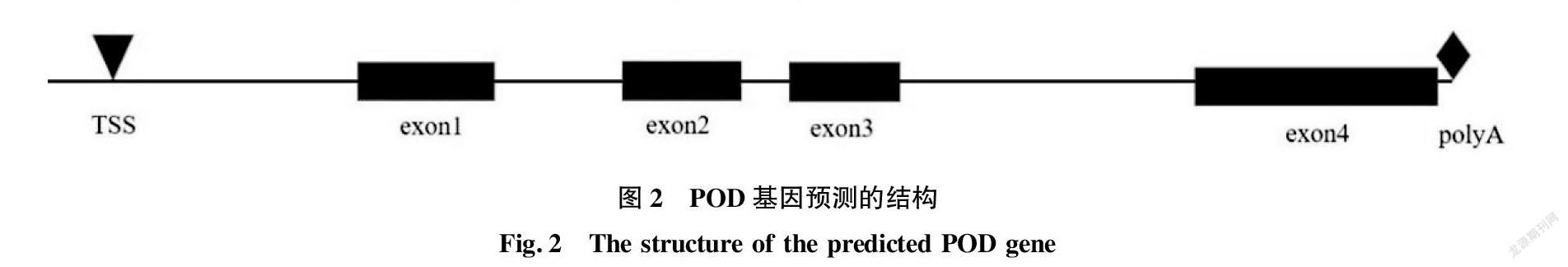
在softberry 网站上选择玉米作为参考基因序列,进行基因结构预测,预测的基因结构如图2所示。该基因包括 4 个外显子,分别位于 788~985、1 200~1 391、1 474~1 639和2 128~2 519 bp处。该基因在371 bp处有一个转录起始位点(transcriptional start site,TSS),在2 450 bp处有加尾信号(polyA)。因此,该序列包括一个完整的启动子和加尾信号,是一个全长基因,接收号为MZ450796。
用该基因的氨基酸序列进行Blast搜索,获得与该基因同源的其他植物蛋白氨基酸序列,用Mega 6.0软件构建进化树,结果见图3。该基因的氨基酸与芦笋POD的氨基酸序列同源性最高,聚为一类。在覆盖率100%时,芦笋POD氨基酸序列的一致性为74.30%,进一步证明拼接后的序列为富贵竹POD基因。说明成功克隆出富贵竹POD的全长基因。
2.2 POD 基因的表达
根据预测的基因结构,引物POD-2F和POD-3R预计从基因组中扩增387 bp的片段,从cDNA中扩增305 bp片段;引物POD-3F和POD-4R预计从基因组中扩增679 bp的片段,从cDNA中扩增191 bp片段。用RT-PCR检测基因在叶片中的表达,结果见图4。从图4可以看出,第2、3泳道的产物与预期的191 bp和679 bp相近,第4、5泳道的产物与预期的305 bp和387 bp相近。RT-PCR中扩增的产物都有一条带的大小与基因组扩增的大小相近,其原因是提取RNA后,没有用DNA酶降解RNA中基因组DNA。结果表明,POD基因在叶片中表达且克隆出的全长基因预测结构是正确的。
根据RT-PCR的结果,选择从cDNA中扩增大小为191 bp的POD-3F和POD-4R进行荧光定量PCR。提取接种后1、2、3、4和5 d富贵竹嫩叶的RNA,用无RNA酶的DNA酶降解RNA中残留的基因组DNA后,用18S rRNA作参照基因进行qPCR,结果见图5。从图5可以看出,POD基因的表达在接种 P.stewartii 后表达量上升,到接种3 d,其相对表达量达最大值6.63,之后POD基因的表达开始下降。因此,POD基因的表达受病原物诱导表达。
3 讨论
过氧化物酶(POD)在植物正常生长和应激反应中发挥着重要作用,是植物重要的保护酶类,在高等植物中分布较为广泛。因此,克隆植物POD基因并研究其功能具有重要意义。当前随着三代测序技术的发展,可以迅速完成对植物基因组的高深度测序,从而获得该物种大量的基因序列[22],但植物基因组测序仍存在倍性和杂合度的挑战,且成本较高。因此,从植物基因组中克隆出基因仍具有广泛的应用前景,且目前在许多植物中已经克隆到POD基因的报道。其中有根据物种已有POD基因的序列,设计特异性引物扩增基因或基因的cDNA[12,14,23-24]。然而目前尚缺乏富贵竹POD基因序列。在芋头中,在没有基因序列的情况下,利用CODEHOP设计简并引物扩增了POD基因,并用HiTAIL-PCR获得芋头POD部分基因[11]。该研究利用POD基因简并引物从富贵竹中扩增出POD的部分基因,利用hiTAIL-PCR技术成功克隆出该基因的侧翼序列,成功克隆出包含全部启动子和加尾信号的POD全长基因。
用RT-PCR方法定性地證实了POD基因在叶片中表达。叶片在植物的抗病虫、抗逆过程中具有重要功能,因此POD基因在叶片中的表达可能在这些过程中起着重要作用。在RT-PCR中,由于在提取RNA时经常有DNA的污染。在不同的外显子上设计引物,并用基因组扩增产物作对照,扩增产物与基因组的扩增产物大小,与预期从cDNA上扩增产物大小一致。一方面证实了RT-PCR的产物是来自cDNA,是基因表达的真实产物,同时也证实了预测POD基因结构的准确性。水稻的4个POD基因,只有2个被黄单孢杆菌诱导表达,接种12~24 h表达量达最大,然后逐渐下降[7]。 甜橙的12个POD基因,在感病品种被黄单孢杆菌感染后,2个POD表达上升,接种48 h表达量达到最大值,然后逐渐下降[9]。从富贵竹中克隆的POD基因接种 P.stewartii 后表达量上升,3 d时相对表达量达最大值,然而之后逐渐下降,说明该POD基因被病原物诱导表达,可能与富贵竹的抗病性有关。
4 结论
通过简并引物扩增并克隆了富贵竹 POD 部分基因,利用已克隆的 POD 基因部分序列设计 hiTAIL-PCR 引物扩增该基因左右两侧DNA,最终获得一个长度为 3 419 bp 的序列。经基因结构预测,该序列包含 1 个转录起始位点、加尾信号和 4 个外显子。该基因编码的氨基酸序列与芦笋 POD 的氨基酸序列一致性最高,获得了 POD 全长基因。通过 RT-PCR 确定了 POD 基因在富贵竹叶片中表达,并确定了基因结构预测的正确性。qPCR 结果表明,POD 基因被 P.stewartii 诱导上调表达。
参考文献
[1] MITTLER R.Oxidative stress,antioxidants and stress tolerance [J].Trends in plant science,2002,7(9):405-410.
[2] APEL K,HIRT H.Reactive oxygen species:Metabolism,oxidative stress,and signal transduction [J].Annual review of plant biology,2004,55:373-399.
[3] WELINDER K G.Superfamily of plant,fungal and bacterial peroxidases [J].Current opinion in structural biology,1992,2(3):388-393.B38838FF-7371-4061-8A06-23ACEAFF21C7
[4] HIRAGA S,YAMAMOTO K,ITO H,et al.Diverse expression profiles of 21 rice peroxidase genes [J].FEBS letters,2000,471(2/3):245-250.
[5] HIRAGA S,SASAKI K,ITO H,et al.A large family of class III plant peroxidases [J].Plant cell physiology,2001,42(5):462-468.
[6] TOGNOLLI M,PENEL C,GREPPIN H,et al.Analysis and expression of the class III peroxidase large gene family in Arabidopsis thaliana [J].Gene,2002,288(1/2):129-138.
[7] CHITTOOR J M,LEACH J E,WHITE F F.Differential induction of a peroxidase gene family during infection of rice by Xanthomonas oryzae pv.Oryzae[J].Molecular plant-microbe interactions,1997,10(7):861-871.
[8] SHIGETO J,TSUTSUMI Y.Diverse functions and reactions of class III peroxidases[J].New phytologist,2016,209(4):1395-1402.
[9] LI Q,DOU W F,QI J J,et al.Genomewide analysis of the CIII peroxidase family in sweet orange( Citrus sinensis )and expression profiles induced by Xanthomonas citri subsp. citri and hormones[J/OL].Journal of genetics,2020,99(1)[2021-04-18].https://link.springer.com/article/10.1007/s12041-019-1163-5.
[10] PASSARDI F,LONGET D,PENEL C,et al.The class Ⅲ peroxidase multigenic family in rice and its evolution in land plants[J].Phytochemistry,2004,65(13):1879-1893.
[11] 莫俊杰,梁钾贤,胡汉桥,等.芋头过氧化物酶基因克隆[J].广东农业科学,2016,43(9):37-43.
[12] 苏亚春,王竹青,李竹,等.甘蔗过氧化物酶基因 ScPOD02 的克隆与功能鉴定[J].作物学报,2017,43(4):510-521.
[13] 郭媖,郭旺珍,张天真.两个陆地棉过氧化物酶cDNA的克隆和鉴定[J].作物学报,2007,33(6):891-897.
[14] 杨尚谕,李立芹,陈倩,等.烟草过氧化物酶基因 NtPOD1 的克隆及表达模式分析[J].华北农学报,2018,33(3):106-112.
[15] 刘付东标.富贵竹室内加工技术研究[J].园艺学报,2002,29(4):389-391.
[16] ZHANG S,XU Z Y,LE R,et al.First report of leaf blight wilt on Dracaena sanderiana by Pantoea stewartii subsp.indologenes in China[J].Plant disease,2020,104(6):1854.
[17] BOYCE R,CHILANA P,ROSE T M.iCODEHOP:A new interactive program for designing COnsensus-DEgenerate Hybrid Oligonucleotide Primers from multiply aligned protein sequences[J].Nucleic acids research,2009,37:W222-W228.
[18] ROSE T M,HENIKOFF J G,HENIKOFF S.CODEHOP(COnsensus-DEgenerate hybrid oligonucleotide primer)PCR primer design [J].Nucleic acids research,2003,31(13):3763-3766.
[19] LIU Y G,CHEN Y L.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].BioTechniques,2007,43(5):649-656.
[20] MANOLI A,STURARO A,TREVISAN S,et al.Evaluation of candidate reference genes for qPCR in maize[J].Journal of plant physiology,2012,169(8):807-815.
[21] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔ C T Method[J].Methods,2001,25(4):402-408.
[22] 陳勇,柳亦松,曾建国.植物基因组测序的研究进展[J].生命科学研究,2014,18(1):66-74.
[23] 乔枫,耿贵工,曾阳,等.枸杞抗坏血酸过氧化物酶基因的克隆与表达分析[J].中国农业大学学报,2019,24(4):64-72.
[24] 朱海生,刘建汀,王彬,等.丝瓜过氧化物酶基因的克隆及其在果实褐变中的表达分析[J].农业生物技术学报,2018,26(1):43-52.B38838FF-7371-4061-8A06-23ACEAFF21C7
