外源甘露醇复壮草菇退化菌株的研究
2022-06-15程志虹王文沛谭强飞张凡红贠建民赵风云
程志虹,王文沛,谭强飞,张凡红,贠建民,赵风云
(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)
草菇(Volvariellavolvacea),又名稻草菇、中国菇,是我国重要的栽培食用菌之一[1]。据中国食用菌协会统计,草菇年产量由2010年的33.08万t降至2019年的23.43万t,下降了29.17%。究其原因,可能与草菇不耐低温储藏,较其他食用菌更容易退化有关[2]。因此,寻找一种简单高效地复壮草菇退化菌种的方法是草菇产业亟待解决的关键问题。
菌种退化是指食用菌由于恶劣的外界环境、病毒侵害或传代次数过多等原因,导致产量、品质、抗性等降低的变化。菌种退化是食用菌生产中普遍存在的现象,严重限制了食用菌产业的发展并降低了它们的生物利用价值[3]。KIM等[4]发现金针菇退化菌株的菌丝生长缓慢、子实体很少或没有子实体。王巧莉等[5]研究发现草菇退化菌株的气生菌丝密度稀疏、菌丝生长速度及基质降解酶活力显著降低。
碳源是食用菌重要的营养源之一,为食用菌的生长发育提供能量。食用菌长期使用相同的碳源,可能会导致菌丝营养吸收能力降低,加速菌种退化。通过更换碳源,会一定程度上刺激菌丝代谢,从而提高菌丝对碳源的吸收能力。培养基中常使用的碳源有葡萄糖、蔗糖、甘露醇、海藻糖、麦芽糖、果糖和可溶性淀粉等。牛宇等[6]发现白灵菇以甘露醇为碳源时的菌丝生物量最大,蔗糖和麦芽糖次之。谢永等[7]发现可溶性淀粉是秀珍菇生长的最佳碳源,其次为葡萄糖和果糖。
组织分离是指通过切取子实体、菌核或菌索的1块组织来获取纯培养的方法。生产上常用组织分离法进行食用菌菌种的提纯和复壮,但过多的组织分离会导致菌种的退化。本文以连续组织分离法获得的草菇退化菌株为试验材料,用同等碳量的6种碳源代替传统马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)中的葡萄糖,筛选出复壮效果较好的培养基碳源,并结合草菇菌丝体的生理性状、色度培养基(liquid medium supplemented with bromothymol blue and lactose,LBL)脱色能力及基质降解相关酶活力指标的测定,为草菇及其他食用菌退化菌种的复壮研究提供理论依据和技术支持。
1 材料与方法
1.1 菌种
原种(D0),草菇V844保藏于甘肃农业大学食品科学与工程学院。
继代菌种(D1-D3),由课题组前期通过组织分离继代法获得;D1,连续组织分离继代6次,产量降低7.89%;D2,连续组织分离继代12次,产量降低35.46%;D3,连续组织分离继代18次,产量降低90.75%。
1.2 实验方法
1.2.1 培养基制备
对照组培养基PDA(g/L):马铃薯200,葡萄糖20,KH2PO41,MgSO41,琼脂粉20。
处理组培养基:将对照组中的20 g/L葡萄糖分别替换为同等碳量的19 g/L海藻糖、20 g/L甘露醇、19 g/L蔗糖、20 g/L果糖、20 g/L麦芽糖及18 g/L可溶性淀粉。
色度培养基LBL(g/L):马铃薯200、乳糖20、NH4NO32、KH2PO41.5、MgSO40.5、溴百里香酚蓝(bromothymol blue, BTB)0.06。
酶活测定培养基(g/L):粉碎的棉籽壳10,酵母抽提物5,KH2PO40.6,MgSO40.5。
1.2.2 草菇菌丝生理性状测定
气生菌丝密度:将菌株D0~D3统一活化并培养3 d后,观察并拍照记录气生菌丝密度。
菌丝生长速度(mm/h):参照文献[8]的方法。将D0~D3统一活化并培养72 h后,在培养皿上通过十字交叉法划线标记草菇菌落直径,计算菌丝生长速度。
菌丝生物量(g):参照REN等[9]的方法。将菌株D0~D3统一活化并培养3 d后,收集菌丝,用蒸馏水洗涤3次后在60 ℃下干燥至恒重并称重。
1.2.3 LBL脱色能力测定
参照CHEN等[10]的方法。将5块直径1 cm的菌丝琼脂接种到100 mL LBL中,并取5块同样的空白琼脂作为空白组。在黑暗中30 ℃、110 r/min摇瓶培养6 d,观察颜色变化。
1.2.4 相关酶活力的测定
粗酶液的制备:将活化好的草菇菌丝33 ℃、180 r/min摇床培养8 d,取适量发酵液,4 ℃,10 000 r/min离心10 min,取上清液即为粗酶液。
滤纸酶(filter paper activity,FPA)和内切葡聚糖酶(endoglucanase,EG)活力的测定参照GHOSE[11]的方法;外切葡聚糖酶(exoglucanase,CBH)和β-葡萄糖苷酶(β-glucosidase activity,BGL)活力的测定参照孟建宇等[12]的方法;漆酶(laccase,Lac)活力的测定参照CHEN等[13]的方法;锰过氧化物酶(manganese peroxidase,MnP)活力的测定参照BILAL等[14]的方法;半纤维素酶(hemicellulase,HMC)活力的测定参照崔堂武等[15]的方法;木聚糖酶(xylanase,Xyl)活力的测定参照韦赟等[16]的方法。
1.2.5 数据处理
采用Excel 2019进行数据统计处理,采用Origin 2018软件作图,采用SPSS 26.0统计软件对数据进行显著性分析。
2 结果与分析
2.1 培养基碳源对草菇气生菌丝密度的影响
如图1所示,随着继代次数的增加,对照组气生菌丝密度呈现先上升后下降的趋势。更换培养基碳源后,甘露醇、海藻糖和蔗糖处理组的气生菌丝密度均明显大于对照组,可溶性淀粉、麦芽糖、果糖处理组小于对照组。
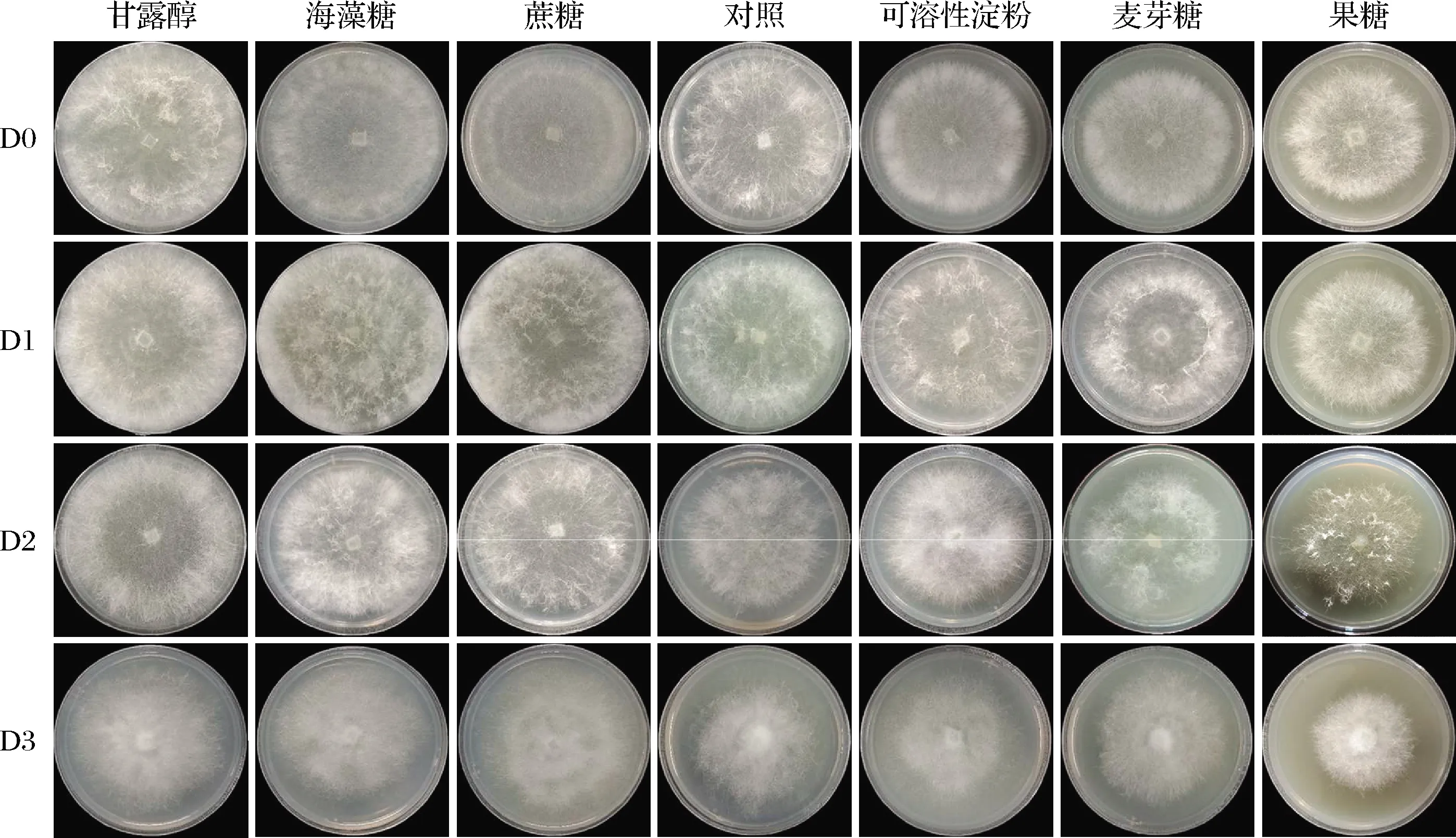
图1 不同碳源对草菇气生菌丝密度的影响Fig.1 Effects of different carbon sources on the density of mycelium of V.volvacea
2.2 培养基碳源对草菇菌丝生长速度和生物量的影响
如图2所示,对照组和处理组的菌丝生长速度和生物量的大小顺序依次为:甘露醇>海藻糖>蔗糖>对照>可溶性淀粉>麦芽糖>果糖。在甘露醇处理组中,D0、D1、D2和D3的菌丝生长速度较对照组分别提高了13.67%、14.17%、24.89%、11.50%;菌丝生物量较对照组分别提高了55.03%、53.79%、105.19%、59.26%。甘露醇对D2菌株的菌丝性状恢复最好。初筛试验表明,甘露醇处理组的复壮效果最好,选择甘露醇处理组对D0~D3作进一步的研究。
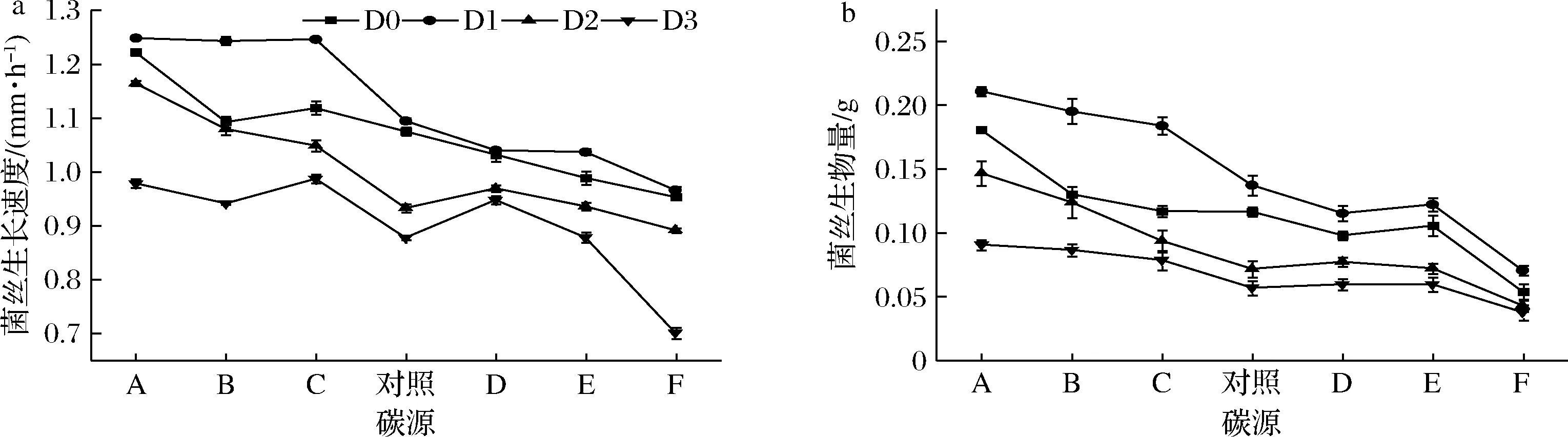
A-甘露醇;B-海藻糖;C-蔗糖;D-可溶性淀粉;E-麦芽糖;F-果糖 a-菌丝生长速度;b-菌丝生物量图2 不同碳源对草菇菌丝生长速度及生物量的影响Fig.2 Effects of different carbon sources on mycelium growth rate and biomass of V.volvacea
2.3 添加甘露醇对LBL脱色能力的影响
LBL脱色法可以一定程度上判断菌丝的活力和菌种退化程度。如图3所示,草菇菌株D0和D1的脱色能力较强,培养基颜色呈淡黄色;甘露醇处理组和对照组培养基颜色无明显变化。D2的脱色能力下降,对照组培养基的颜色加深,甘露醇处理组的颜色可恢复到淡黄色。D3的脱色能力最差,对照组培养基的颜色呈现出深绿色;更换为甘露醇碳源后,脱色能力较对照组增强,但培养基的颜色未能恢复至淡黄色。

图3 LBL脱色能力的变化Fig.3 Change of decolorization ability of LBL
2.4 添加甘露醇对基质降解酶活力的影响
2.4.1 纤维素降解相关酶活力的变化
如图4所示,随着继代次数的增加,FPA、EG活力显著降低,BGL、CBH活力没有明显变化。更换为甘露醇碳源后,D1~D3的FPA、EG活力均有显著升高(P<0.05),D1的酶活力分别提高了8.35%、11.74%,D2分别提高了62.26%和50.26%,D3分别提高了58.16%、57.08%。而BGL、CBH活力变化不显著(P>0.05)。甘露醇处理组对D1~D3的FPA、EG活力的恢复效果较好。
2.4.2 木质素降解相关酶活力的变化
如图5所示,随着继代次数的增加,Lac、MnP活力均呈现先上升后下降的趋势。更换为甘露醇碳源后,Lac、MnP活力除D1外均显著提高(P<0.05);D0分别提高了7.79%、17.08%,D2分别提高了35.68%、206.46%,D3分别提高了219.40%、291.72%。甘露醇处理组对D2、D3的木质素降解相关酶活力恢复效果较好。
2.4.3 半纤维素降解相关酶活力的变化
对D0~D3的半纤维素降解相关酶活力进行测定,结果如图6所示。随着继代次数的增加,HMC活力呈现先上升后下降的趋势,而Xyl活力呈现下降趋势。2种酶活力在甘露醇处理组和对照组之间均无显著差异(P>0.05)。
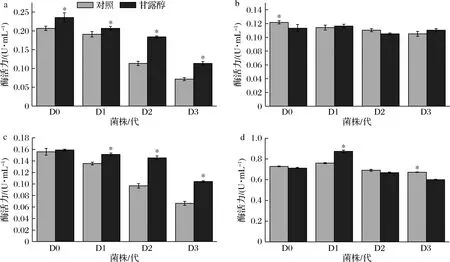
a-FPA;b-BGL;c-EG;d-CBH图4 纤维素降解相关酶活力的变化Fig.4 Changes in cellulose degradation-related enzymes activity 注:*代表同组内有显著性差异(P<0.05) (下同)
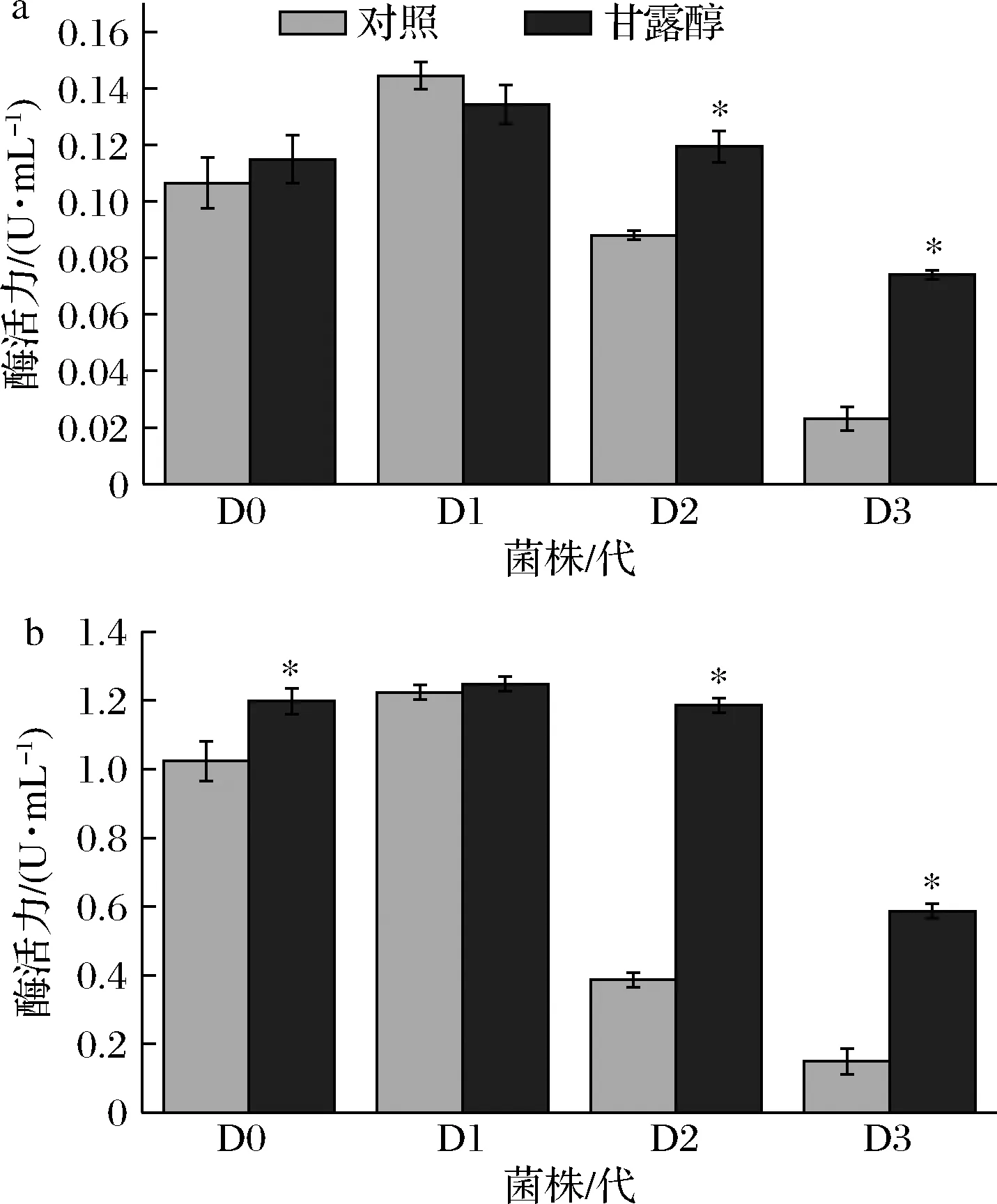
a-Lac;b-MnP图5 木质素降解相关酶活力的变化Fig.5 Changes in lignin degradation-related enzymes activity
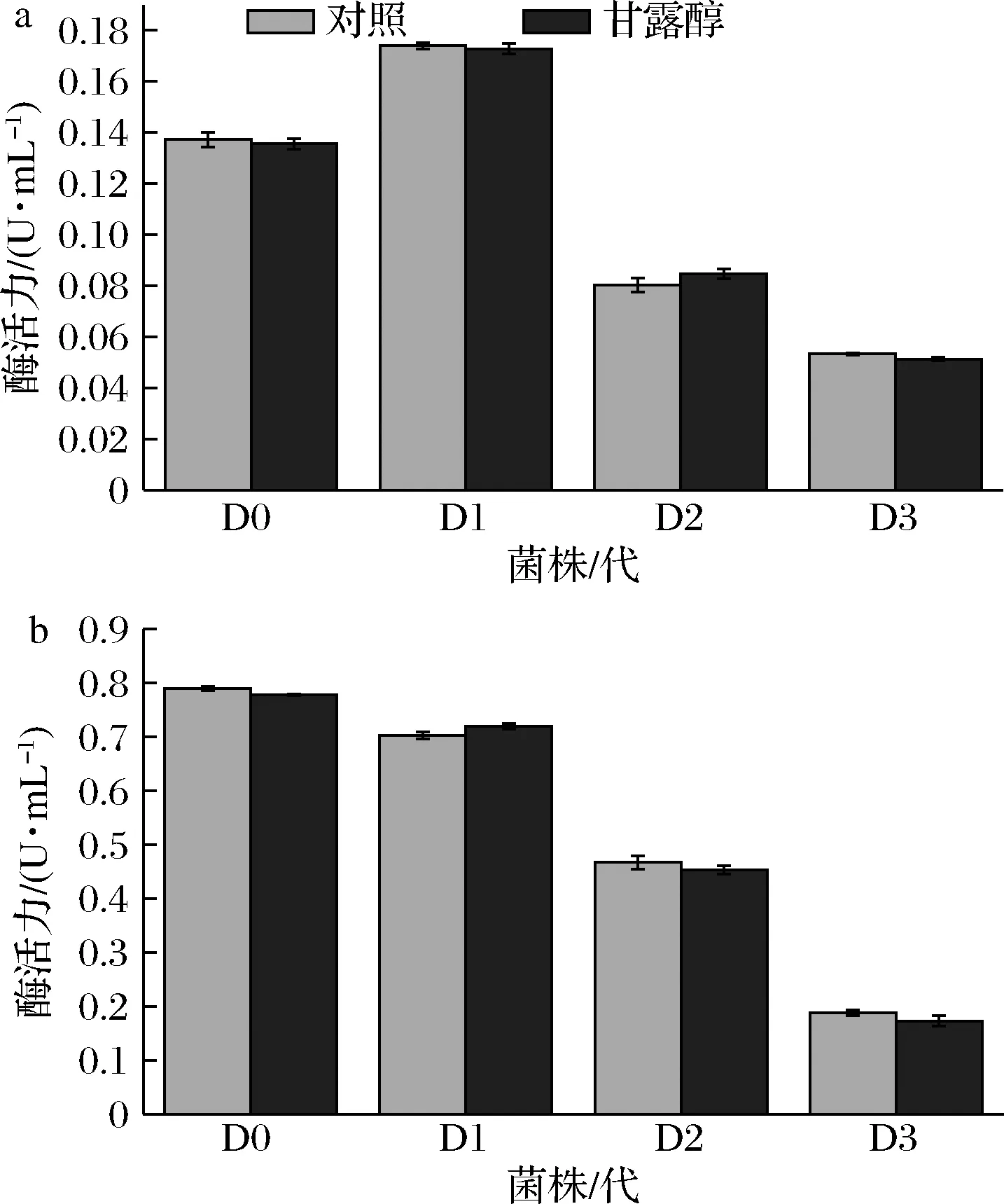
a-HMC;b-Xyl图6 半纤维素降解相关酶活力的变化Fig.6 Changes in hemicellulose degradation-related enzymes activity
3 讨论
MAGAE等[3]证实了金针菇退化菌株的LBL培养基脱色能力显著低于正常菌株。林清泉等[17]发现蛹虫草退化菌株在LBL培养基上的脱色能力变弱。CHEN等[10]发现草菇菌丝体继代菌株随继代次数的增加,其LBL脱色能力也随之降低。本研究与之有相同结论。LBL培养基中通常以BTB作为指示剂,其在酸性环境中会变黄。在发酵过程中,菌株会代谢产生有机酸、氨基酸、CO2等物质,这些物质具有高溶解度,并产生游离H+,使发酵液的pH降低。当菌株发生退化时,菌株发酵代谢能力降低,发酵液pH值升高、颜色变深,脱色能力随之降低[18]。本研究利用甘露醇代替PDA中的葡萄糖后,草菇退化菌株D2、D3的LBL脱色能力显著增加(图3),表明D2、D3的发酵代谢能力得到有效恢复,甘露醇对草菇退化菌株有较好的复壮效果。
甘露醇是一种天然的六碳糖醇,易溶于水,广泛存在于真菌的孢子、子实体和菌丝体中[19]。甘露醇在子囊菌和担子菌中承担着调节渗透压、清除活性氧等重要的生物学功能[2]。PATEL等[20]发现甘露醇是良好的抗氧化剂,能保护真菌细胞免受活性氧侵害。WEINSTEIN等[21]发现嗜冷真菌Humicolamarvinii中的甘露醇含量明显增多,以帮助菌株抵御低温胁迫。ZHAO等[2]发现,在草菇栽培中添加甘露醇可以增加子实体的低温耐受性。本研究发现甘露醇对退化程度较轻的D1、D2菌株的复壮效果较好,多数指标能基本达到D0水平;而对退化程度较重的D3菌株虽然也有一定的恢复作用,但无法恢复到D0状态。
草菇是典型的草腐菌,栽培原料一般为废棉、稻草和棉籽壳等,这些物质的主要成分为纤维素、半纤维素和木质素[22]。草菇分泌相关酶将这些基质分解为小分子物质,以满足自身生长、发育和繁殖的需要[23]。纤维素的分解先由EG将长链的纤维素裂解成较短的寡糖,再由CBH进一步降解为纤维二糖,最后由BGL分解为D-葡萄糖[24]。半纤维素的主要成分为木聚糖,Xyl可以将长链木聚糖水解成短链的低聚木糖,再进一步降解为木糖等小分子[25]。木质素的降解主要依赖于Lac和MnP,最终生成酚类单体等小分子化合物[22]。
本研究中以棉籽壳为基质进行相关酶活力的测定。结果表明,添加甘露醇为碳源后,草菇退化菌株D1~D3的FPA、EG活力显著提高(图4),D2、D3的Lac和MnP活力显著提高(图5)。可能是由于甘露醇具有较高的抗氧化性和抗逆性[2],有效清除了草菇退化菌株中积累的大量活性氧,从而使菌株分泌基质降解酶的能力提高[26],为草菇菌丝提供葡萄糖等营养,促进了草菇菌丝生长速度加快、气生菌丝密度和菌丝生物量增加(图7)。半纤维素通过共价键和氢键与木质素分子紧密相连,将纤维素包裹在其中,只有当木质素被分解后,化学键断裂,纤维素才能暴露出来,被进一步酶解;木质素的降解成为自然界碳循环的限速步骤[27]。而半纤维素对该过程没有起到决定性作用且含量较低,对草菇菌丝作用不显著,可能是半纤维素降解相关酶活力变化较小的原因。具体机理还有待于进一步研究。
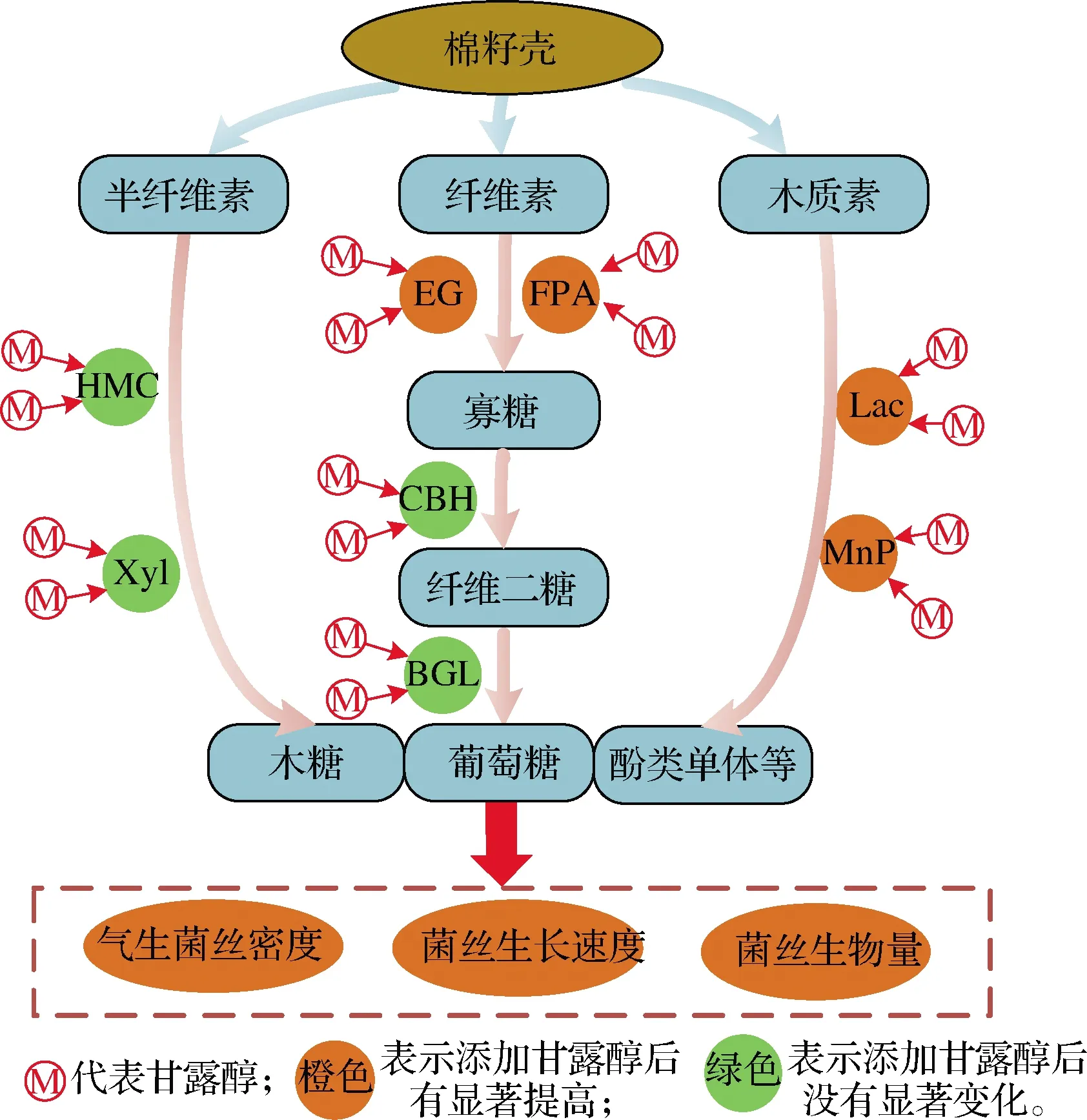
图7 外源添加甘露醇复壮草菇退化菌株的通路图Fig.7 Pathway diagram of exogenous addition of mannitol to rejuvenate degraded strains of V.volvacea
[1] BAO D P, GONG M, ZHENG H J, et al.Sequencing and comparative analysis of the straw mushroom (Volvariellavolvacea) genome[J].PLoS One, 2013, 8(3):e58294.
[2] ZHAO X, YU C X, ZHAO Y, et al.Changes in mannitol content, regulation of genes involved in mannitol metabolism, and the protective effect of mannitol onVolvariellavolvaceaat low temperature[J].BioMed Research International, 2019, 2019:1493721.
[3] MAGAE Y, AKAHANE K, NAKAMURA K, et al.Simple colorimetric method for detecting degenerate strains of the cultivated basidiomyceteFlammulinavelutipes(Enokitake)[J].Applied and Environmental Microbiology, 2005, 71(10):6 388-6 389.
[4] KIM S Y, KIM K H, IM C H, et al.Identification of degenerate nuclei and development of a SCAR marker forFlammulinavelutipes[J].PLoS One, 2014, 9(9):e107207.
[5] 王巧莉, 孔梓璇, 谭强飞, 等.草菇组织分离继代中菌种退化对相关酶活力的影响[J].食品与发酵工业, 2021, 47(8):1-5.
WANG Q L, KONG Z X, TAN Q F, et al.Effects of strain degradation on the activities of related enzymes in tissue separation and subculture ofVolvariellavolvacea[J].Food and Fermentation Industries, 2021, 47(8):1-5.
[6] 牛宇, 蒙秋霞, 聂建军, 等.不同碳源对7个白灵菇品种菌丝生长的影响[J].中国食用菌, 2017, 36(6):27-32.
NIU Y, MENG Q X, NIE J J, et al.Effect of different carbon sources on mycelial growth of sevenPleurotuseryngiivar.tuoliensisstrains[J].Edible Fungi of China, 2017, 36(6):27-32.
[7] 谢永, 谌金吾, 宋吉玲, 等.秀珍菇母种培养基最佳碳、氮源探究[J].耕作与栽培, 2020, 40(4):31-33.
XIE Y, CHEN J W, SONG J L, et al.Study on the best C & N source of culture medium ofPleurotusostreatus[J].Tillage and Cultivation, 2020, 40(4):31-33.
[8] 安学明, 陈超, 刘小霞, 等.草菇继代培养中菌种退化对子实体营养成分的影响[J].菌物学报, 2020, 39(2):390-397.
AN X M, CHEN C, LIU X X, et al.Effects of degeneration of cultivated strains on fruiting body nutrients ofVolvariellavolvaceaduring subculture[J].Mycosystema, 2020, 39(2):390-397.
[9] REN Y Y, SUN P P, LI H R, et al.Effects of Na2SeO3on growth, metabolism, antioxidase and enzymes involved in polysaccharide synthesis ofCordycepsmilitaris[J].Process Biochemistry, 2020, 97:64-71.
[10] CHEN X, ZHANG Z, LIU X X, et al.Characteristics analysis reveals the progress ofVolvariellavolvaceamycelium subculture degeneration[J].Frontiers in Microbiology, 2019, 10:2045.
[11] GHOSE T K.Measurement of cellulase activities[J].Pure and Applied Chemistry, 1987, 59(2):257-268.
[12] 孟建宇, 冀锦华, 郭慧琴, 等.常温纤维素降解细菌的筛选及其复合系的构建[J].生物学杂志, 2020, 37(3):86-90.
MENG J Y, JI J H, GUO H Q, et al.Isolation of room temperature cellulose-degrading bacteria and construction of degrading consortia[J].Journal of Biology, 2020, 37(3):86-90.
[13] CHEN S C, MA D B, GE W, et al.Induction of laccase activity in the edible straw mushroom,Volvariellavolvacea[J].FEMS Microbiology Letters, 2003, 218(1):143-148.
[14] BILAL M, IQBAL M, HU H B, et al.Mutagenicity and cytotoxicity assessment of biodegraded textile effluent by Ca-alginate encapsulated manganese peroxidase[J].Biochemical Engineering Journal, 2016, 109:153-161.
[15] 崔堂武, 袁波, 凌晨, 等.木质素降解酶的酶活测试方法的评价与分析[J].化工进展, 2020, 39(12):5 189-5 202.
CUI T W, YUAN B, LING C, et al.Evaluation and analysis of activity assays of ligninolytic enzymes[J].Chemical Industry and Engineering Progress, 2020, 39(12):5 189-5 202.
[16] 韦赟, 江正强, 李里特, 等.橄榄绿链霉菌固体发酵产木聚糖酶的研究[J].食品科学, 2004, 25(S1):70-73.
WEI Y, JIANG Z Q, LI L T, et al.Study on the production of xylanase by solid fermentation ofStreptomycesolivaceoviridis[J].Food Science, 2004, 25(S1):70-73.
[17] 林清泉, 丘雪红, 郑壮丽, 等.蛹虫草退化菌株的特征研究[J].菌物学报, 2010, 29(5):670-677.
LIN Q Q, QIU X H, ZHENG Z L, et al.Characteristics of the degenerate strains ofCordycepsmilitaris[J].Mycosystema, 2010, 29(5):670-677.
[18] HOAG G E, COLLINS J B, HOLCOMB J L, et al.Degradation of bromothymol blue by ‘greener’ nano-scale zero-valent iron synthesized using tea polyphenols[J].Journal of Materials Chemistry, 2009, 19(45):8671.
[19] MEENA M, PRASAD V, ZEHRA A, et al.Mannitol metabolism during pathogenic fungal-host interactions under stressed conditions[J].Frontiers in Microbiology, 2015, 6:1019.
[20] PATEL T K, WILLIAMSON J D.Mannitol in plants, fungi, and plant-fungal interactions[J].Trends in Plant Science, 2016, 21(6):486-497.
[21] WEINSTEIN R N, PALM M E, JOHNSTONE K, et al.Ecological and physiological characterization ofHumicolamarvinii, a new psychrophilic fungus from fellfield soils in the maritime Antarctic[J].Mycologia, 1997, 89(5):706-711.
[22] 杨静, 蒋剑春, 张宁, 等.微生物降解木质素的研究进展[J].生物质化学工程, 2021, 55(3):62-70.
YANG J, JIANG J C, ZHANG N, et al.Research progress on lignin degradation by microorganism[J].Biomass Chemical Engineering, 2021, 55(3):62-70.
[23] PARK Y J, BAEK J H, LEE S, et al.Whole genome and global gene expression analyses of the model mushroomFlammulinavelutipesreveal a high capacity for lignocellulose degradation[J].PLoS One, 2014, 9(4):e93560.
[24] WANG B T, HU S, YU X Y, et al.Studies of cellulose and starch utilization and the regulatory mechanisms of related enzymes in fungi[J].Polymers,2020,12(3):530.
[25] 吴秀芸, 戴琳, 张舒, 等.高效木聚糖降解酶系定制的新进展与挑战[J].微生物学通报, 2020, 47(7):2 278-2 289.
WU X Y, DAI L, ZHANG S, et al.New advances and challenges in customizing xylan-degrading enzymes[J].Microbiology China, 2020, 47(7):2 278-2 289.
[26] ZHANG J J, HAO H B, WU X L, et al.The functions of glutathione peroxidase in ROS homeostasis and fruiting body development inHypsizygusmarmoreus[J].Applied Microbiology and Biotechnology, 2020, 104(24):10 555-10 570.
[27] VELUCHAMY C, KALAMDHAD A S.Influence of pretreatment techniques on anaerobic digestion of pulp and paper mill sludge:A review[J].Bioresource Technology, 2017, 245:1 206-1 219.
