维生素B5对出芽短梗霉产普鲁兰多糖的影响
2022-06-15张伊凡陈世伟郭利飞郑又铭赵廷彬徐雪天殷海松乔长晟
张伊凡,陈世伟,郭利飞,郑又铭,赵廷彬,徐雪天,殷海松,乔长晟,,4,5*
1(天津科技大学 生物工程学院,天津,300457)2(天津慧智百川生物工程有限公司,天津,300457) 3(天津现代职业技术学院 生物工程学院,天津,300457)4(工业发酵微生物教育部重点实验室暨天津市 工业微生物重点实验室,天津,300457)5(天津市微生物代谢与发酵过程控制技术工程中心,天津,300457)
普鲁兰多糖是一种由酵母样真菌出芽短梗霉(Aureobasidiumpullulans)在深层发酵中以无定形黏液的形式,需氧状态下产生的微生物胞外多糖,它是一种线性葡聚糖,由α-1,4糖苷键连接的麦芽三糖重复单位,经α-1,6糖苷键聚合而成的直链状多糖[1]。普鲁兰多糖是可食用和可生物降解的,还具有高保湿性能,限制水分迁移等作用[2],通常用作低热量食品添加剂、胶囊、黏合剂、增稠剂和延伸剂等。低分子质量的多糖由于其在生物组织中的高扩散性而比高分子质量的多糖更具优势[3]。而高分子质量的普鲁兰多糖因其具有较高黏度而有很高的价值,在食品、制药和化妆品等行业的应用较广,因此可将其制成微丸、不透氧膜、药物胶囊等[4-6]。目前对普鲁兰多糖的研究还集中在其生产方面,如菌株和发酵工艺的优化,研究发现,细胞形态、培养基组成、培养条件等因素均能影响普鲁兰多糖生产[7-9]。普鲁兰多糖的产量和分子质量是决定聚合物收率和特性的重要参数[10]。而普鲁兰多糖硬胶囊主要是由平均分子质量为1.0×105~2.0×105Da的商业普鲁兰制造的[4],因此,在提高产量的同时进行分子质量的调控具有一定的意义。
维生素B5又称遍多酸或泛酸,是一种水溶性维生素,它是能量代谢所必需的微量营养素,且是合成辅酶A和酰基载体蛋白的关键前体,辅酶A对脂肪酸代谢和柠檬酸循环至关重要[11]。EDWARDS等[12]在酵母发酵过程中添加了维生素B5从而增加H2S的生成。SLYSHENKOV等[13]在研究人类淋巴母细胞增加的机制时发现,将泛酸用于人淋巴母细胞培养时会大大增加谷胱甘肽的含量。
本研究通过在培养基中添加维生素B5,探讨其对普鲁兰多糖的产量和分子质量的影响。对发酵过程中关键酶活性进行测定,并对发酵前期(24 h)和后期(84 h)两个时间点鉴定出的差异蛋白进行生物学分析,目的在于了解维生素B5对普鲁兰合成的影响,为出芽短梗霉合成普鲁兰的机理研究提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株
出芽短梗霉(Aureobsidiumpullulans)保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号:CGMCC NO.7055。
1.1.2 主要试剂
蔗糖、(NH4)2SO4、MgSO4、NaCl、K2HPO4、酵母浸粉、牛肉粉,所有试剂均为国产分析纯。
α-淀粉酶活性测定试剂盒(G0510F)、普鲁兰酶活性测定试剂盒(G0578F)、磷酸葡萄糖变位酶试剂盒(G0563F)、尿苷二磷酸葡萄糖焦磷酸化酶试剂盒(G0535F),苏州格瑞思生物科技有限公司;真菌葡萄糖基转移酶酶联免疫分析试剂盒(JL49526),上海将来实业股份有限公司。
1.1.3 主要仪器设备
08-F25型5 L自动发酵罐,镇江格瑞生物工程有限公司;TDL-5-A型高速离心机,上海安亭科学仪器厂;5977B-7890B气相质谱联用仪,德国安捷伦科技有限公司;LC-20A高效液相色谱系统,日本岛津公司。
1.1.4 培养基
种子培养基(g/L):蔗糖100,酵母浸粉3,(NH4)2SO41,K2HPO42,MgSO4·7H2O 0.4,NaCl 2.5,FeSO4·7H2O 0.05,以6.0 mol/L HCl及6.0 mol/L NaOH溶液调节pH值6.0,121 ℃灭菌20 min。
发酵培养基(g/L):蔗糖 150,牛肉粉 5,K2HPO47,MgSO4·7H2O 0.4,NaCl 3,FeSO4·7H2O 0.05,以6.0 mol/L HCl及6.0 mol/L NaOH溶液调节pH值6.0,121 ℃灭菌20 min。
其中,实验组是在发酵培养基中添加0.2 g/L的维生素B5。
1.2 实验方法
1.2.1 种子培养
取4 ℃冰箱中保存待用的新鲜斜面于28 ℃恒温恒湿培养箱中活化2 h,然后从中挑取1环孢子接入种子培养基中,28 ℃,180 r/min摇床恒温培养20~22 h,制得种子液。
1.2.2 发酵培养
摇瓶发酵培养:以6%体积分数的接种量,将种子液接种至装有100 mL发酵培养基的500 mL三角瓶中,在180 r/min摇床中培养,发酵前24 h温度维持在32 ℃,后64 h温度调节为28 ℃。
分批发酵培养:按照6%体积分数的接种量,将种子液接入到5 L发酵罐的培养基中,发酵前24 h温度维持在32 ℃,后72 h温度调节为28 ℃,罐压恒定在0.02 MPa,通风比为1∶1.25(体积比),初始pH 6.0,转速400 r/min,培养周期96 h。
1.2.3 指标测定
细胞干重及普鲁兰产量的测定方法参照文献[14]。参照文献[15]的方法测定普鲁兰分子质量。磷酸葡萄糖变位酶(glucose phosphate mutase,PGM)、尿苷二磷酸葡萄糖焦磷酸化酶(uridine diphosphate glucose pyrophosphorylase,UGP)、葡萄糖基转移酶(glucosyltransferase,GTF)、α-淀粉酶和普鲁兰酶的活性用试剂盒测定。
1.2.4 出芽短梗霉蛋白质组学
取适量84 h的发酵液于2.5 mL EP管中,10 000 r/min离心10 min,弃上清液留菌体。然后将菌体用PBS重悬,10 000 r/min下精准快速离心10 min,此操作重复3次,最后将菌体用液氮速冻10 min,保存至-80 ℃下备用。取1管样品液氮研磨,然后加入8 mol/L尿素(50∶1体积比加入蛋白酶抑制剂)超声2 s,停2 s,共2 min。14 000 r/min离心20 min,取上清液,分装,留取10 μL定量,其余冻入-80 ℃。
酶解脱盐及质谱色谱条件参照文献[16]的方法。
1.3 数据统计
实验数据为3组平行样品计算结果的平均值。Origin 2019b软件作图。GO和KEGG的注释用Uniprot的Yeast注释数据完成。
2 结果与分析
2.1 维生素B5对普鲁兰合成的影响
在摇瓶发酵条件下,不同浓度维生素B5对出芽短梗霉细胞生长和普鲁兰合成的影响如图1所示。
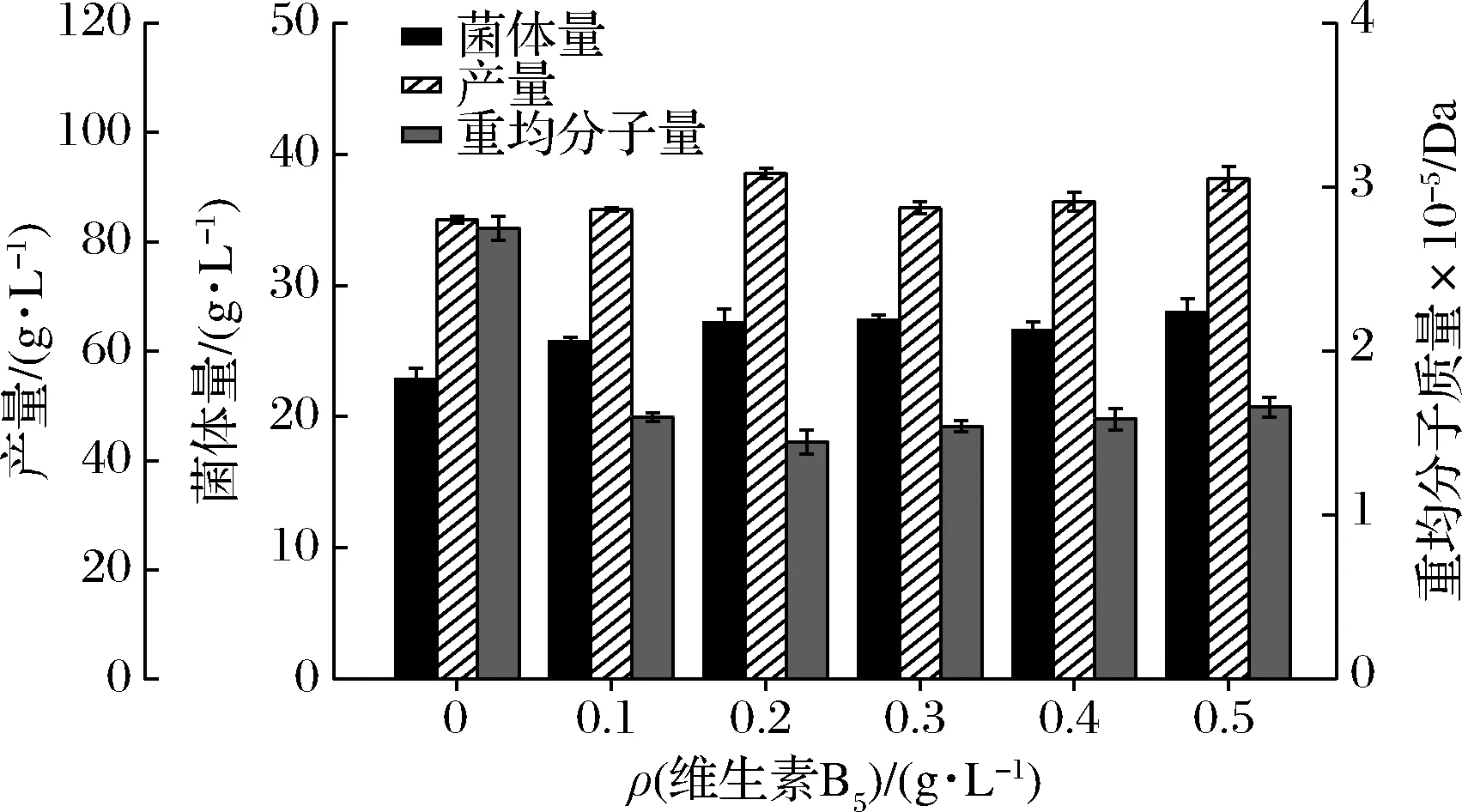
图1 不同梯度浓度维生素B5对普鲁兰发酵的影响Fig.1 Effect of different gradient concentrations of vitamin B5 on pullulan fermentation
维生素B5的添加提高了普鲁兰产量和菌体量,降低了黏度和普鲁兰的重均分子质量。当维生素B5添加量为0.2 g/L时,普鲁兰产量达到最大值92.57 g/L,比对照提高了8.82%,单位菌体产量也从3.34 g/L提高到3.41 g/L;而普鲁兰多糖的重均分子质量在此浓度下最低,比对照降低了50.20%。以上结果表明,培养基中维生素B5的存在有利于普鲁兰多糖产量的提高,同时能降低它的重均分子质量。
2.2 发酵罐验证维生素B5对普鲁兰多糖的影响
在5 L发酵罐中对出芽短梗霉进行发酵培养,检测了0.2 g/L维生素B5和对照条件下的菌体量、分子质量和普鲁兰多糖合成情况。通过图2分析可知,0~12 h内,对照组和实验组的菌体量一致,24 h以后,对照组和实验组的菌体量开始出现变化,维生素B5的添加刺激了出芽短梗霉的生长,同时普鲁兰的产量由对照组的87.3 g/L提高至实验组的102 g/L,产量增加了16.8%。单位菌体产量也从5.45 g/L提高到5.9 g/L,在维生素B5存在的情况下,普鲁兰最终重均分子质量由对照组的2.14×102kDa下降到实验组的1.11×102kDa,降幅为48.2%。分子质量在发酵的早期达到最大值,随着发酵的进行逐渐降低,与AN等[17]研究的结果一致。这可能是因为在培养和发酵过程中,培养基中分泌的普鲁兰酶和α-淀粉酶导致了普鲁兰多糖的分子质量在生长后期显著降低[18]。

a-菌体量;b-普鲁兰产量;c-重均分子质量图2 添加维生素B5对普鲁兰多糖发酵的影响Fig.2 Effect of adding vitamin B5 on pullulan fermentation
2.3 普鲁兰多糖生物合成和降解中关键酶的活性
由图3可知,在出芽短梗霉发酵产普鲁兰过程中,与空白组相比,实验组的PGM、UGP和GTF都有所提高,关键酶活性的增强从而使得多糖合成有所加强。

a-磷酸葡萄糖变位酶活性;b-尿苷二磷酸葡萄糖焦磷酸化酶活性;c-葡萄糖基转移酶活性;d-α-淀粉酶活性;e-普鲁兰酶活性图3 普鲁兰多糖生物合成和降解过程中关键酶活性Fig.3 Key enzyme activities in the biosynthesis and degradation of pullulan
而对于实验组分子质量大幅度的降低,实验测定了发酵过程中α-淀粉酶活性和普鲁兰酶活性的变化趋势,α-淀粉酶随着发酵的进行活性也在增大,实验组任意时间点的α-淀粉酶活性均大于空白组。发酵前中期并未检测到普鲁兰酶活性,可能是由于活性太低或者发酵前中期没有普鲁兰酶的合成,在发酵后期72 h和发酵末期96 h,实验组的普鲁兰酶活性均大于空白组。因此可以推断,实验组中维生素B5的添加使得重均分子质量的降低可能是由于胞内α-淀粉酶和普鲁兰酶活性的增强。
2.4 蛋白质组学分析
2.4.1 差异表达蛋白质的鉴定及统计分析结果
按照表达倍数变化1.5倍以上的标准筛选差异表达蛋白质,结果如表1所示,出芽短梗霉发酵合成普鲁兰多糖的过程中,前期(24 h)和后期(84 h)实验组与对照组相比分别鉴定出差异蛋白387和381种。

表1 差异蛋白质定量结果统计Table 1 Statistics of protein quantification results
2.4.2 差异表达蛋白质的鉴定及统计分析结果
采用层次聚类算法对比较组的差异表达蛋白质分别进行聚类分析,如图4所示。红色代表上调蛋白,蓝色代表下调蛋白,颜色越深表示差异越加明显。其中主要差异蛋白变化情况如表2所示。
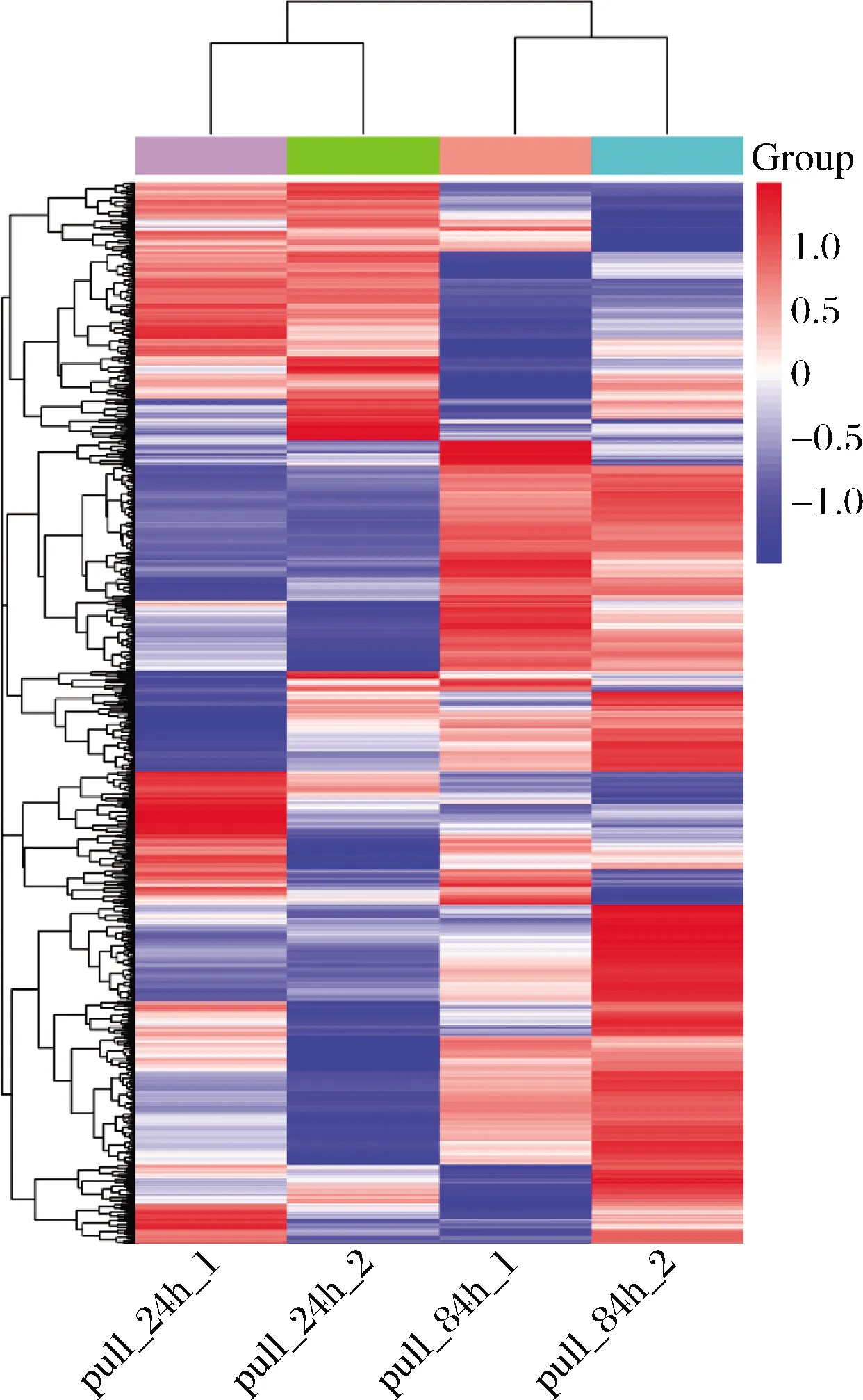
1-对照组;2-实验组图4 全局分析聚类热图Fig.4 Global analysis cluster heat map

表2 差异蛋白结果统计Table 2 Differential proteins statistics
2.4.3 差异表达蛋白质标准化分类体系功能富集分析
差异表达蛋白质标准化分类体系,它从生物学的3个方面对蛋白质功能进行分类,即细胞组分、分子功能和生物过程。通过对不同时间点(24和84 h)实验组和对照组差异蛋白的GO功能富集分析,结果如图5所示。
发酵前期(24 h)差异蛋白GO功能富集分析显示,实验组与对照组差异蛋白主要参与核糖体生物起源、甾醇生物合成的过程、RNA聚合酶转录、RNA转录tRNA和RNA聚合酶的终止等生物过程。富集到的差异蛋白主要定位到出芽短梗霉细胞膜的组成部分、内质网、内质网膜、核质和核糖体等位置。差异蛋白在分子功能上主要体现在Zn2+结合、蛋白酶活性、RNA聚合酶Ⅰ活性、大核糖体亚基rRNA及核酸结合。发酵后期(84 h)实验组与对照组差异蛋白所参与的生物过程主要是麦角固醇的生物合成过程、核糖体生物起源、RNA聚合体的转录、核转录的mRNA分解代谢过程及组氨酸生物合成的过程。富集到的差异蛋白主要定位到出芽短梗霉细胞的膜的组成部分、内质网、内质网膜、核糖体等位置上。这与24 h差异蛋白在细胞组分上的定位一致。差异蛋白在分子功能上主要体现在Zn2+结合、DNA结合、RNA聚合酶I活性等。

a-24 h;b-84 h图5 24 h和84 h差异蛋白GO功能富集分析Fig.5 24 h,84 h differential protein GO terms enrichment analysis
2.4.4 差异表达蛋白质代谢和信号转导通路富集分析
通过对鉴定出来的差异蛋白进行KEGG功能注释,将其按照所属的不同代谢途径进行功能分类。并对不同途径中富集到的蛋白数目进行统计,按照蛋白统计数目排列出前20的代谢通路,统计注释结果如图6所示。

a-24 h;b-84 h图6 24 h和84 h差异蛋白KEGG通路富集度分析Fig.6 24 h,84 h differential protein KEGG pathway enrichment analysis
发酵前期(24 h)差异蛋白参与的代谢通路主要有类固醇生物合成、甘油肌醇代谢、戊糖和葡萄糖醛酸酯的相互转化、不饱和脂肪酸的生物合成、组氨酸代谢、β-丙氨酸代谢及磷酸肌醇代谢。发酵后期(84 h)差异蛋白主要涉及苯丙氨酸、酪氨酸和色氨酸的生物合成、磷酸肌醇代谢、类固醇生物合成、不饱和脂肪酸的生物合成、果糖和甘露糖代谢、组氨酸代谢、精氨酸生物合成及内质网中的蛋白质加工等途径。由此可见,实验组中维生素B5的存在,影响了发酵过程中碳代谢、氨基酸代谢及脂肪酸代谢,这些均可能与普鲁兰多糖产量和重均分子质量的变化有关。
2.4.5 差异蛋白代谢途径分析
有学者提出了一种通过蛋白质组学和代谢图的基因重要性确定代谢途径的活性和方向性的方法[19]。因此,根据筛选出的主要差异蛋白质,结合KEGG通路和关键酶活性的测定分析了差异蛋白对代谢途径的影响,同时结合LIU等[20-21]的研究并绘制了差异蛋白对出芽短梗霉代谢途径影响图,如图7所示。
己糖激酶是参与糖酵解、果糖和甘露糖代谢中的酶[22],同时也是普鲁兰多糖生物合成途径中的关键酶之一。在糖酵解中,己糖激酶是参与α-D-葡萄糖转化成α-D-6-磷酸葡萄糖和β-D-葡萄糖转化成β-D-6-磷酸葡萄糖的酶[22],实验组中检测到己糖激酶相关蛋白表达量的提高,促使更多的α-D-6-磷酸葡萄糖和β-D-6-磷酸葡萄糖合成,从而加强了普鲁兰的合成过程及三羧酸(tricarboxylic acid,TCA)循环的进行。在果糖和甘露糖代谢中,己糖激酶可以促进D-甘露糖转化成D-6-磷酸甘露糖,而D-6-磷酸甘露糖又将生成β-D-6-磷酸葡萄糖进入普鲁兰多糖合成的主途径中,因此,己糖激酶表达量的提高有利于普鲁兰多糖的合成。

图7 维生素B5引起的差异蛋白对出芽短梗霉代谢途径的影响Fig.7 Effect of differential protein caused by vitamin B5 on the metabolic pathway of A.pullulans
在戊糖和葡萄糖醛酸酯的相互转化途径中,木糖还原酶表达量的下降抑制了D-木糖转化为木糖醇,因此更多的D-木糖向着丙酮酸转换,丙酮酸最终进入TCA循环为发酵提供大量能量。
天冬氨酸转氨酶是连接氨基酸代谢和碳水化合物代谢的关键代谢酶,并且通过参与天冬氨酸/苹果酸穿梭将产生的能量转移到线粒体[23]。在丙氨酸-天冬氨酸-谷氨酸代谢途径中,丙氨酸-乙醛酸转氨酶表达量的上调促使L-丙氨酸转化成丙酮酸,而天冬氨酸转氨酶和谷氨酸合酶表达量的下调,抑制草酰乙酸与L-天冬氨酸之间的相互转化及α-酮戊二酸合成谷氨酸。而TCA循环是许多合成代谢和分解代谢途径整合的重要纽带,它被认为是能量代谢的核心过程[24]。丙酮酸、草酰乙酸和α-酮戊二酸含量的提高,加强了TCA循环,从而为出芽短梗霉菌体的生长和普鲁兰多糖的合成提高更多的能量。
在甘氨酸-丝氨酸-苏氨酸代谢途径中,苏氨酸可以转化为甘氨酸,甘氨酸又可以转化为丝氨酸,最后由丝氨酸转化为丙酮酸,苏氨酸醛缩酶表达量的提高增强了苏氨酸转化为甘氨酸途径,而L-丝氨酸裂解酶表达量的提高使更多的丝氨酸向着丙酮酸方向进行。
在缬氨酸、亮氨酸和异亮氨酸降解中,缬氨酸进入TCA循环是通过转化为琥珀酰辅酶A,琥珀酰辅酶A会进一步的合成琥珀酸,而琥珀酸是TCA循环中必不可少的物质,醛脱氢酶表达量的提高加强了缬氨酸的降解,促进了琥珀酰辅酶A的生成,使TCA循环更加高效的进行。
在磷酸肌醇代谢中,α-D-6-磷酸葡萄糖是合成肌醇的出发物质,同时也是普鲁兰多糖合成路径中的关键物质,肌醇磷酸合成酶是α-D-6-磷酸葡萄糖合成肌醇过程中的酶,其表达量的下降减弱了磷酸肌醇代谢,同时也保证了α-D-6-磷酸葡萄糖维持在较高的水平参与到普鲁兰多糖的合成途径中去。
柠檬酸也是TCA循环中必不可少的物质,由草酰乙酸合成柠檬酸的过程中,柠檬酸合酶表达量的提高及前面分析得到的乙酰辅酶A的增强,可以增大柠檬酸的含量并加速TCA循环的进行。
维生素B5使PGM、UGP、GTF、α-淀粉酶和普鲁兰酶活性的提高,有利于向普鲁兰多糖合成的方向进行,最终使其产量提高。而在α-淀粉酶和普鲁兰酶的作用下,高分子质量的普鲁兰多糖被分解,从而降低了普鲁兰多糖的分子质量。
3 结论与讨论
本研究考察了维生素B5在普鲁兰生物合成中的作用,采用非标记定量技术对出芽短梗霉进行分析,结果发现与对照相比,0.2 g/L维生素B5显著提高了普鲁兰多糖的产量和菌体量,同时显著降低了它的重均分子质量。而添加维生素B5的实验组PGM、UGP、GTF、α-淀粉酶和普鲁兰酶活性都有所提高。发酵前期(24 h)共筛选出387个差异蛋白,包括196个上调蛋白和191个下调蛋白,发现后期(84 h)共筛选出381个差异蛋白,其中包括182个上调蛋白和199个下调蛋白。通过对这些差异表达基因进行GO功能注释和KEGG通路富集分析,发现维生素B5影响了参与发酵过程中碳代谢、氨基酸代谢及脂肪酸代谢等,最终在提高了普鲁兰产量的同时降低了普鲁兰的分子质量。研究结果有助于理解维生素B5在普鲁兰生物合成中的作用机制,同时也为出芽短梗霉合成普鲁兰的机理研究提供了参考。
