羟胺强化谷氨酸-Fe(Ⅱ)催化过碳酸钠体系处理地下水中的苯
2022-06-15傅晓日魏新颜闫武鹏
傅晓日,魏新颜,2,张 伟,闫武鹏
(1.中建六局水利水电建设集团有限公司,天津 300222;2.中国建筑第六工程局有限公司,天津 300450)
苯系物是石油的重要组成部分,是生产生活中不可或缺的重要化工原料。但在使用苯系物过程中,人为的不当操作或突发事件,造成苯系物的泄露或含苯系物废水的排放,使其成为地下水中常见的有机污染物[1]。苯系物具有神经毒性和遗传毒性,会影响人体的神经、血液以及生殖系统,长期接触可导致人体患上白血病等疾病,对人类健康产生威胁[2]。其中,苯作为苯系物中毒性最强、危害最严重的物质,被国际癌症研究机构认定为第一类致癌物质,也被多个国家明确为优先控制污染物[3-4]。
原位化学氧化修复技术利用向地下水中注入的强氧化剂将有机污染物降解为无毒或低毒性化合物,从而达到修复效果。近年来,该技术具有适用性强、修复效果好、对环境影响小且成本相对较低等特点,而得到广泛应用[5]。常用的氧化剂包括Fenton试剂[6]、臭氧[7]、高锰酸盐[8]、过氧化钙[9]和过硫酸盐[10]。
研究指出过碳酸钠(Na2CO3·1.5H2O2,SPC)溶于水后会分解为H2O2和Na2CO3,在Fe(Ⅱ)催化作用下,引发类Fenton反应,快速产生HO·自由基,高效降解有机污染物[11]。而螯合剂的存在可提升Fe(Ⅱ)-催化SPC体系降解有机污染物的能力[12]。Zang等[12]在研究柠檬酸螯合Fe(Ⅱ)催化SPC体系降解三氯乙烯的过程中发现,柠檬酸的加入提高了三氯乙烯的去除率,但Fe(Ⅱ)在反应初期即被快速消耗,1 min内Fe(Ⅱ)的质量浓度由25.5 mg/L降至1.25 mg/L。在反应后半段,体系中主要以催化能力较弱的Fe(Ⅲ)为主。Fu等[13]研究谷氨酸(GLA)-Fe(Ⅱ)/SPC体系降解苯的过程中,发现体系中存在大量溶解态Fe(Ⅲ),且GLA可促进Fe(Ⅲ)转化为Fe(Ⅱ),从而提高苯的去除率。但体系中GLA的存在不足以将Fe(Ⅲ)完全转化为Fe(Ⅱ),且Fe(Ⅱ)/Fe(Ⅲ)循环相对缓慢,限制了苯去除率的进一步提升。因此,将螯合-Fe(Ⅱ)催化SPC体系中大量存在的溶解态Fe(Ⅲ)还原为Fe(Ⅱ),可大幅提高体系的催化能力,在减少催化剂用量的同时,保证污染物的去除。
本文考察盐酸羟胺(HAH)、抗坏血酸(ASC)、亚硫酸钠和抗坏血酸钠4种还原剂对GLA-Fe(Ⅱ)催化SPC体系降解地下水中苯的影响;着重分析了HAH强化GLA-Fe(Ⅱ)/SPC[HAH-GLA-Fe(Ⅱ)/SPC]体系中HAH浓度、溶液初始pH、无机阴离子和以腐植酸(HA)为代表的天然有机物对苯降解的影响;探究HAH-GLA-Fe(Ⅱ)/SPC体系中存在的主要活性氧自由基,HAH对活性氧自由基产生的强化效果,以及主体活性氧自由基在苯降解过程中的作用;考察HAH-GLA-Fe(Ⅱ)/SPC体系在实际地下水中对苯降解的适用性,为苯系物污染地下水修复工程提供技术选择。
1 试验材料与方法
1.1 试验材料
1.1.1 试剂

1.1.2 试验仪器
试验仪器主要有:SDC-6型低温恒温槽(宁波新芝生物科技股份有限公司)、配备离子火焰检测器和HP-5色谱柱(长为30 m、内径为0.32 mm、膜厚为0.25 μm)的6890N型气相色谱仪(美国安捷伦)、COMBI-PLA自动进样器(CTC,Switzerland)、85-2型磁力搅拌器(上海闵行虹浦仪器厂)、DELTA320型pH计(瑞士Mettler-Toledo集团)和EMX-8/2.7C电子顺磁共振仪(德国BRUKER)。
1.2 试验流程及分析方法
连接低温恒温槽与有效容积为250 mL的带夹层圆柱玻璃反应器,通过夹层中流动的恒温水控制反应温度为20 ℃。取25 mL配制好的苯母液(10 mmol/L)于反应器中,定容后,苯的摩尔浓度为1 mmol/L。依次向反应器中加入FeSO4·7H2O、GLA和HAH,控制磁力搅拌器(转速为600 r/min)使溶液混合均匀(混合时间为10 min),取初始点样品后加入SPC,开始反应并计时。在既定时间点采取2.5 mL样品溶液于盛有1 mL甲醇的顶空瓶中,密封后快速震荡,及时终止反应,并进行苯浓度分析。苯母液及试验用水均统一采用超纯水或实际地下水。在考察pH对苯降解影响的试验中,采用NaOH或H2SO4(0.1 mol/L)调节溶液初始pH。所用试验结果为2个平行样品的平均值。
样品中苯浓度由顶空-气相色谱仪测定。顶空进样器条件:加热槽温度设定为50 ℃,以500 r/min震荡5 min;注射针温度设定为60 ℃。气相色谱条件如下:保持40 ℃初始柱温2 min后,以30 ℃/min升至80 ℃并保持1 min;载气为N2,流速为3.0 mL/min;进样口和检测器温度分别设定为150 ℃和250 ℃;进样量为500 μL且无分流。
Fe(Ⅱ)及Fe(Ⅲ)浓度采取1,10-邻菲罗啉分光光度法测定[14],H2O2浓度采用分光光度法测定[15],HO·强度由电子顺磁共振(EPR)分析技术测定[16-17]。
在既定时间点取反应溶液0.3 mL,加入到0.3 mL(摩尔浓度为8.84 mmol/L)的5,5-二甲基-1-氧化吡咯啉溶液中,混合后快速转移至毛细管,进行EPR分析。EPR分析条件如下:中心磁场为0.351 5 T;扫场宽度为0.01 T;分辨率为1 024像素;微波频率为9.866 GHz;微波强度为2.016 mW;调制幅度为10-4T;调制频率为100.00 kHz;扫描时间为41.943 s;时间常数为163.840 ms;扫描次数为1。
2 结果与讨论
2.1 还原剂强化GLA-Fe(Ⅱ)/SPC体系中苯的降解
图1显示HAH、ASC、亚硫酸钠和抗坏血酸钠4种还原剂对GLA-Fe(Ⅱ)/SPC体系中苯降解效果的影响。试验中SPC摩尔浓度为2 mmol/L,GLA、Fe(Ⅱ)、苯和各还原剂摩尔浓度均为1 mmol/L。由图1可知,试验阶段苯挥发损失小于3%,可忽略不计。苯在GLA-Fe(Ⅱ)/SPC体系中的降解率仅为27.0%。随着HAH、ASC和抗坏血酸钠的加入,苯降解率分别提高了36.7%、24.5%和19.3%,升至63.7%、54.5%和46.3%,表明HAH、ASC和抗坏血酸钠强化了GLA-Fe(Ⅱ)/SPC体系对苯的降解能力,且HAH-GLA-Fe(Ⅱ)/SPC体系对苯的降解效果最佳。而抗坏血酸钠-GLA-Fe(Ⅱ)/SPC体系中苯的降解率仅为21.1%,低于GLA-Fe(Ⅱ)/SPC体系中27.0%的苯去除率,说明亚硫酸钠削弱了GLA-Fe(Ⅱ)/SPC体系降解苯的能力。这主要因为亚硫酸钠还原能力较弱,无法将Fe(Ⅲ)大量还原为Fe(Ⅱ),体系催化能力不足。同时,亚硫酸钠可与苯竞争消耗体系中的HO·,最终导致体系中苯的降解受到亚硫酸钠的明显抑制。

图1 还原剂强化GLA-Fe(Ⅱ)/SPC体系中苯的降解效果
图2显示最佳还原剂HAH初始浓度对GLA-Fe(Ⅱ)/SPC体系降解苯的影响。试验中SPC摩尔浓度为2.00 mmol/L,GLA、Fe(Ⅱ)和苯的摩尔浓度均为1.00 mmol/L。当不投加HAH时,2 min内苯降解率为23.5%。由图3可知,在仅有SPC和GLA存在的空白组试验中,SPC在2 min内释放大量H2O2,摩尔浓度达到2.96 mmol/L。在GLA-Fe(Ⅱ)/SPC体系中,H2O2摩尔浓度在2 min内迅速降至2.22 mmol/L,说明体系中存在的Fe(Ⅱ)与SPC释放的H2O2迅速反应,短时间内产生大量HO·,实现了2 min内苯的快速降解。值得注意的是,2 min后苯的降解相对缓慢,120 min时苯的降解率仅为27.0%。这是因为体系中Fe(Ⅱ)被大量消耗,摩尔浓度由1.000 mmol/L降至0.051 mmol/L,而生成的Fe(Ⅲ)催化能力较弱,降低了体系的催化能力。虽然GLA的存在可促进Fe(Ⅲ)转化为Fe(Ⅱ),但Fe(Ⅱ)/Fe(Ⅲ)循环相对缓慢,Fe(Ⅱ)摩尔浓度仅由0.051 mmol/L升至0.112 mmol/L,不足以催化大量剩余的H2O2产生足量HO·,限制了苯的进一步降解。
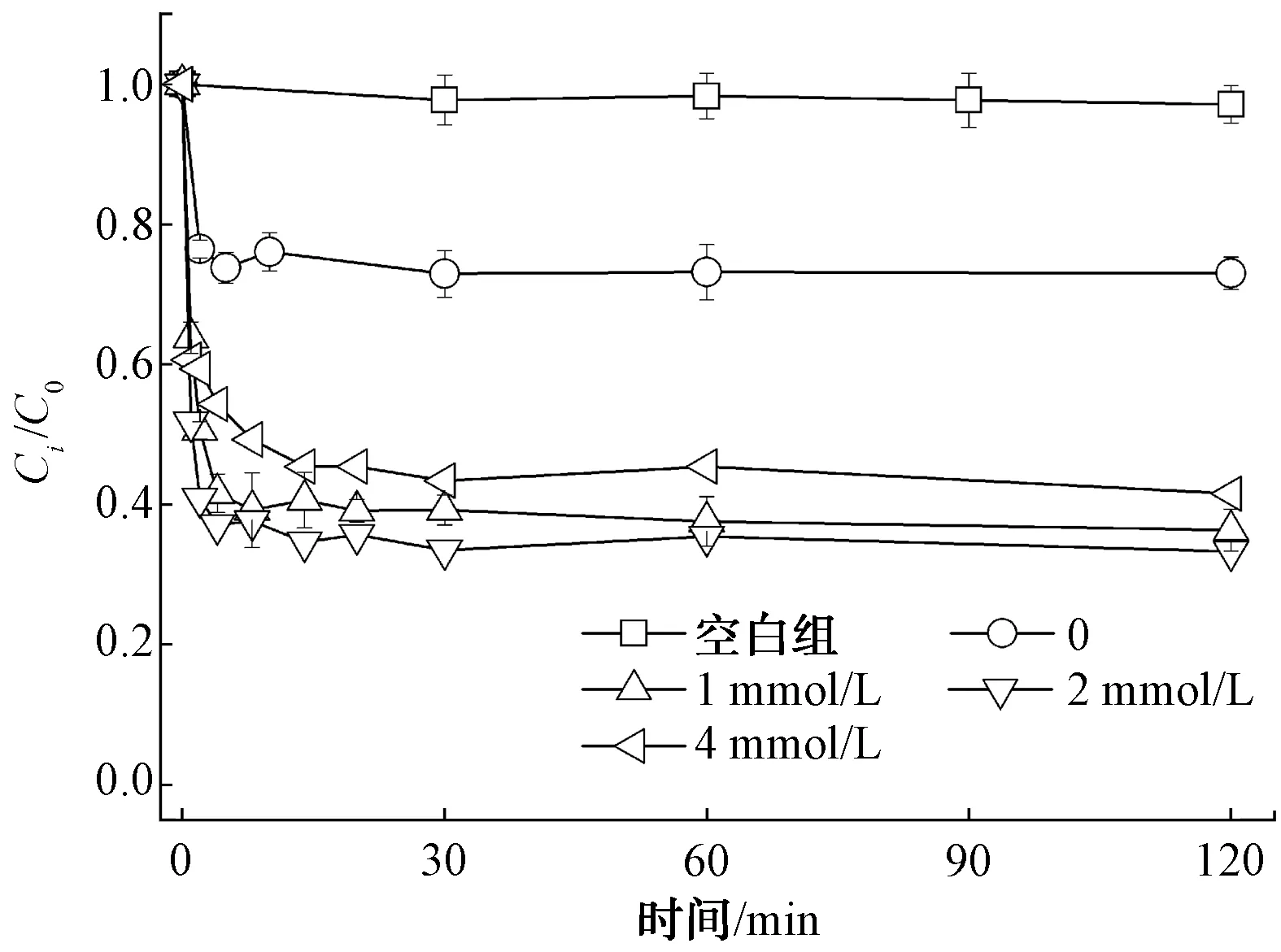
图2 HAH浓度对苯降解的影响
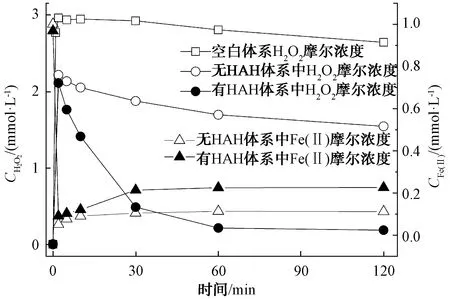
图3 GLA-Fe(Ⅱ)/SPC、HAH-GLA-Fe(Ⅱ)/SPC体系中Fe(Ⅱ)和H2O2的浓度变化
当HAH摩尔浓度为1 mmol/L时,苯在2 min和120 min时的去除率分别为49.4%和63.7%,远高于GLA-Fe(Ⅱ)/SPC体系中23.5%和27.0%的苯去除率,说明HAH的加入提高了GLA-Fe(Ⅱ)/SPC体系的氧化能力,促进了苯的降解。由图3可知,HAH促进了Fe(Ⅲ)还原为Fe(Ⅱ)的过程,加快了Fe(Ⅱ)/Fe(Ⅲ)循环,高浓度的Fe(Ⅱ)催化H2O2产生更多HO·,从而提高苯去除率。例如,2 min时,HAH-GLA-Fe(Ⅱ)/SPC体系中Fe(Ⅱ)摩尔浓度为0.091 mmol/L,且2 min后Fe(Ⅱ)摩尔浓度不断升至0.230 mmol/L,远高于GLA-Fe(Ⅱ)/SPC体系中Fe(Ⅱ)浓度。与之对应的是体系中H2O2浓度的不断降低以及苯的持续降解。
由图2可知,当HAH摩尔浓度升至2 mmol/L时,苯去除率为66.7%。进一步提高HAH的摩尔浓度为4 mmol/L时,苯去除率降至58.5%,说明过量的HAH不利于苯的降解。这是因为过量的HAH会与苯竞争,以小于5.0×108L/(mol·s)的反应速率与HO·反应[18]。同时,随着HAH进入体系中的Cl-可与HO·反应生成氧化性较弱的自由基,两者共同造成了HO·的无效消耗,不利于苯的进一步降解[19]。
2.2 HAH-GLA-Fe(Ⅱ)/SPC体系中苯降解机制研究
2.2.1 自由基探针试验


图4 自由基探针试验

图5 GLA-Fe(Ⅱ)/SPC体系和HAH-GLA-Fe(Ⅱ)/SPC体系中自由基EPR谱图
2.2.2 自由基清扫试验

图6 异丙醇和CF对体系中苯降解效果的影响
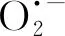
2.3 水质条件对HAH-GLA-Fe(Ⅱ)/SPC体系降解苯的影响
图7显示了溶液初始pH、无机阴离子和HA对HAH-GLA-Fe(Ⅱ)/SPC体系中苯降解的影响。试验中,SPC摩尔浓度为2.00 mmol/L,GLA、Fe(Ⅱ)、HAH和苯的摩尔浓度均为1.00 mmol/L。控制组溶液初始pH值为6.0。

图7 水质条件对苯降解的影响
由图7(a)可知,溶液初始pH对体系中苯的降解具有显著影响。当溶液初始pH值为9时,苯的降解率为37.0%,明显低于控制组63.7%的苯降解率。当溶液初始pH值为11时,苯降解率最低(16.4%),说明碱性条件抑制了体系中苯的降解,且随着pH的升高,抑制作用明显增强。此时,溶液终点pH值为8.73,远高于控制组的终点pH,高pH的碱性环境促使Fe离子沉淀,降低体系催化能力。此外,研究指出高pH的碱性环境下,羟胺更易与HO·反应,增加了HO·的无效消耗,降低了体系的氧化能力,从而抑制了污染物的降解[24]。
当溶液初始pH值为3.0和4.5时,苯降解率均为68%左右,略高于控制组苯降解率,且终点pH值均低于3.0,说明酸性环境有利于苯的降解。这是因为酸性环境有利于体系中Fe离子以溶解态形式存在,提高体系的催化能力。且当pH值<5.96时,HAH以NH3OH+为主要存在形式,而HO·与NH3OH+反应速率较慢,减少了HO·的无效消耗,提高了体系的氧化能力[18,25]。此外,体系中苯的降解在pH值=7.0时,没有受到明显抑制,说明HAH-GLA-Fe(Ⅱ)/SPC体系可在中性条件下有效降解水溶液中的苯。
(1)
(2)


IbR=(RcB-ReB)/RcB×100%
(3)
其中:RcB、ReB——GLA-Fe(Ⅱ)/SPC、HAH-GLA-Fe(Ⅱ)/SPC体系中苯的最终去除率。
2.4 HAH-GLA-Fe(Ⅱ)/SPC体系对实际地下水中苯的降解效果

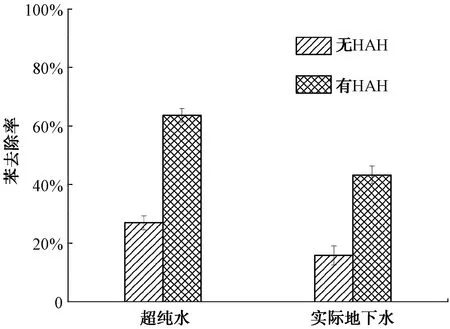
图8 实际地下水中HAH-GLA-Fe(Ⅱ)/SPC体系对苯的降解效果

表和HA对GLA-Fe(Ⅱ)/SPC和HAH-GLA-Fe(Ⅱ)/SPC体系苯去除的抑制率
在实际地下水中,HAH的加入使苯去除率由15.8%升至43.3%,说明HAH增强了GLA-Fe(Ⅱ)/SPC体系对苯的去除效果,提高了体系在实际地下水中的适用性。
3 结论
(1)还原剂HAH、ASC和抗坏血酸钠促进了GLA-Fe(Ⅱ)/SPC体系中苯的降解,且促进效果最佳的还原剂为HAH,但过量的HAH对苯去除率进一步提高不利。
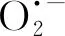

(4)HAH-GLA-Fe(Ⅱ)/SPC体系更适用于实际地下水中苯的降解。
