囊型棘球蚴病Antigen 5 iELISA检测方法的建立和应用*
2022-06-15余闻静叶航羊严茹心左钱飞范俊杰龙宇鹏
余闻静,叶航羊,严茹心,左钱飞,范俊杰,龙宇鹏△
1.陆军第九五八医院检验科,重庆 400023;2.西藏军区总医院肝胆科,西藏拉萨 850000;3.陆军军医大学第一附属医院肿瘤科,重庆 400038;4.陆军军医大学药学系微生物与生化教研室,重庆 400038
棘球蚴病又称包虫病,是一种重要的人畜共患寄生虫病。棘球蚴病一般分为囊型棘球蚴病(CE)和泡型棘球蚴病(AE),分别由细粒棘球绦虫和多房棘球绦虫感染引起[1]。该病呈现世界性分布,每年感染率超过0.05%;在我国西部,该病的流行尤其严重,感染率可以达到5%~10%,是平均水平的100余倍。据保守估计,全球由于CE产生的最低伤残调整寿命年(一种衡量人们健康受损的指标)约为28.5 万年,每年可造成1.94亿美元经济损失[2],给公共健康和安全以及农业发展造成巨大影响。
细粒棘球绦虫的感染性较强,主要寄生于肝脏。根据WHO分级标准,将CE患者分为3级:感染期(C1、C2期)、过渡期(C3期)以及潜伏期(C4、C5期)[3-4]。目前,对于CE患者主要的治疗策略为药物治疗(如阿苯达唑、苯并咪唑),但仍有20%~40%的深度感染期患者并不能彻底治愈[5],因此,早期的临床诊断具有重要的现实意义。临床上,CE的诊断一方面依靠影像学方法,如X线片、CT、MRI等[6-8],另一方面依靠血清学检测方法,如酶联免疫吸附试验(ELISA)等。目前,建立血清学检测方法的抗原一般采用的是包囊液粗提物,由于无法排除宿主本身的抗原蛋白,检测结果往往出现假阳性[9-10]。Antigen 5(Ag5)是CE中免疫原性最强、富集程度最高的抗原之一,伴随细粒棘球绦虫整个生命周期[11]。本研究选取Ag5作为目标抗原,建立间接ELISA(iELISA)法,通过检测血清中Ag5抗体水平实现对CE患者高特异度和高灵敏度的临床诊断。
1 资料与方法
1.1一般资料 选择2019年1月至2021年1月西藏军区总医院收治的184例肝CE患者,平均年龄(48±13)岁。采集所有患者血清,1 000 ×g离心后冻存于-80 ℃备用。同时,收集同期在陆军第九五八医院体检的126例健康人血清作为阴性对照。本研究经西藏军区总医院和陆军第九五八医院医学伦理委员会批准,所有受试者知情同意。纳入标准:(1)影像学手段(CT或MRI)明确诊断肝CE;(2)基本信息完整,临床及影像资料齐全。排除标准:(1)资料信息不完善;(2)具有对试验结果产生干扰的其他疾病;(3)因某些情况不能配合检查。
1.2主要试剂 大肠埃希菌DH5α及BL21(DE3)购自北京全式金生物科技有限公司;pGEX-6P-2 原核表达载体由陆军第九五八医院检验科实验室保存;质粒提取试剂盒购自美国Omega公司;高保真DNA聚合酶、DNA Marker、BamH Ⅰ和NotⅠ限制性内切酶购自大连TakaRa公司;PreScission protease(PSP酶)购自瑞士GE Healthcare公司;HRP标记的小鼠抗人IgG(H+L)抗体购自美国Jackson Immuno-Research Laboratories;检测棘球绦虫IgG的商品化试剂盒购自德国R-Biopharm AG公司;进口或国产分析纯。
1.3重组蛋白的构建、表达与纯化 以细粒棘球绦虫基因组DNA基因组为模板,通过构建引物进行PCR。上游引物:5′-GCGGGATCCATGGCGAGATCGCGGCCCCTTTGGATCGTTTTCGTCTGTC-3′(下划线为BamH Ⅰ酶切位点); 下游引物:5′-GCGGCGGCCGCTTAGACTGCGTAGCGGTTGATCCACTGGATG ACACTGCCCAC-3′(下划线为NotⅠ酶切位点)。经BamHⅠ和NotⅠ双酶切后将PCR产物及pGEX-6P-2质粒进行连接获得pGEX-6P-2-Ag5。连接产物转化至XL-1blue,挑取单克隆于30 ℃摇床振荡培养至600 nm处吸光度(A)为0.6终止,加入100 μg/mL IPTG 于30 ℃诱导3 h。超声裂解后高速离心15 min,分离上清液和沉淀;将Glutathione Sepharose 4B加入上清液中,4 ℃旋转过夜。离心收集特异性结合GST融合蛋白的Glutathione Sepharose 4B,随后加入等体积PBS和PSP酶(酶量体积比为1∶10),于室温进行酶切,再次离心后吸取上清液,重悬于PBS中备用。
1.4iELISA方法的建立
1.4.1最佳包被浓度及反应条件 将纯化后的Ag5蛋白按200 ng/mL包被于96孔板后置于4 ℃过夜,次日用1× PBST(PBS含0.05%吐温)洗涤,接着利用2%的牛血清清蛋白(BSA)在37 ℃ 封闭2 h;将待检血清进行1∶200稀释后于37 ℃ 孵育1 h;孵育完成后,利用HRP标记的抗人IgG二抗(1∶50 000稀释)继续孵育30 min;彻底洗涤后,加入TMB室温显色15 min;在450 nm条件下读取并扣除背景A值即为样品读值。
1.4.2临界值的确定 为了提高Ag5包被的iELISA法的灵敏度及特异度,选取29例健康人血清为阴性对照;阳性对照来自经影像学及手术确诊的34例CE患者。阳性和阴性对照的血清分别经商品化棘球蚴病检测试剂盒确认。设置重复孔,检测并读取各血清标本的A比值,经受试者工作特征(ROC)曲线分析以确定最佳临界值。利用(A待检血清-A阴性对照)/(A阳性对照-A阴性对照)计算出A比值,A比值越高,表明Ag5抗体水平越高。
1.5统计学处理 使用GrapPad Prism 7软件进行数据分析及作图。计数资料以例数、百分率表示,组间比较采用χ2检验;计量资料两组间比较采用Wilcoxon检验,多组间比较采用Kruskal-WalisH检验,组间两两比较采用Mann Whitney-U检验;采用ROC曲线评估本研究建立的iELISA方法的诊断效能;以P<0.05为差异有统计学意义。
2 结 果
2.1CE患者分型 经CT、MRI影像学分析,约80%(152/184)的CE患者表现为肝脏单一病灶,另有部分CE患者(32/184)呈现不同器官或组织如肺脏、肾脏、皮下等的散发病灶。所有病例中,包囊过渡型CE患者(CE3a、CE3b)占比(52.7%)最高,活化型(CE1、CE2)及失活型(CE4、CE5)CE患者分别为19.6%和27.7%。见表1。
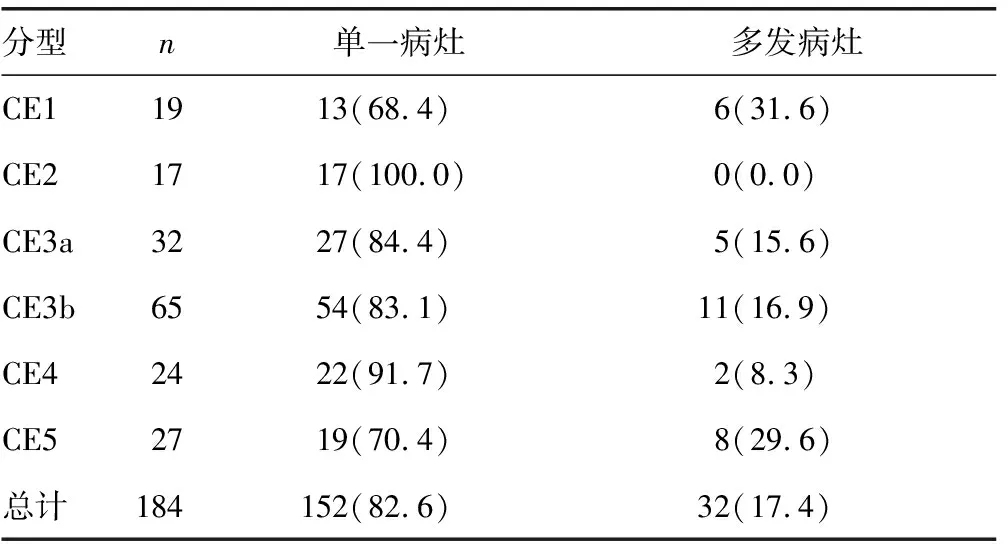
表1 CE患者的数量及分型[ n(%)]
2.2重组蛋白Ag5的构建、表达 以细粒棘球绦虫基因组DNA为模板,PCR扩增出目的条带,片段大小为1 455 bp,与预期结果符合。融合表达载体pGEX-6P-2-Ag5构建后经双酶切鉴定及测序分析无误后,转入XL-1blue,获得重组菌株。诱导表达获得Ag5/GST重组融合蛋白,PSP酶酶切Ag5/GST重组融合蛋白,酶切后目的蛋白经SDS-PAGE电泳,如图1所示,与预期目的蛋白分子量大小一致。
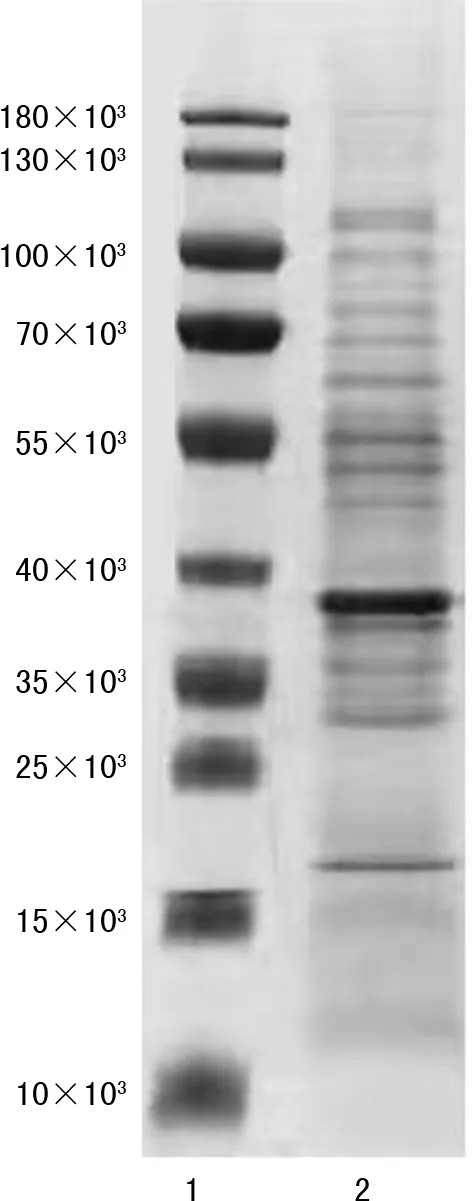
注:1为蛋白分子量标准;2为重组表达蛋白。
2.3iELISA方法的建立及应用
2.3.1临界值的确定 利用Ag5包被的iELISA方法对阴性和阳性血清标本进行检测,ROC曲线分析显示,曲线下面积(AUC)为0.972,当临界A比值为0.46时,iELISA方法具有最佳的灵敏度和特异度,其中灵敏度为91.6%,特异度为96.3%。见图2。
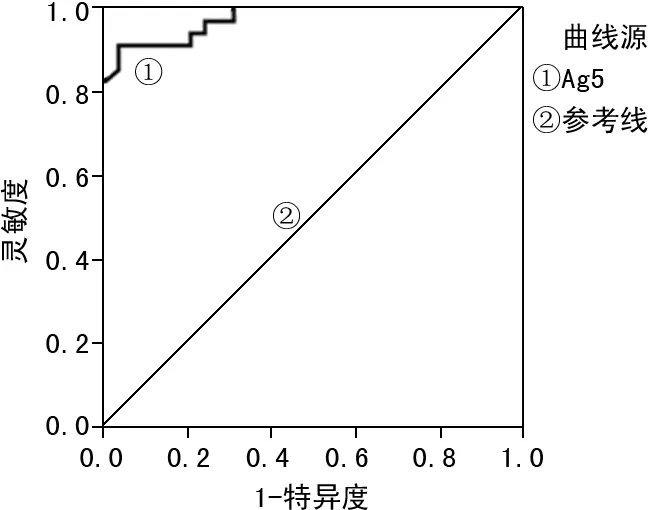
图2 iELISA方法诊断CE的ROC曲线
2.3.2CE患者及健康人Ag5抗体检测结果 应用本研究建立的iELISA方法对收集的CE患者及健康人血清的Ag5抗体进行检测。如图3A所示,与健康人相比,CE患者血清中A比值明显高于健康人(P<0.05),表明CE患者血清中存在高水平的Ag5抗体。图3B显示,相对于CE1和CE2阶段的患者,处于过渡期的CE3a及CE3b患者血清中具有较高水平的Ag5抗体(P<0.05),而处于包囊无活性阶段的CE4和CE5患者血清Ag5抗体水平较低,但差异无统计学意义(P>0.05)。
采用本研究建立的iELISA方法及商品化棘球蚴病检测试剂盒分别对CE患者及健康人Ag5抗体血清进行平行检测。结果显示:iELISA方法及商品化试剂盒在CE1、CE2、CE3a、CE3b阶段的CE患者检测中表现出相近的阳性率,并且对于CE2、CE3b阶段的CE患者,阳性率均在90%以上。对于CE4和CE5阶段的患者,iELISA方法检测的阳性率明显高于商品化试剂盒(CE4:83.3%vs.70.8%,CE5:63.0%vs.48.1%),差异均有统计学意义(P<0.05)。见表2。

注:A表示CE患者与健康人血清中Ag5抗体水平比较;B表示不同分型的CE患者血清中Ag5抗体水平比较;与健康人比较,#P<0.05; 与CE1、CE2比较,*P<0.05。
2.3.3不同临床特征的CE患者检测结果 按照包囊活性、包囊数量、是否接受药物或手术治疗等将患者分组,分别统计其样本数量及阳性率。有活性包囊、多包囊、接受药物治疗的患者阳性率均高于无活性包囊、单包囊、未接受药物治疗的患者(91.7%vs. 72.5%,94.0%vs.84.8%,94.1%vs.72.3%),差异均有统计学意义(P<0.05),而手术治疗患者的阳性率与未手术治疗的患者相比差异无统计学意义(P>0.05)。见表3。
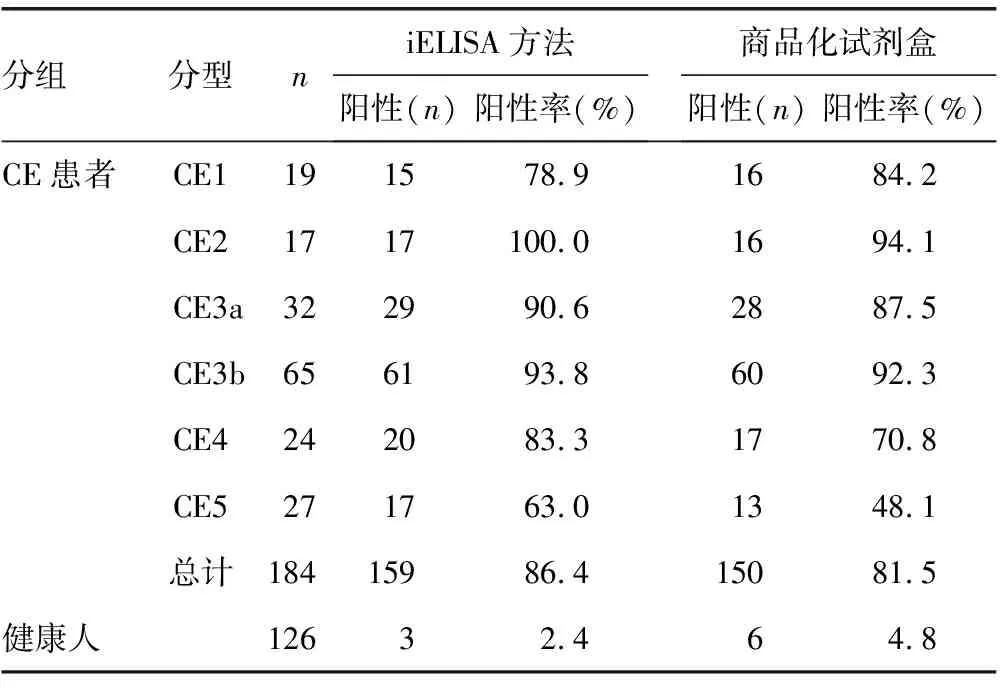
表2 本研究建立的iELISA方法与商品化试剂盒检测Ag5抗体结果的对比
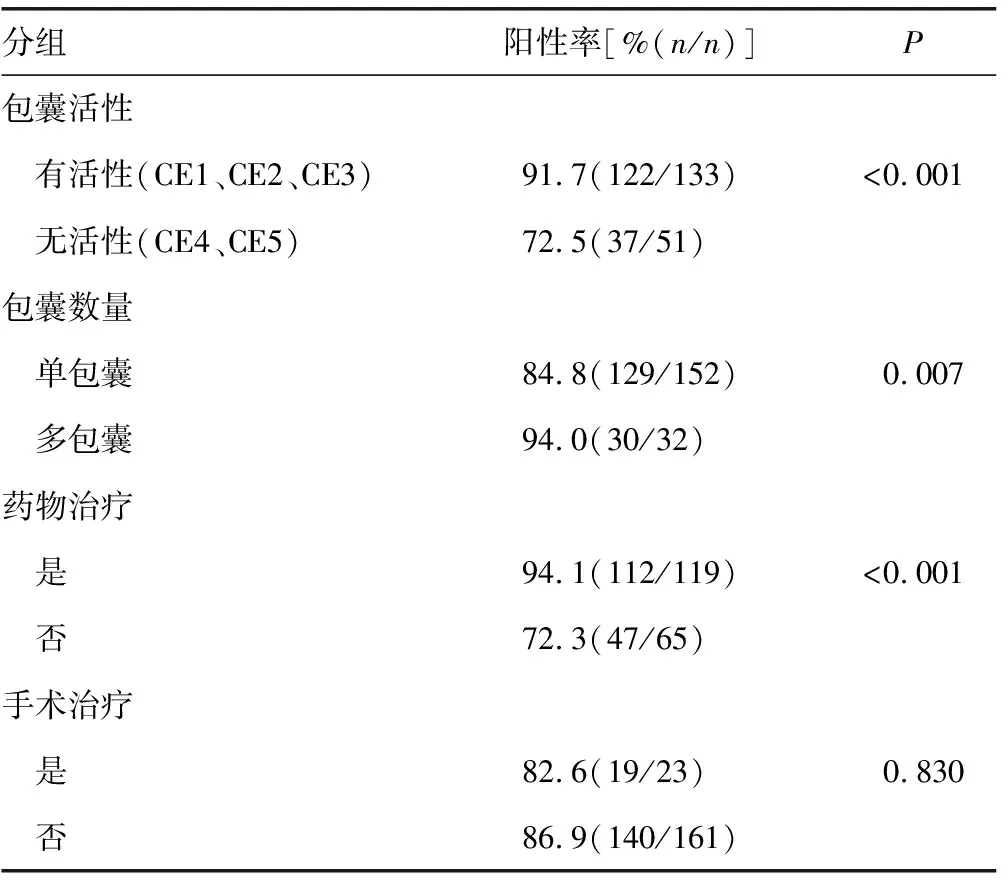
表3 利用iELISA检测不同CE患者的结果
3 讨 论
CE是一种严重的人畜共患病,对公共健康及农业经济造成巨大损失。早期诊断可以帮助CE患者通过药物治疗及时清除感染。细粒棘球绦虫感染后通常不表现出剧烈的症状,但机体会很快建立体液及细胞免疫反应。有证据表明,Th2细胞是介导抗细粒棘球绦虫的重要T细胞亚群,其分泌的白细胞介素(IL)-4能够参与特异性IgG1抗体的产生[12];据报道,在感染细粒棘球绦虫的小鼠模型中发现,IL-12协同γ-干扰素(IFN-γ)可以显著上调特异性IgG2a抗体水平[13],说明Th1细胞亚群在抗感染过程中也发挥一定的作用。
CE的临床诊断可采用影像学方法,但该方法受限于技术操作等难以实现大范围的筛查;而血清学方法能够很好地弥补其不足,是检测CE的重要手段。补体结合试验(CFT)、间接红细胞凝集试验(IHA)因为缺乏较高的灵敏度和特异度,逐渐被ELISA、间接免疫荧光(IFAT)、免疫电泳(IEP)等所取代[14]。除此之外,多种快速检测CE的方法已被建立并报道:研究者利用特异性抗原包被的试纸,在短时间内可完成对CE的诊断[15];利用棘球绦虫特异性表达的4种抗原建立的斑点金免疫渗滤测定法(DIGFA),能够在极短时间内显示检测结果[16];另外,针对细粒棘球绦虫线粒体基因,利用重组酶介导等温核酸扩增技术(RAA)在不依赖PCR仪的情况下能够快速进行基因诊断[17]。在进一步提高灵敏度和特异度之后,这些方法都具有诊断CE的临床应用潜力。
据调查,在CE流行的地区,约1/4的受检者呈现包虫囊液提取物抗体阳性,但是只有少部分CE患者被确诊,说明血清中包虫囊液抗体水平并不能特异性地作为检测指标[18]。抗原的交叉反应限制了包囊液在CE临床诊断中的价值[19]。目前,多种抗原已被鉴定并应用于血清学检测中,如AgB[16]、EpC1[20]、Eg19[21]、C317、E14t[22]等。与这些抗原不同的是,Ag5能够在细粒棘球绦虫感染的不同阶段均表现出免疫原性[10],根据这一特征,本研究选择Ag5作为目标抗原建立特异性检测细粒棘球绦虫抗体的iELISA方法。
利用本研究建立的iELISA方法对184例CE患者进行检测,结果发现,与商品化试剂盒检测方法相比,iELISA方法具有更低的假阳性率(2.4%vs. 4.8%)。此外,处于活性包囊以及多包囊阶段的CE患者呈明显的高阳性率,提示CE患者血清中特异性细粒棘球绦虫抗体水平与包囊数量、活性状态密切相关。另外,经过药物治疗的CE患者也有较高的阳性率,推测可能是由于药物导致包囊被破坏,抗原释放至外周血中所致。因此,基于Ag5建立的iELISA方法不仅能够用于CE的临床诊断,对于评价药物或手术治疗的有效性同样存在应用价值。
