SIRT1、ATF4、KL-6蛋白在COPD患者肺组织中的表达及与气道重塑的相关性研究*
2022-06-15骆玉兔潘家华田胤纯
骆玉兔,潘家华,刘 云,田胤纯,刘 俊
江苏省泰州市第二人民医院呼吸与危重症医学科,江苏泰州 225500
慢性阻塞性肺疾病(COPD)是呼吸系统一种常见的多发性疾病,病死率较高,主要致病因素是过多吸入有害颗粒或气体,造成肺内的氧化应激反应、肺部炎症等,多发于中老年人群[1]。现阶段的治疗方案虽获得一定疗效,但无法完全抑制病情发展,在降低患者病死率方面效果不佳[2]。为了阐明COPD发病机制需要探讨COPD病情发展中的特异性生物标志物,这是开发临床新药、改善患者预后的关键。沉默信息调节因子相关酶1(SIRT1)参与细胞应激反应机制并发挥一定调控作用;活化转录因子4(ATF4)在氧化应激反应中具有一定的调控作用;表达于Ⅱ型肺泡上皮细胞表面的涎液化糖链抗原-6(KL-6)是一种糖蛋白,在肺疾病中具有一定的预测价值[3-5]。但SIRT1、ATF4、KL-6在COPD病情发展与气道重塑中的研究较少。因此本研究旨在分析不同病情严重程度COPD患者SIRT1、ATF4、KL-6蛋白的水平差异,探讨COPD患者不同气道重塑程度与SIRT1、ATF4、KL-6蛋白表达的相关性,探讨SIRT1、ATF4、KL-6蛋白在COPD病情发展以及气道重塑中的可能调控机制。
1 资料与方法
1.1一般资料 收集2020年1月至2021年5月在本院呼吸与危重症医学科诊断为急性加重期COPD合并肺肿瘤、稳定期COPD合并肺肿瘤的肺叶切除组织蜡块标本各40例分别作为急性期组、稳定期组,另选取本院呼吸内科保存的40例确诊为非COPD的肺肿瘤患者肺叶切除组织蜡块标本作为对照组,收集所有研究对象的临床资料。急性期组:男21例,女19例;年龄35~66岁,平均(54.41±3.22)岁;体质量指数(BMI)18~25 kg/m2,平均(21.43±1.03)kg/m2;病程1~12年,平均(6.38±2.11)年;有糖尿病史23例,吸烟史22例,饮酒史23例。稳定期组:男20例,女20例;年龄35~64岁,平均(54.39±3.22)岁;BMI 18~25 kg/m2,平均(21.38±1.02)kg/m2;病程1~12年,平均(6.38±2.11)年;有糖尿病史21例,吸烟史24例,饮酒史22例。对照组:男23例,女17例;年龄35~65岁,平均(54.39±3.19)岁;BMI 18~25 kg/m2,平均(21.41±1.05)kg/m2;病程1~13年,平均(6.35±2.12)年;有糖尿病史22例,吸烟史23例,饮酒史25例。3组年龄、性别、病程、既往病史等基线资料差异均无统计学意义(P>0.05),具有可比性。将COPD患者依据临床资料中的高分辨CT气道重塑检查结果划分气道重塑程度,选择支气管外径大小1~5 mm为对象,计算气道壁面积占总横截面积比[WA%=(气道总面积-气道管腔面积)/气道总面积],采用WA%作为评估患者气道重塑情况的指标,按照<60%、≥60%~85%、>85%划分为无气道重塑组、轻中度组、重度组,分别为30例、30例、20例。所有研究对象及其家属均详细了解研究内容,在个人意愿下表示愿意参与并签订知情同意书。本研究已通过本院伦理委员会审核批准。
COPD纳入标准:(1)患者症状及肺功能指标水平变化符合《慢性阻塞性肺疾病诊疗指南》[6]中COPD诊断标准,经病理学等一系列检查以及专家诊断,确诊为COPD;(2)语言表达能力正常,可进行无障碍沟通,可对自身疾病症状情况进行有效反馈描述,并可以对自身的生活质量、满意度等进行合理评价;(3)临床资料完整,包含气道重塑、肺功能等检查项目;(4)合并肺肿瘤行肺叶切除术。
排除标准:(1)合并肺气肿、慢性支气管炎和支气管哮喘疾病;(2)除本研究外还参与其他研究、试验的患者;(3)临床资料不完整;(4)智力低下或患有精神疾病导致认知障碍,无法沟通、反馈以及配合研究。
1.2方法 采用Western blotting法[7]检测肺组织SIRT1、ATF4、KL-6蛋白水平。肺叶切除术组织蜡块标本切片脱蜡研磨后,加入200 μL裂解缓冲液并充分混匀,冰浴30 min,细胞充分裂解后在4 ℃条件下,按照1 300 r/min离心10 min。提取上清液分装于容器中,在-20 ℃环境中保存备用。蛋白浓度使用BCA分析试剂盒进行检测,经聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后将蛋白进行转膜,转移至PVDF膜并进行标记,使用TBST进行重复洗膜,至少3次,每次持续10 min。将5%浓度的脱脂奶粉加入进行封闭处理,持续2 h,加入一抗溶剂在37 ℃环境中进行摇床,振荡混匀后进行孵育,过夜。使用TBST进行清洗,重复清洗3次,每次持续10 min。加入二抗试剂在室温环境中持续反应2 h,使用TBST进行清洗,重复清洗3次,每次持续5~10 min。在ECL化学发光液暗盒中进行曝光。将获得的结果应用Gel-Pro32软件进行灰度分析,以2-ΔΔCt计算SIRT1、ATF4、KL-6蛋白的表达情况。
1.3观察指标 (1)对比3组肺组织SIRT1、ATF4、KL-6蛋白水平;(2)绘制受试者工作特征(ROC)曲线分析肺组织SIRT1、ATF4、KL-6蛋白检测在COPD诊断中的应用价值,包括灵敏度、特异度、曲线下面积(AUC);(3)分析无气道重塑组、轻中度组、重度组的肺组织SIRT1、ATF4、KL-6蛋白表达与COPD患者气道重塑的相关性。
2 结 果
2.1比较3组肺组织SIRT1、ATF4、KL-6蛋白水平差异 与对照组相比,急性期组、稳定期组的肺组织SIRT1蛋白水平明显降低(P<0.05),肺组织ATF4、KL-6蛋白水平明显升高(P<0.05);且与稳定期组相比,急性期组的肺组织SIRT1蛋白水平明显降低(P<0.05),肺组织ATF4、KL-6蛋白水平明显升高(P<0.05)。见表1、图1~3。
表1 各组肺组织SIRT1、ATF4、KL-6蛋白水平比较

图1 各组SIRT1蛋白免疫组化结果(×200)

图2 各组ATF4蛋白免疫组化结果(×200)

图3 各组KL-6蛋白免疫组化结果(×200)
2.2肺组织SIRT1、ATF4、KL-6蛋白检测诊断COPD的效能分析 肺组织SIRT1、ATF4、KL-6蛋白检测诊断COPD的灵敏度、特异度均在70.00%以上,AUC均在0.740以上。见表2、图4。
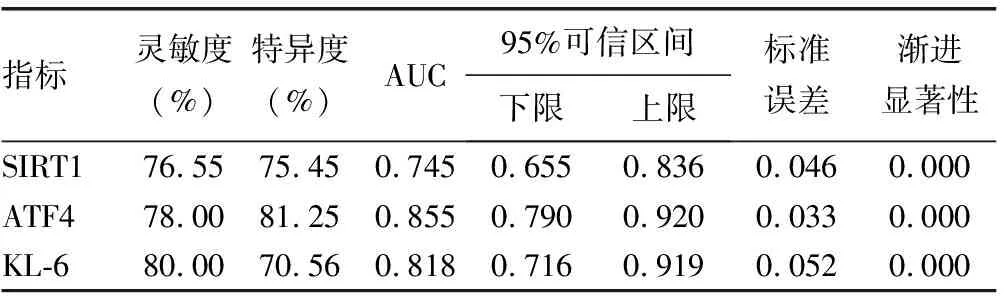
表2 肺组织SIRT1、ATF4、KL-6蛋白检测对COPD的诊断效能
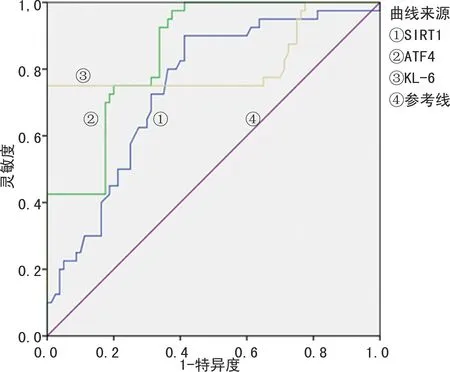
图4 肺组织SIRT1、ATF4、KL-6蛋白诊断COPD的ROC曲线
2.3不同气道重塑程度COPD患者肺组织SIRT1、ATF4、KL-6蛋白水平差异及其相关性 与无气道重塑组相比,重度组、轻中度组的肺组织SIRT1蛋白水平明显降低(P<0.05),肺组织ATF4、KL-6蛋白水平明显升高(P<0.05);重度组的SIRT1蛋白水平与轻中度组相比明显降低(P<0.05),ATF4、KL-6蛋白水平明显升高(P<0.05)。见表3。
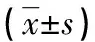
表3 不同气道重塑程度COPD患者肺组织SIRT1、ATF4、KL-6蛋白表达差异
COPD患者气道重塑WA%与肺组织SIRT1蛋白表达呈负相关(r=-0.635,P<0.001),与肺组织ATF4、KL-6蛋白表达呈正相关(r=0.768、0.892,P<0.001)。见图5~7。

图5 气道重塑WA%与肺组织SIRT1蛋白相关性
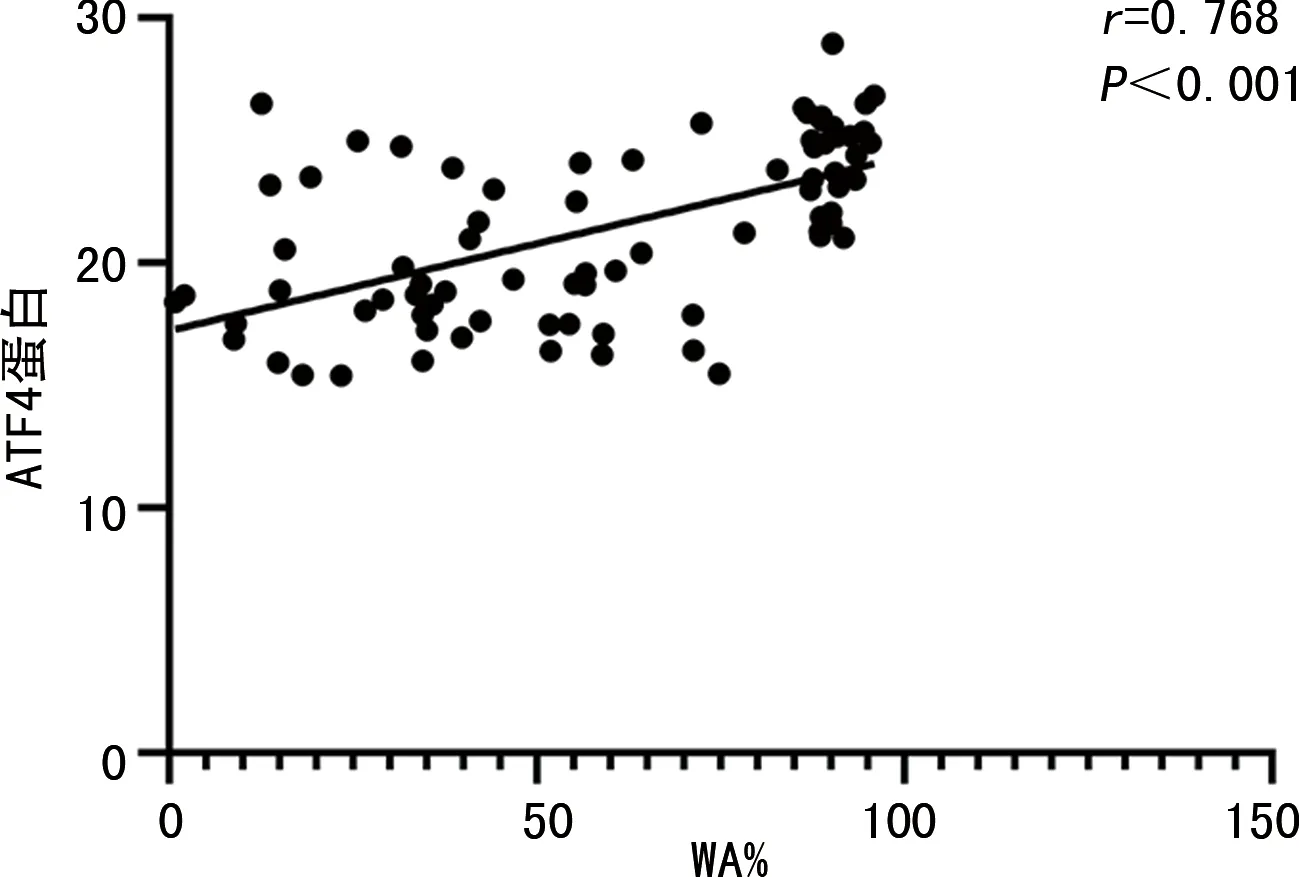
图6 气道重塑WA%与肺组织ATF4蛋白相关性
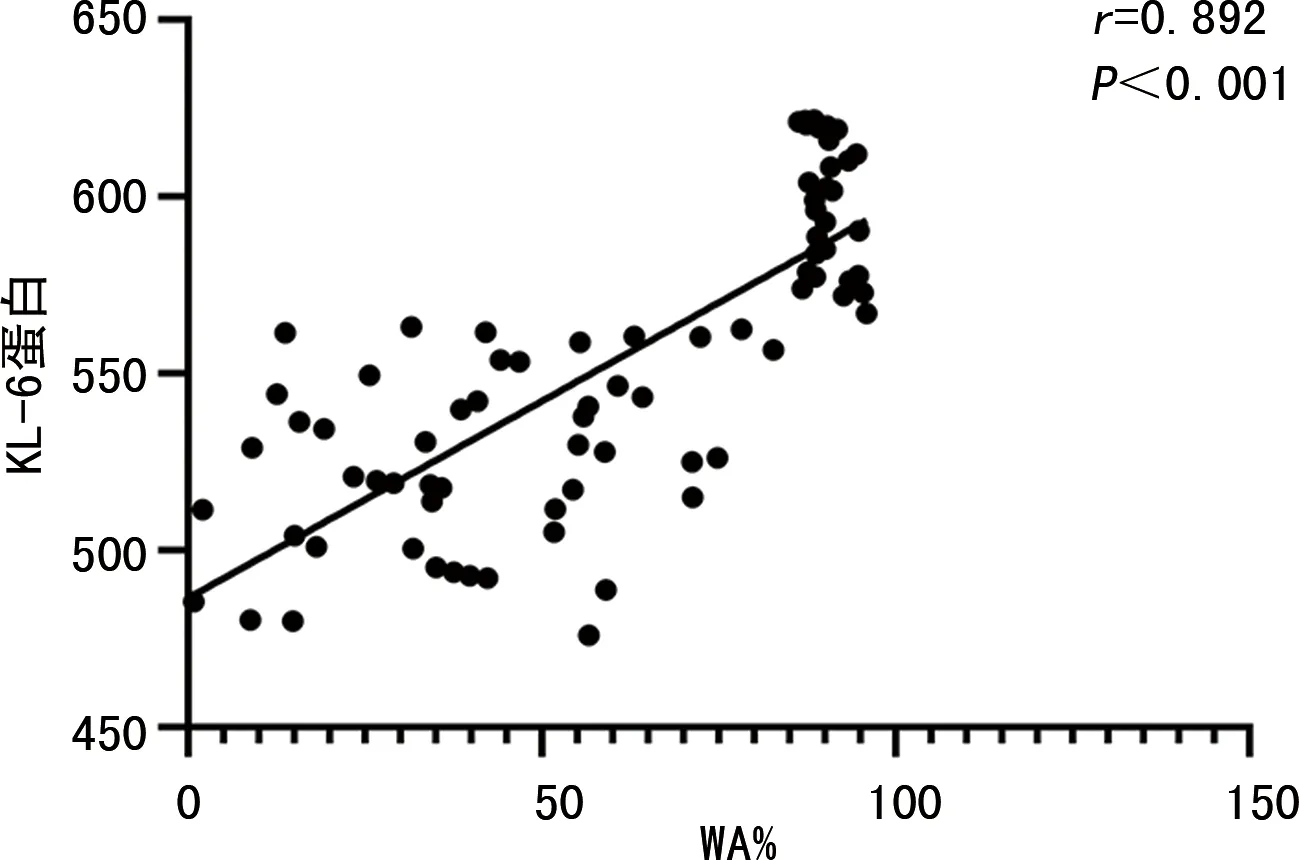
图7 气道重塑WA%与肺组织KL-6蛋白相关性
3 讨 论
绝大多数COPD患者死亡归因于吸烟,吸烟是导致COPD患者病情急性发作、症状加重的主要原因。COPD急性加重主要特征为呼吸症状加重,其表现为呼吸困难加重、咳嗽次数和咳痰量增加以及气道受阻。已有数据表明COPD患者的致死率随着气道重塑加重而相应升高[8]。
SIRT1是Sirtuins中的重要组成成员,Sirtuins可通过多种途径参与COPD疾病进展,并发挥一定的调控作用[9]。COPD小鼠的炎性反应以及免疫抑制诱发巨噬细胞大量聚集,进而引起p65乙酰化增强,促使SIRT1大量转化且活性降低,最终导致SIRT1在COPD小鼠肺组织中低表达,而上调SIRT1水平可能是后续COPD治疗的一个新方向[10]。分析WA%与SIRT1蛋白水平呈负相关的作用机制如下:基质金属蛋白酶9(MMP9)与气道重塑存在密切联系,对多糖以外的细胞外基质(ECM)成分降解具有明显的调控作用,ECM降解以及过度沉积会造成气道壁结构异常、气道重塑[11]。郭国华等[12]研究提出SIRT1低表达可促进MMP-9高表达,进而参与COPD患者的气道重塑发生与发展过程并发挥一定的调控作用。本研究结果显示,与对照组相比,COPD患者肺组织的SIRT1蛋白水平明显降低,COPD患者的气道重塑评估指标WA%与SIRT1蛋白水平呈负相关,SIRT1诊断COPD的灵敏度、特异度均>75.00%,AUC>0.740,与以上机制及研究结论相符,提示COPD患者肺组织SIRT1蛋白参与COPD的发生、发展及患者的气道重塑过程,SIRT1的异常变化可准确诊断COPD。
氧化物会破坏蛋白质、核酸等生物大分子结构,造成细胞凋亡,进而促使COPD发生与病情进展,而作为转录活性因子之一的ATF4对抗氧化剂表达具有一定的调控作用。在氧化及抗氧化过程中可发挥重要作用,而COPD患者多具有严重的氧化应激反应,在氧化应激状态下,ATF4呈高水平表达[13]。刘娜等[14]研究报道,呼吸道感染等刺激引起中性粒细胞、嗜酸性粒细胞、巨噬细胞聚集,导致活性氧大量释放,刺激气道上皮细胞分泌高分子复合糖,破坏黏膜屏障,使血管内皮细胞通透性提升,进而导致气道损伤加重,而氧化应激会诱发蛋白质结构改变,促使平滑肌收缩以及肥大细胞激活,气道分泌物也会异常增加,最终造成气道重塑。ATF4作为应激反应早期应答因子表达明显上调,影响抗氧化酶γ-GCS的表达,从而对细胞氧化还原能力、氧化应激反应起到一定的调控作用,推测AFT4通过调控氧化应激反应参与气道重塑。本研究结果中COPD患者肺组织ATF4蛋白明显高于对照组,COPD患者的气道重塑评估指标WA%与COPD患者的ATF4蛋白表达呈正相关,与以上机制及研究结论相符。另外,本研究结果显示ATF4蛋白诊断COPD的灵敏度、特异度均>78.00%,AUC>0.850,提示COPD患者肺组织ATF4蛋白在COPD病情发生、发展、气道重塑过程中有所参与并发生明显变化,ATF4蛋白在诊断COPD中具备良好的诊断效能。
KL-6存在于Ⅱ型肺泡上皮细胞表面,可以通过细胞脱落进入血液、肺泡腔。NAKAMURA等[15]研究显示,KL-6可促使纤维细胞分泌胶原蛋白,同时诱导胶原蛋白分化为肌成纤维细胞,最终造成肺组织出现上皮-间质转变及细胞外基质过度沉积。COPD患者KL-6高表达的主要原因可能是COPD患者伴随一定肺损伤,患者体内的巨噬细胞大量分泌炎症细胞因子引发严重的肺泡炎性反应,炎性反应使KL-6从肺泡内渗透到血液中,进而导致KL-6高水平表达。彭伟等[16]多因素Logistic回归分析显示KL-6升高是肺癌患者发生放射性肺炎的独立危险因素,KL-6高表达会引发严重的炎性反应。而肿瘤坏死因子-α(TNF-α)等炎症因子具有促进炎症细胞浸润、活化的作用,在炎性反应状态下TNF-α呈高表达,TNF-α可刺激气道平滑肌细胞分泌内皮素1(ET-1)促使气道平滑肌收缩,进而导致气道细胞异常增殖,最终导致气道重塑。本研究结果显示,与对照组相比,COPD组肺组织KL-6蛋白明显升高,COPD患者的气道重塑评估指标WA%与KL-6蛋白表达呈正相关,与以上文献数据、结论相符。另外,本研究结果显示,KL-6蛋白在COPD诊断中的灵敏度、特异度均>70.00%,AUC>0.810,提示KL-6蛋白在COPD发生、发展及患者的气道重塑过程中均有参与并发挥一定的调控作用,KL-6蛋白在COPD临床诊断中有良好的诊断效能。
本研究仍存在一定不足,例如研究样本量相对较少,并且WA%不是气道重塑的唯一评估指标,虽获得的数据、结论具有临床文献支持,但研究设计思路仍有进一步完善的空间,为提高数据、结论的可信度应进一步扩大样本量,对本研究数据、结论进行深入研究验证。
总之,COPD患者肺组织中SIRT1蛋白呈低表达,ATF4、KL-6蛋白均呈高表达,在COPD病情发展、气道重塑中SIRT1、ATF4、KL-6蛋白均有参与,在COPD临床诊断中具有良好的诊断效能,可作为COPD诊断及气道重塑后续临床治疗的新研究方向。
