血清S100A12、IL-17A在预测冠状动脉药物洗脱支架植入术后支架内再狭窄的临床价值*
2022-06-15汤万春尹永厚
汤万春,尹永厚,谢 瑞
包头医学院第二附属医院心血管内科,内蒙古包头 014030
冠心病是以冠状动脉血管壁内出现粥样硬化性斑块为主要特征的心血管疾病之一,也是心绞痛、心肌梗死和缺血性心力衰竭的主要高危因素[1]。经皮冠状动脉介入(PCI)是目前治疗冠心病最有效的血管重建策略之一,尤其是药物洗脱支架(DES)的出现,可明显降低急性血管闭塞和二次血运重建的风险;但是仍有部分患者会发生支架内再狭窄(ISR)[2-3]。因此,寻找预测冠心病介入治疗后ISR发生的生物标志物,对于优化治疗方案、改善预后具有重要意义。PCI术后ISR是一个复杂的过程。血管内皮细胞完整性的破坏可引起内膜增生、血管重构和弹性反冲,并涉及炎性反应。例如Th17细胞可分泌白细胞介素-17A(IL-17A),刺激细胞间黏附分子和促炎细胞因子的释放[4]。此外S100钙结合蛋白A12(S100A12)是一种促炎因子,主要在粒细胞中表达,在许多急性和慢性疾病中都有报道[5]。因此笔者推测血清S100A12、IL-17A可能是反映机体广泛炎症状态的新型生物标志物。基于此,本研究旨在探讨血清S100A12、IL-17A在预测冠状动脉DES植入术后ISR发生风险的临床价值。
1 资料与方法
1.1一般资料 本研究为前瞻性队列研究,2020年1-12月连续招募于本院接受西罗莫司洗脱支架-PCI治疗的冠心病患者230例作为研究对象。纳入标准:(1)根据血管造影诊断为冠心病;(2)接受择期或急诊PCI,并且在术后常规接受双联抗血小板治疗,至少维持了1年;(3)无PCI临床禁忌证,对西罗莫司洗脱支架无过敏反应;(4)年龄≥18岁。排除标准:(1)有心血管外科史(如PCI、血运重建或冠状动脉旁路移植术);(2)合并急慢性感染、肝肾等脏器功能严重障碍、自身免疫性疾病、血液性疾病、恶性肿瘤等;(3)入组前3个月内使用消炎药或免疫抑制药物治疗;(4)无法定期随访;(5)孕妇或哺乳期妇女。本研究经本院伦理委员会批准。所有患者在登记时都提供了书面同意书。
1.2方法
1.2.1资料收集 入组后记录患者的临床资料,包括:(1)人口学特征,如年龄、性别和体质量指数(BMI);(2)冠心病危险因素,如当前吸烟状况,合并高血压、糖尿病、高胆固醇血症、高尿酸血症情况及冠心病家族史(男性一级亲属在55岁之前或女性一级亲属在65岁之前出现冠心病或心脏猝死);(3)心功能指数,如左室射血分数(LVEF);(4)实验室指标,如平均动脉压(MAP)、空腹血糖(FBG)、血清肌酐(SCr)、血清尿酸(SUA)、心肌肌钙蛋白I(cTnI)、N末端脑钠肽(NT-proBNP)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、高敏C反应蛋白(hs-CRP);(5)病变特征,如动脉病变数目、靶病变数目、靶病变狭窄程度、靶病变长度;(6)介入手术参数,如支架长度、直径、扩张时间;(7)PCI术后使用的药物,如阿司匹林、氯吡格雷、硝酸盐类药物、他汀类药物、β-受体阻滞剂、血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂(ACEIs/ARBs)和钙通道阻滞剂。
1.2.2血清S100A12、IL-17A检测 所有患者在介入前禁食8 h后(冠状动脉造影前)采集外周血标本,收集于含有乙二胺四乙酸二钾的试管中,在4 ℃条件下经离心机2 500×g离心15min,分离上层血清保存于-80 ℃冰箱中待测。IL-17A使用酶联免疫吸附试验(ELISA)试剂盒(eBioscience,美国)检测;S1000A12使用人S100A12 Platinum ELISA试剂盒(eBioscience,美国)检测,组内及组间变异系数分别为5.5%、11.9%。所有检测均严格按照试剂盒说明书进行操作。
1.2.3ISR诊断及分组 介入治疗包括PCI、西罗莫司洗脱支架植入(北京乐普医疗器械有限公司)以及术前、术后处理(如使用阿司匹林、氯吡格雷等)。介入前、介入后及随访12个月(或出现临床表现时)行冠状动脉造影,利用计算机心血管造影分析系统(Pie Medical,荷兰)进行定量冠状动脉造影,分析冠状动脉ISR程度及非介入性病变的纹状体。根据最小管腔直径和参考直径(取自患者任意主要侧分支病变近端及近端5 mm的血管造影正常段)计算直径狭窄百分比(DS%)。随访12个月,ISR被定义为在支架植入节段(包括支架近端和远端边缘5 mm)内,DS%≥50%。在随访期内,根据ISR发生情况将患者分为ISR组及非ISR组。
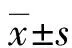
2 结 果
2.12组患者一般临床资料比较 随访12个月,ISR组60例,非ISR组170例。2组患者动脉病变数目、靶病变狭窄程度、靶病变长度、支架长度及HDL-C、SUA、hs-CRP水平比较,差异均有统计学意义(P<0.05)。见表1。

表1 2组患者一般临床资料分析或n(%)或M(P25~P75)]
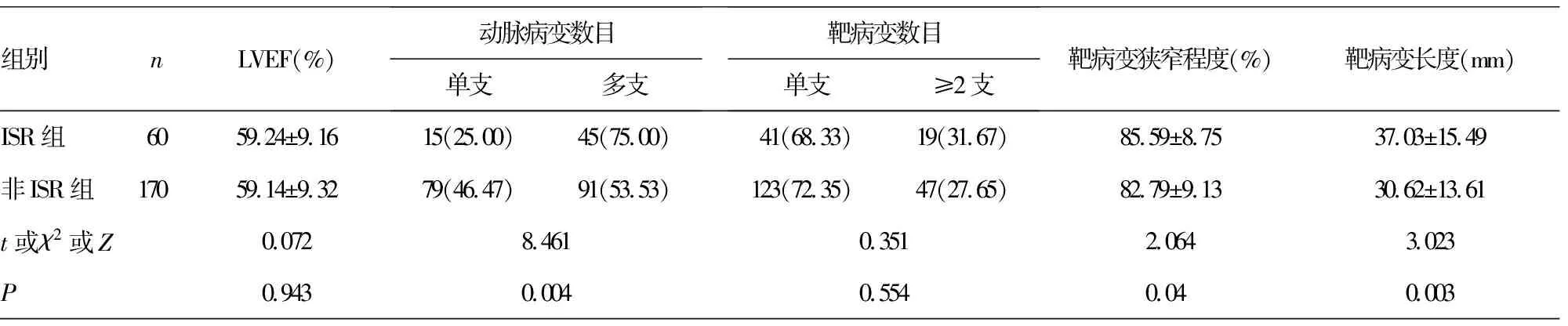
组别nLVEF(%)动脉病变数目单支多支靶病变数目单支≥2支靶病变狭窄程度(%)靶病变长度(mm)ISR组6059.24±9.1615(25.00)45(75.00)41(68.33)19(31.67)85.59±8.7537.03±15.49非ISR组17059.14±9.3279(46.47)91(53.53)123(72.35)47(27.65)82.79±9.1330.62±13.61t或χ2或Z0.0728.4610.3512.0643.023P0.9430.0040.5540.040.003

组别n实验室指标FBG(mmol/L)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)SCr(μmol/L)SUA(μmol/L)ISR组605.90±2.324.56±1.671.52±0.372.45±1.000.97±0.1998.86±28.10344.49(241.90~525.18)非ISR组1706.09±2.394.31±1.771.56±0.472.52±1.101.07±0.27110.46±32.19288.40(195.74~430.73)t或χ2或Z0.5330.9540.5970.4342.6451.638-2.253P0.5940.3410.5510.6650.0090.1030.024
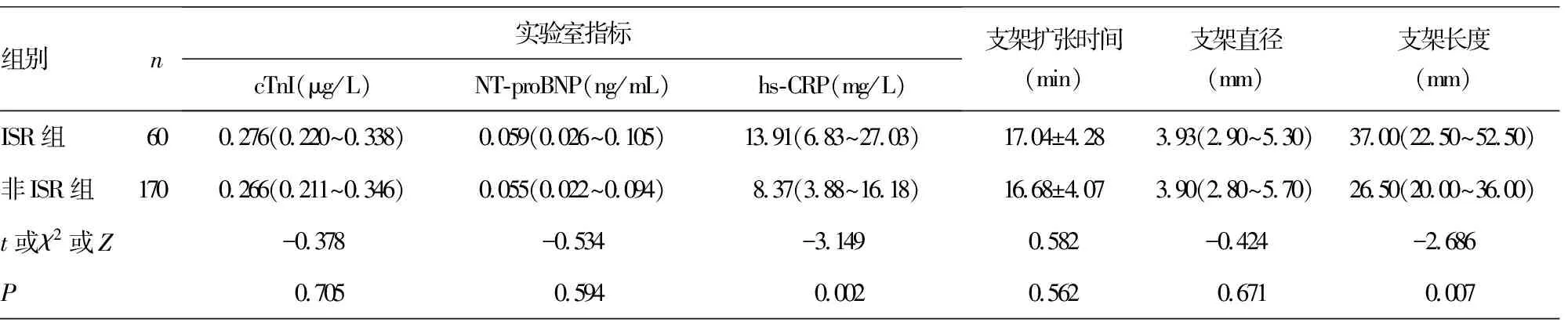
组别n实验室指标cTnI(μg/L)NT-proBNP(ng/mL)hs-CRP(mg/L)支架扩张时间(min)支架直径(mm)支架长度(mm)ISR组600.276(0.220~0.338)0.059(0.026~0.105)13.91(6.83~27.03)17.04±4.283.93(2.90~5.30)37.00(22.50~52.50)非ISR组1700.266(0.211~0.346)0.055(0.022~0.094)8.37(3.88~16.18)16.68±4.073.90(2.80~5.70)26.50(20.00~36.00)t或χ2或Z-0.378-0.534-3.1490.582-0.424-2.686P0.7050.5940.0020.5620.6710.007

组别n术后用药ACEIs/ARB钙通道阻滞剂β-受体阻滞剂他汀类药物阿司匹林氯吡格雷硝酸盐类药物ISR组6049(81.67)21(35.00)48(80.00)58(96.67)60(100.00)60(100.00)55(91.67)非ISR组170126(74.12)50(29.41)152(89.41)162(95.29)170(100.00)170(100.00)156(91.76)t或χ2或Z1.3890.6493.4640.201--0.001P0.2390.4210.0630.654--0.981
2.22组患者血清S100A12、IL-17A水平比较 经ELISA检测,ISR组患者的血清S100A12、IL-17A水平均明显高于非ISR组患者,差异均有统计学意义(P<0.001)。见表2。
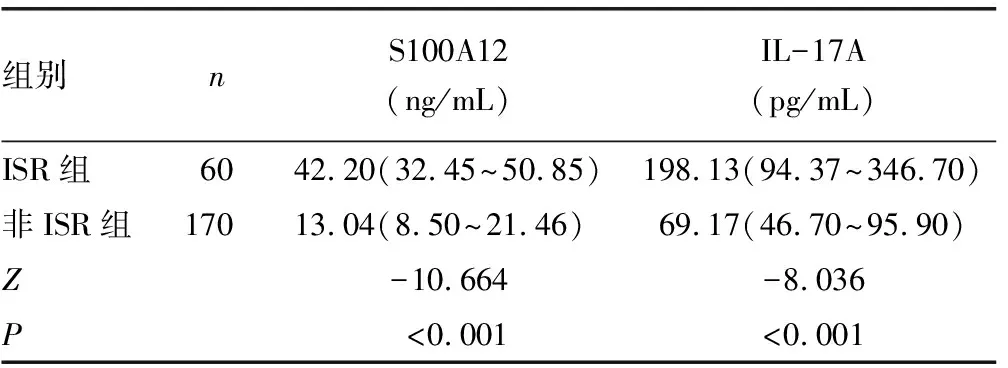
表2 2组患者血清S100A12、IL-17A水平分析[ M(P25~P75)]
2.3冠心病患者血清IL-17A、S100A12水平与hs-CRP的相关性 经Spearman相关分析,冠心病患者血清IL-17A、S100A12水平均与hs-CRP呈正相关(rs=0.264、0.151,P<0.05)。
2.4多因素Logistic回归分析影响冠心病患者DES植入后发生ISR的临床因素 经多因素Logistic回归分析,HDL-C水平、SUA水平、靶病变长度及血清S100A12、IL-17A水平均是冠心病患者DES植入后发生ISR的独立影响因素(P<0.05)。见表3。
2.5血清S100A12、IL-17A水平对冠心病患者DES植入后发生ISR的预测价值 经ROC曲线分析,血清S100A12、IL-17A联合预测冠心病患者DES植入后发生ISR的曲线下面积(AUC)为0.981(95%CI:0.967~0.995),灵敏度和特异度分别为88.3%和95.9%,约登指数为0.842,优于S100A12、IL-17A单项检测。见表4、图1。
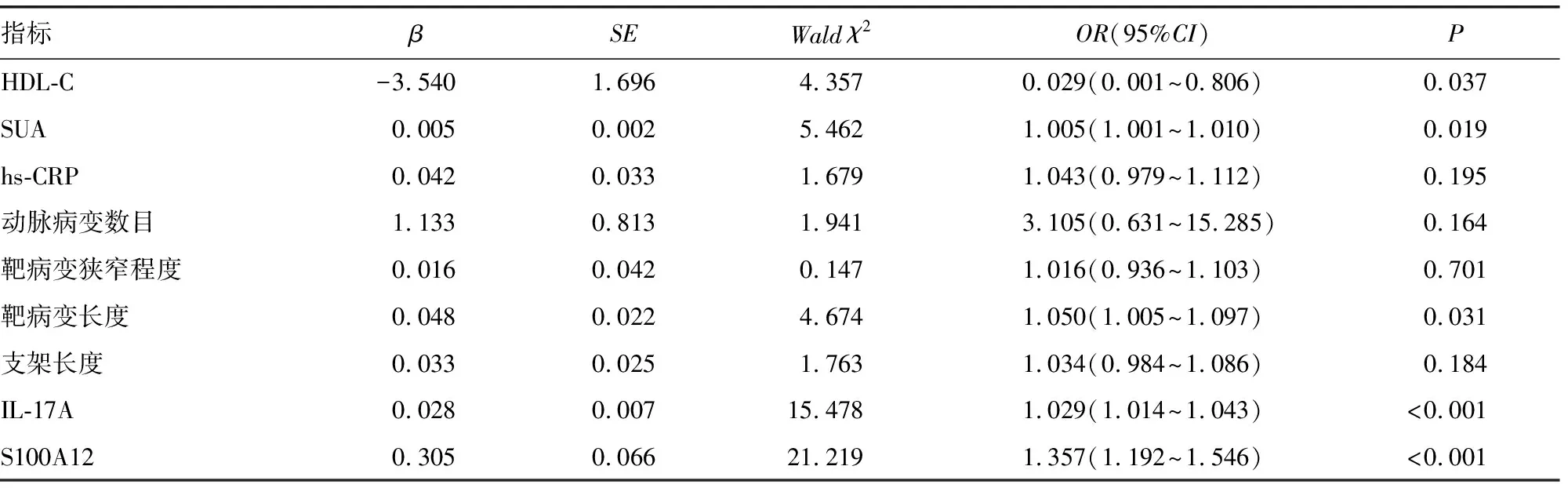
表3 多因素分析影响冠心病患者DES植入后发生ISR的临床因素

表4 血清S100A12、IL-17A水平对冠心病患者DES植入后发生ISR的预测价值分析

图1 血清S100A12、IL-17A水平预测冠心病患者DES植入后发生ISR的ROC曲线
3 讨 论
DES植入人体后,药物可逐渐从涂层中洗脱出来,以尽量减少术后血栓和ISR的发生。目前众多研究通过分析发现,诱发因素(如吸烟)、冠状动脉造影、合并症(如高血压、糖尿病)等临床指标可预测ISR发生风险及患者预后情况,但灵敏度欠佳[6-7]。本研究证实ISR组患者的血清S100A12、IL-17A水平均明显高于非ISR组患者,因此推断S100A12、IL-17A可能与ISR的发生机制有关。
冠心病潜在的病理生理机制为动脉粥样硬化,其特征为血管内膜病变、轻度炎症、脂质积聚以及斑块形成,斑块破裂或侵蚀会叠加动脉粥样硬化血栓形成及血管阻塞,引发包括心肌梗死、心肌缺血等在内的心血管事件[8]。虽然DES植入后早期ISR发生率较球囊血管形成术、裸金属支架显著降低,但随着手术时间的推移,ISR的发生风险也逐渐升高。发生ISR的主要原因包括支架膨胀不良、贴壁不良、残余狭窄等,早期ISR的发生主要是由于血管弹性回缩及斑块的迁移,而晚期ISR的发生通常是因血栓的形成、血管重塑及内膜增生等[9-10]。PCI及支架植入过程中对血管的损伤可引起新生内膜组织增生,去除动脉粥样硬化斑块也会导致血小板活化,释放各种细胞因子、生长因子及趋化因子,从而触发血管平滑肌细胞增殖、白细胞募集、凝血级联激活。此外动脉粥样硬化也是促使ISR发生的重要因素,局部炎症可促进动脉粥样硬化的发展[11]。
据报道,hs-CRP在炎性反应及动脉粥样硬化斑块的发生、发展中具有重要意义[12]。在本研究中ISR组患者的hs-CRP水平显著高于非ISR组,而且冠心病患者血清IL-17A、S100A12水平均与hs-CRP呈正相关,说明IL-17A、S100A12可能参与炎性反应及动脉粥样硬化的进展。S100A12为S100蛋白家族的成员,S100蛋白家族具有参与炎性反应、聚集巨噬细胞、调节氧化应激等多种生理功能。其中S100A12主要是由参与炎性反应的免疫细胞(如中性粒细胞、单核细胞)合成和释放,并且可激活炎症细胞引起趋化作用,加剧动脉粥样硬化过程中血管壁的慢性炎性反应[13]。众多研究表明,S100A12的促炎作用是通过MOK蛋白激酶和Toll样受体(TLR)4相互作用介导的,在急性及慢性炎性反应中均起重要作用,并与动脉粥样硬化相关[14]。WANG等[15]在急性冠脉综合征患者的血浆中观察到可溶性晚期糖基化终末产物及S100A12水平较稳定型心绞痛、非阻塞性冠状动脉粥样硬化患者及健康者升高,并认为二者联合检测可作为严重冠心病的预测指标。LIANG等[16]证实血清S100A12水平升高对于预测冠心病患者冠状动脉DES植入后发生ISR有一定的临床效能。这与本研究结果基本相符。此外,IL-17A由Th17细胞产生,是冠心病患者体内常见的炎症细胞因子,其被证明可以控制动脉粥样硬化病变中巨噬细胞的单核细胞聚集及细胞死亡、迁移、募集和活化,最终导致动脉粥样硬化、动脉粥样硬化斑块破裂和血栓形成[17]。有研究团队发现IL-17A在PCI植入支架后发生ISR的患者中水平更高,但并未证实IL-17A预测ISR发生风险的有效性[18]。而本研究结果显示血清IL-17A水平也是冠心病患者DES植入后发生ISR的独立影响因素,血清IL-17A水平升高则预示着ISR发生风险增加,并且血清S100A12、IL-17A联合预测冠心病患者DES植入后发生ISR有更佳的预测效能。
综上所述,术前血清S100A12、IL-17A在预测冠心病患者DES植入后发生再狭窄风险方面具有可接受的应用价值,然而,鉴于纳入的样本量偏少,后期应进一步研究以确定该结论的可靠性。此外,S100A12、IL-17A与机体炎症状态也有一定关系,这些结果进一步支持了动脉损伤、炎症和血管内膜增生之间的关系,因此亦提示减少动脉损伤和抑制炎性反应可能是抵抗血管内膜增生的有效方法。
