血清中IL-6联合组织相关标志物对AAD的临床诊断价值*
2022-06-15陈珍妮倪二茹谢华斌李文正贾克刚
陈珍妮,倪二茹,王 钊,谢华斌,李文正,贾克刚,5△
1.中南大学湘雅二医院检验科,湖南长沙 410011;2.厦门大学附属心血管病医院检验科,福建厦门 361000;3.泰达国际心血管病医院心脏监护科,天津 300457;4.泰达国际心血管病医院检验科,天津 300457;5.天津医科大学心血管病临床学院,天津 300457
急性主动脉夹层(AAD)是一种危及生命的心血管疾病,及早诊治是提高患者存活率的关键,高达39%的AAD患者在尸检前仍未得到诊断[1-2]。研究证实血清中各种生物标志物的检测可用于AAD的诊断[3]。由于AAD的组织学特征为细胞外基质(ECM)重塑、平滑肌细胞减少、炎症发生及血栓形成,血清中的生物标志物主要分为以下两类:(1)主动脉壁损伤的相关成分,如基质金属蛋白酶-9(MMP-9)[4]、可溶性弹性蛋白片段(sELAF)[5]、腱糖蛋白C(TN-C)[6]等;(2)炎性反应及假性管腔内血栓形成的相关成分, 如白细胞介素-6(IL-6)[7]、D-二聚体(DD)[2]等。
血液生物标志物有望成为AAD常规筛查和监测的一种有效途径,但目前的临床指南并未对其使用作出具体的建议。研究证实,循环中的IL-6水平是诊断AAD以及评估患者预后的可靠生物标志物[7],而组织标志物TN-C作为在正常组织中少见的细胞外基质糖蛋白,与AAD的发生、发展密切相关[8],目前国内外关于其作为AAD的诊断生物标志物的临床证据不足,且鲜有将组织及炎症标志物联合早期诊断AAD的研究报道。本研究检测了组织特异性标志物(MMP-9、sELAF、TN-C)及炎症因子IL-6,分析各个指标之间的相关性,评估各指标对AAD的诊断作用,旨在从临床实验室的角度寻求并验证是否存在诊断AAD的特异性血液学指标。
1 资料与方法
1.1一般资料 连续选取2019年1月至2020年12月在泰达国际心血管病医院及厦门大学附属心血管病医院因胸痛主诉入院治疗的AAD患者61例为AAD组,急性冠脉综合征(ACS)患者59例为ACS组[包括36例急性心肌梗死患者(AMI组)、23例不稳定性心绞痛患者(UA组)]。纳入标准:(1)患者因胸痛主诉入院并于入院24 h内采血,行DD检测;(2)有完整的基本资料(包括性别、年龄、身高、体质量)和临床相关资料;(3)AAD参照2014年欧洲心脏病学会发布的《主动脉疾病诊断与治疗指南》[9]明确诊断;ACS(包括AMI、UA)参照《急性冠脉综合征急诊快速诊治指南(2019)》明确诊断[10]。排除标准:孕妇及哺乳期;年龄<20岁;合并肿瘤、血液系统疾病;有活动性感染及自身免疫性疾病。选择同期在泰达国际心血管病医院体检的56例体检健康者作为HC组。各组间性别、年龄相匹配。
各组基本资料见表1。AAD组与AMI、UA组患者有高血压病史、糖尿病史的比例差异有统计学意义(P<0.05);AAD组与HC组的体质量指数(BMI)、收缩压及有高血压病史、糖尿病史、吸烟和饮酒史的比例差异均有统计学意义(P<0.05)。
1.2方法 AAD及ACS组患者手术前24 h内或入院当天通过肘正中静脉采集静脉血5 mL,HC组采集空腹静脉血5 mL,抽取后离心(3 500 r/min,15 min),吸取上层血清至1.5 mL冻存管内,用于检测IL-6、TN-C、MMP-9、sELAF水平。冻存至-80 ℃冰箱内,避免反复冻融。实验当天将所有样品同时解冻。采用化学发光免疫夹心法(试剂盒购自深圳新产业生物医学工程有限公司)检测血清中IL-6水平,采用酶联免疫吸附试验检测血清中TN-C(试剂盒购自上海艾博抗贸易有限公司)、MMP-9(试剂盒购自上海爱必信生物科技有限公司)、sELAF(试剂盒购自武汉华美生物工程有限公司)的水平。收集DD、血常规、凝血常规、心肌损伤相关指标的数值。
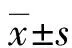

表1 各组基本资料比较
2 结 果
2.1各组实验室资料比较 AAD组与AMI组间白细胞计数(WBC)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)、国际化标准比值(INR)、C反应蛋白(CRP)、DD、血小板计数(PLT)、纤维蛋白原(FIB)、肌钙蛋白I(cTnI)、IL-6、MMP-9、sELAF水平差异均有统计学意义(P<0.05);AAD组与UA组间WBC、APTT、PT、TT、INR、肌酸激酶同工酶(CK-MB)、脑钠肽(BNP)、CRP、DD、PLT、FIB、cTnI、IL-6、MMP-9、TN-C、sELAF水平差异均有统计学意义(P<0.05);AAD组与HC组间WBC、红细胞分布宽度(RDW)、总胆固醇(TC)、PLT、IL-6、MMP-9、TN-C、sELAF水平差异均有统计学意义(P<0.05);各组间平均红细胞体积(MCV)、血小板分布宽度(PDW)、三酰甘油(TG)水平差异均无统计学意义(P>0.05)。见表2。

表2 各组实验室资料比较或M(IQR)]
2.2血清TN-C、IL-6、MMP-9、sELAF、DD各指标间的相关性 Spearman相关分析显示:血清MMP-9与sELAF、IL-6水平呈正相关(r=0.326、0.277,P<0.01);血清IL-6与sELAF、TN-C水平呈正相关(r=0.167、0.382,P<0.05);血清TN-C与sELAF水平呈正相关(r=0.406,P<0.001);血清TN-C与MMP-9水平无相关性(P>0.05)。
2.3ROC曲线分析
2.3.1分析血清IL-6、MMP-9、sELAF、TN-C水平对AAD的诊断效能 绘制ROC曲线,将AAD与AMI、UA、HC组分别比较,结果显示:IL-6鉴别诊断AAD与AMI、UA、HC的AUC分别为0.752(95%CI:0.653~0.852)、0.964(95%CI:0.929~0.998)、0.892(95%CI:0.826~0.957),均P<0.001,见图1;MMP-9鉴别诊断AAD与AMI、UA、HC的AUC分别为0.686(95%CI:0.560~0.792,P<0.01)、0.683(95%CI:0.566~0.800,P<0.05)、0.794(95%CI:0.709~0.879,P<0.001),见图2;sELAF鉴别诊断AAD与AMI、UA、HC的AUC分别为0.691 (95%CI:0.585~0.796,P<0.01)、0.661(95%CI:0.543~0.780,P<0.05)、0.793(95%CI:0.712~0.873,P<0.001),见图3;TN-C鉴别诊断AAD与AMI、UA、HC的AUC分别为0.529(95%CI:0.409~0.649,P>0.05)、0.760(95%CI:0.653~0.866,P<0.001)、0.787(95%CI:0.706~0.867,P<0.001),见图4。血清IL-6、MMP-9、sELAF、TN-C水平鉴别诊断AAD与AMI、UA、HC的效能见表3。
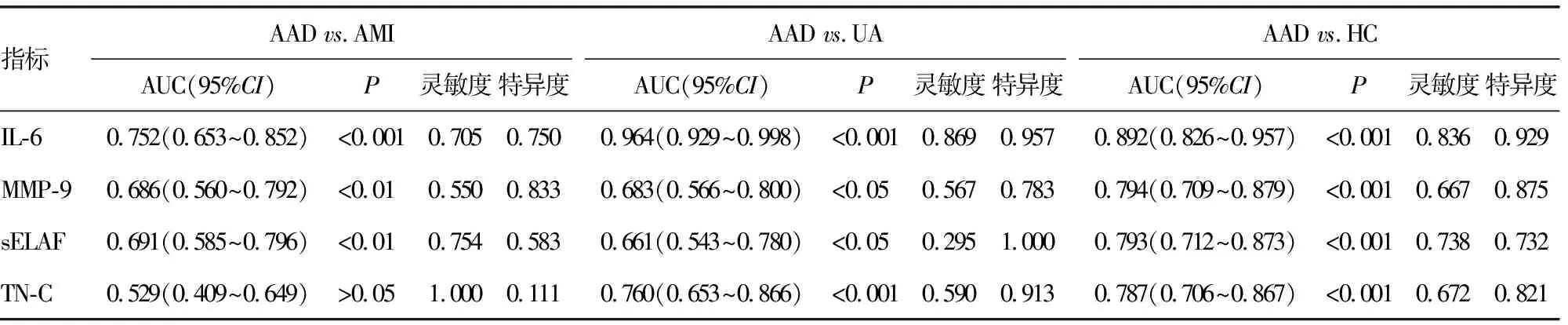
表3 血清IL-6、MMP-9、sELAF、TN-C鉴别诊断AAD与AMI、UA、HC的效能

图1 血清IL-6鉴别诊断AAD与AMI、UA、HC的ROC曲线

图2 血清MMP-9鉴别诊断AAD与AMI、UA、HC的ROC曲线
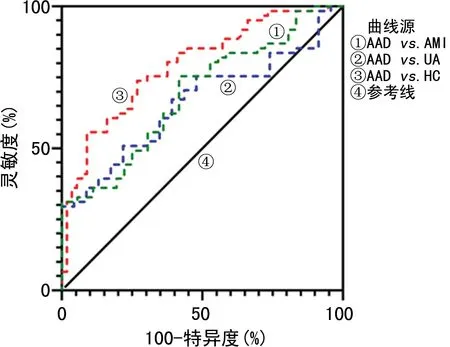
图3 血清sELAF鉴别诊断AAD与AMI、UA、HC的ROC曲线

图4 血清TN-C鉴别诊断AAD与AMI、UA、HC的ROC曲线
2.3.2比较血清DD、IL-6、MMP-9、sELAF对AAD和ACS的鉴别诊断效能 DD及IL-6鉴别诊断AAD和ACS的效能较高,AUC分别为0.895(95%CI:0.830~0.960)、0.835(95%CI:0.763~0.907),均P<0.001;血清 MMP-9、sELAF水平对鉴别诊断AAD和ACS有一定的价值,AUC分别为0.685(95%CI:0.588~0.782)、0.679(95%CI:0.584~0.775),均P<0.01。见表4和图5。

表4 血清DD、IL-6、MMP-9、sELAF对AAD和ACS的鉴别诊断效能
2.4各指标联合鉴别诊断AAD与UA的效能比较 最佳早期鉴别诊断AAD与UA的两两组合标志物为sELAF+IL-6(AUC为0.976,P<0.001),其诊断效能高于TN-C+MMP-9+sELAF(AUC为0.852,P<0.001)、TN-C+MMP-9+sELAF+IL-6(AUC为0.971,P<0.001),见表5。

图5 血清DD、IL-6、MMP-9、sELAF鉴别诊断AAD与ACS的ROC曲线

表5 各指标联合鉴别诊断AAD与UA的效能比较
3 讨 论
AAD是由主动脉内膜纵向或横向撕裂引发,血液迅速进入到动脉壁内继发血栓形成和主动脉破裂[11]。主动脉壁炎性反应参与动脉中膜的降解,致使主动脉管壁扩张、撕裂形成夹层,一旦主动脉夹层发生,主动脉中膜损伤或破坏旳平滑肌细胞蛋白成分如MMP-9、sELAF、TN-C就会释放入血,同时主动脉假腔内血栓形成或降解会引起血液中溶栓和纤溶标志物(如DD)的水平变化[11-12]。本研究结果显示,DD鉴别AAD与ACS的诊断效能最佳,常被用于AAD的排除诊断[2]。同时,本次结果显示AAD患者入院PLT显著降低,可能与血管壁撕裂后引发血栓形成,继而消耗过多血小板有关,既往研究认为PLT降低预示潜在的出血趋势和不良的临床结果[13]。
本研究发现IL-6诊断AAD的效能仅次于DD,且优于MMP-9和sELAF。IL-6通过介导血管外膜炎症,促进主动脉扩张和破裂,是诊断AAD及评估AAD患者的治疗结果和预后的可靠生物标志物[7,14]。MMP-9所介导的蛋白水解作用,可以促进中层弹性蛋白网络的碎裂,继而释放sELAF到循环血液中。已有研究证实AAD患者循环中sELAF水平明显高于健康人和AMI患者[5]。本研究结果显示血清IL-6与MMP-9、sELAF水平均相关,可能是由于在疾病发生过程中,受损的主动脉细胞释放大量炎症因子激活炎症细胞,而炎症细胞(如巨噬细胞)又分泌各种蛋白酶(如MMPs)降解ECM,包括纤维连接蛋白、胶原蛋白、弹性蛋白、蛋白多糖等,引发进一步的主动脉损伤[14-15]。基质细胞蛋白TN-C的表达受机体微环境中各种生长因子、细胞因子及机械应力的严格调节。与郭涛等[16]发现TN-C可用于早期鉴别诊断AAD与AMI患者的结论并不一致,本研究发现AAD与AMI患者血清TN-C水平均显著增高,但两者间无明显差异,可能是由于TN-C通过调节细胞行为参与机体损伤后的组织修复过程,尤其是炎性反应、纤维化和血管生成等过程,在多种急性心血管疾病中均发挥了重要作用。
PENG等[17]发现平滑肌肌球蛋白重链(smMHC)、sELAF、PC1或DD可作为AAD早期诊断的生物标志物,联合应用可得到更高的诊断价值。本研究将TN-C、MMP-9、sELAF、IL-6分别组合分析发现,将 sELAF 联合 IL-6进行鉴别诊断AAD与UA的AUC明显高于TN-C、MMP-9、sELAF、IL-6单项鉴别诊断的AUC,说明夹层破裂后的炎症指标联合组织损伤相关物质可以很好地辅助诊断AAD。
总而言之,血液生物标志物可用于辅助临床诊断AAD,尤其是炎症及血栓标志物。而组织特异性生物标志物(MMP-9、sELAF、TN-C)的潜在诊断价值不如炎症因子,可能是检测方法存在问题,随着未来检测手段的提高(如质谱、化学发光法等),标志物的灵敏度和特异度也可能会随之发生变化。理想的生物标志物应该同时具有较高的灵敏度和较高的特异度,但目前尚未发现符合临床要求的理想标志物,因此将现有标志物应用到临床实践中时,应考虑到它们各自的优缺点,必要时进行联合检测。本研究AAD的患者数量较少,且属于横断面研究,未检测AAD患者血清指标水平的动态变化,也未对患者进行随访以评估长期死亡率或预后。因此,未来需要进行大样本和长期的随访研究,以验证本研究结果。
