血清CMKLR-1、CTRP9水平与糖尿病视网膜病变的关系*
2022-06-15王丽晖郭亚楠丁文萃常爱玲李新胜钱红霞
王丽晖,张 颖 郭亚楠,丁文萃,常爱玲,魏 静,李新胜,钱红霞△
1.河北省沧州市中心医院内分泌糖尿病一科,河北沧州 061000;2.河北省唐山市利康医院内四科,河北唐山 063000
糖尿病视网膜病变(DR)是2型糖尿病(T2DM)患者常见的微血管并发症之一,其引起视网膜微血管损伤及新生血管过度增生,是导致成人视力低下和致盲的主要原因之一。早诊、早治是延缓DR发生、发展的关键,早期诊治可使超过一半患者的视力损伤及失明得到有效预防[1]。DR的发病机制尚未完全清楚,目前认为其是氧化应激、炎性反应及代谢产物异常堆积等多因素共同作用所致[2]。趋化因子样受体1(CMKLR-1)隶属于Chemerin 配体,其参与机体炎性反应、脂质代谢及免疫应答等多种过程,还可通过Chemerin诱导引发胰岛素抵抗,其可能与DR的发生、进展有关[3]。C1q肿瘤坏死因子相关蛋白9(CTRP9)是一种与脂联素高度同源的脂肪因子,具有抗炎、抗氧化、胰岛素增敏等作用。有动物实验证实CTRP9可抑制T2DM模型鼠视网膜中白细胞介素、肿瘤坏死因子及核因子等多种炎症因子的表达,进而防止视网膜的破坏[4]。鉴于此,本研究通过分析CMKLR-1、CTRP9水平与DR的关系,以期为DR的早期防治提供帮助。
1 资料与方法
1.1一般资料 选取2020年1月至2021年1月河北省沧州市中心医院收治的T2DM患者216例作为研究对象,根据眼底检查结果,按是否并发DR分为DR组123例和非DR组(NDR组)93例。纳入标准:(1)年龄≥18岁;(2)T2DM的诊断符合文献[5]中的相关标准;(3)接受眼底检查;(4)临床资料完整。排除标准:(1)患1型糖尿病;(2)有严重的心脑血管疾病;(3)有严重的肝、肾功能损害;(4)有恶性肿瘤;(5)患急性炎性疾病及结缔组织病;(6)患影响眼部循环的其他眼部疾病;(7)既往有玻璃体注射治疗史。入组患者均签署知情同意书,本研究已获得河北省沧州市中心医院伦理委员会的审批同意(PYJ2019-27)。
1.2方法
1.2.1一般资料收集 查阅病例系统,收集入组患者的基本临床资料,包括年龄、体质量指数(BMI)、性别、是否合并高血压、T2DM病程。
1.2.2生化指标检测 采集所有纳入患者的空腹外周静脉血10 mL,以3 500 r/min离心10 min(离心半径12.5 cm),置于-80 ℃冷藏器中备用。(1)严格按照试剂盒说明操作,采用双抗体夹心酶联免疫吸附试验检测血清中CMKLR-1、CTRP9、C-反应蛋白(CRP)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、核因子-κB(NF-κB)水平,检测试剂盒均购于上海江莱生物科技有限公司。(2)使用日本日立008AS全自动化生化分析仪检测高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TC)、三酰甘油(TG)、空腹血糖(FPG);使用糖化血红蛋白分析仪(美国伯乐公司)检测血清中糖化血红蛋白(HbA1c)水平。
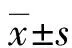
2 结 果
2.1两组患者CMKLR-1、CTRP9及其他临床资料的比较 DR组患者血清CMKLR-1、LDL、CRP、IL-6、TNF-α、NF-κB水平及T2DM病程均明显高于NDR组(P<0.05)。,而血清CTRP9水平明显低于NDR组(P<0.05)。见表1。
2.2DR患者CMKLR-1、CTRP9与其他指标的相关性分析 相关性分析显示DR患者CTRP9与IL-6、TNF-α、NF-κB均呈负相关(r=-0.689、-0.701、-0.691,P<0.05),CMKLR-1与TNF-α、NF-κB均呈正相关(r=0.625、0.594,P<0.05)。见表2。

表1 两组患者CMKLR-1、CTRP9及其他临床资料的比较
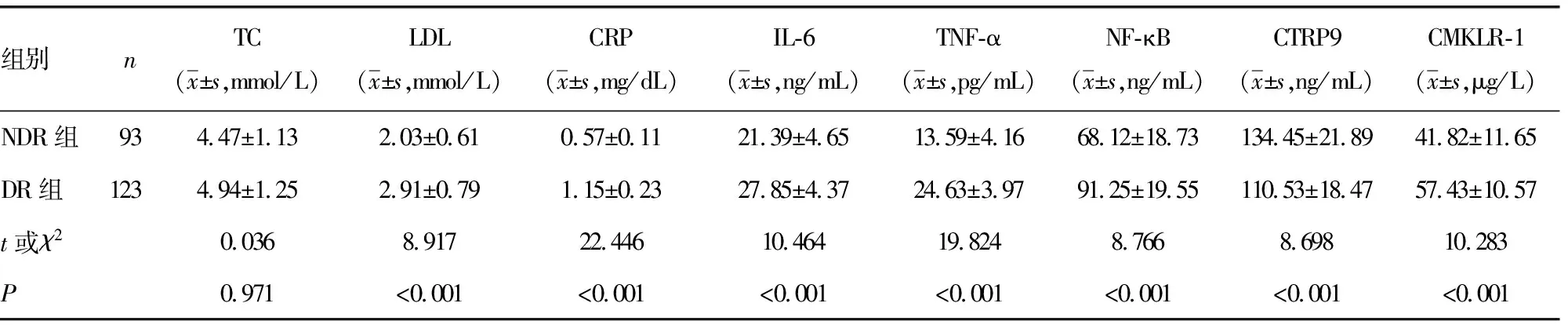
续表1 两组患者CMKLR-1、CTRP9及其他指标的比较

表2 DR患者CMKLR-1、CTRP9与其他指标的相关性分析
2.3T2DM患者并发DR的影响因素分析 以T2DM患者是否并发DR作为因变量Y(是=1,否=0),以CMKLR-1(实测值)、CTRP9(实测值)、T2DM病程(实测值)、TNF-α(实测值)、IL-6(实测值)、NF-κB(实测值)、LDL(实测值)、CRP(实测值)、合并高血压(是=1,否=0)为自变量X,进行多因素Logistic回归分析,结果显示CMKLR-1(OR=2.146,P<0.05)、TNF-α(OR=3.049,P<0.05)、NF-κB(OR=1.831,P<0.05)水平升高是T2DM患者并发DR的危险因素,CTRP9水平升高是T2DM患者并发DR的保护因素(OR=0.587,P<0.05),详见表3。

表3 T2DM患者并发DR的影响因素分析
3 讨 论
近年来,糖尿病发病率逐渐升高,其长期存在的高血糖状态导致微循环障碍及大量微血管形成,导致视网膜长期处于缺氧、慢性炎症刺激状态,最终引发DR[6]。随着DR相关研究的深入,有学者证实糖代谢及脂质代谢紊乱所致的机体固有免疫激活,进而引发的慢性炎性反应在T2DM微血管并发症的发生、发展中发挥重要作用[7]。本研究亦观察到DR组血清CRP、IL-6、TNF-α、NF-κB水平较NDR组明显升高,且多因素Logistic回归分析显示TNF-α、NF-κB水平升高均是T2DM患者并发DR的危险因素。TNF-α、NF-κB可通过趋化中性粒细胞及单核细胞聚集,刺激上皮细胞向视网膜迁移进而导致血管新生,可见炎性反应在DR的发生中发挥重要作用[8]。CMKLR-1、CTRP9是机体内炎性反应、脂质代谢及免疫应答重要的调控因子,可能参与了DR的发生、发展[3-4]。
CMKLR-1是由人类CMKLR-1基因编码的一种蛋白,属于G蛋白耦联受体家族成员之一,是趋化脂肪因子Chemerin的天然配体。Chemerin是一种近年来新发现的促炎趋化因子,其在机体炎性反应、胰岛素抵抗及肥胖的发生、发展中发挥关键作用[9]。有研究显示DR患者血清Chemerin明显升高,且沉默CMKLR-1基因可抑制小鼠血管平滑肌的增生[10]。亦有研究显示饮食控制及有氧运动可通过降低Chemerin/CMKLR-1的表达进而改善糖尿病大鼠糖脂代谢异常[11]。本研究发现DR组血清CMKLR-1水平明显高于NDR组,且与炎症指标TNF-α、NF-κB呈正相关,进一步分析显示CMKLR-1水平升高是T2DM患者并发DR的危险因素,说明CMKLR-1在T2DM患者并发DR的患者血清中升高,与炎症介质的释放、病程进展密切相关。究其原因,可能是CMKLR-1属于Chemerin的内源性配体,二者结合后可促进胞内钙离子的释放,通过ERK1及核转录因子等通路,作用于中性粒细胞、巨噬细胞及树突细胞等炎性细胞,释放白细胞介素、肿瘤坏死因子等炎症因子,进而促进视网膜微血管增生,导致视网膜受损[12-13]。
CTRP9是一种与脂联素高度同源的脂肪因子,其可通过激活腺苷酸活化蛋白激酶(AMPK)、促分裂素原活化蛋白激酶(MAPK)等信号通路促进脂质代谢、改善胰岛素敏感性、降低血糖、减轻炎性反应及保护血管[14]。有细胞实验发现CTRP9可能降低炎症因子的表达,具体表现为浓度依赖性地降低氧化型LDL介导的肿瘤坏死因子和单核细胞趋化蛋白的表达[15]。JUNG等[16]研究显示CTRP9可通过脂联素受体1/AMPK/核因子抑制巨噬细胞炎性反应,并抑制血管内皮细胞中黏附分子及趋化因子的表达,进而减轻血管炎症。还有研究证实CTRP9具有改善机体胰岛素抵抗的脂肪细胞胰岛素样效应,进而间接地调节机体炎性反应[4]。本研究结果证实DR患者CTRP9与IL-6、TNF-α、NF-κB均呈负相关,且CTRP9水平升高是T2DM患者并发DR的保护因素,这提示血清CTRP9水平降低可能增加了DR的发病风险。目前,CTRP9在糖尿病患者中的作用机制仍处于探索阶段,本研究推测CTRP9通过脂联素受体1/AMPK/核因子、改善机体胰岛素抵抗等途径降低机体IL-6、TNF-α、NF-κB的表达,进而使视网膜病理性新生血管减少,改善视网膜内细胞缺氧性退行性变,进而延缓DR病程、降低DR的发病率,亦由于CTRP9发挥抗炎作用而出现消耗性下降[17-18]。
综上所述,血清CMKLR-1水平升高、CTRP9水平降低是T2DM患者并发DR的危险因素,联合检测血清CMKLR-1、CTRP9水平可能有助于临床早期发现并延缓DR的发生、进展。本研究因研究时间及收集的患者数量有限,研究结果可能存在偏倚,后续可增加样本量进一步证实本研究结论,同时CMKLR-1、CTRP9具体如何参与DR的机制需要进一步研究。
