微小RNA-22对髓母细胞瘤细胞恶性生物学行为的影响及其机制▲
2022-06-15潘思安黄永凯欧阳倩朱潇鹏
潘思安 黄永凯 欧阳倩 朱潇鹏
(湖南省株洲市中心医院1 康复治疗科,2 神经外科,株洲市 412000,电子邮箱:rpfdkm@163.com)
髓母细胞瘤属后颅窝恶性胶质瘤,占儿童脑肿瘤的8%~10%,是儿童常见的恶性神经系统肿瘤之一,患儿常有颅压增高、头痛、嗜睡、厌食、恶心、呕吐等表现,肿瘤压迫小脑时可出现共济失调现象[1-2]。目前,临床上常采用手术、颅脊髓照射和化疗等方法治疗髓母细胞瘤,虽然这些方法可显著提高患者生存率,延长生存期,但仍有约三分之一的患者在确诊后5年内死亡,而且现有疗法的长期副作用明显,可引起患者神经认知和听力受损、内分泌功能障碍、继发恶性肿瘤的发生率增加等情况[3-4]。因此,寻找新的治疗方法治疗髓母细胞瘤是临床亟待解决的关键问题。微小RNA是指长度为19~25个核苷酸的非编码单链小RNA,主要通过与目的基因的3′非翻译区结合从而调控mRNA翻译,可作为候选生物标志物用于疾病的诊断和治疗[5-6]。多项研究表明,微小RNA-22(microRNA-22,miR-22)在乳腺癌、宫颈癌、结肠癌、胃癌等恶性肿瘤中的表达下调,具有肿瘤抑制作用[7-8]。但关于miR-22在髓母细胞瘤发生和发展中作用的研究报告较少,其调节作用机制尚未清楚。故本研究通过观察miR-22对髓母细胞瘤细胞恶性生物学行为的影响,并基于磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路分析其潜在的作用机制,为髓母细胞瘤的治疗寻找新的靶标。
1 材料和方法
1.1 细胞来源与培养 人髓母细胞瘤细胞系UW402、UW473、DAOY和ONS-76细胞,以及正常人神经细胞RGC-5细胞,均购自美国ATCC公司。将细胞培养于含有10%胎牛血清的杜氏改良伊戈尔培养基(Dulbecco′s modified Eagle medium,DMEM),培养条件为37℃、饱和温度、5% CO2。每2~3 d传代一次,取对数生长期的细胞用于后续实验。
1.2 实验动物 20只无特定病原体级6周龄雄性BALB/c裸鼠,体重18~20 g,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号码:SCXK(京)2017-0011]。饲养条件:室温(22±1)℃,湿度(50±10)%,每天定时换气,保持12 h:12 h光暗照明,自由进食、饮水。
1.3 试剂与仪器 DMEM培养基(货号:31600)、细胞计数检测(cell counting kit-8,CCK-8)试剂盒(货号:CA1210)、Transwell小室(货号:G4740)、基质胶(货号:M8370)、结晶紫染液(货号:C8470)、胎牛血清(货号:S9020)、青链霉素混合液(100×,货号:P1400)、胰蛋白酶-乙二胺四乙酸消化液(货号:T1300)、TRIzol裂解液(货号:R1100)、膜联蛋白Ⅴ(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒(货号:CA1020)、RIPA裂解液(货号:R0010)、二喹啉甲酸蛋白浓度测定试剂盒(货号:PC0020)均购自北京索莱宝科技有限公司;吉姆萨染色试剂盒(货号:E607314)购自上海生工生物工程股份有限公司;LipofectamineTM2000转染试剂盒(货号:11668027)、RevertAidTMfirst Strand cDNA Synthesis Kit试剂盒(货号:K1622)购自美国ThermoFisher公司;实时荧光PCR引物、miRNA NC/mimics由广州锐博生物科技有限公司合成;PI3K、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、Akt、磷酸化Akt(phosphorylated Akt,p-Akt)兔单抗购自美国CST公司(批号:4249、17336、4691、4060),兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多抗及辣根过氧化物酶标记的羊抗兔二抗购自英国Abcam公司(批号:ab181602、ab205718);740Y-P(PI3K激动剂)购自大连美仑生物技术有限公司。IX53型显微镜购自日本奥林巴斯;TGL16MB型高速冷冻离心机购自长沙湘智离心机仪器有限公司;ELx800型酶标仪购自美国Bio-Tek公司;CytoFLEX S流式细胞仪购自美国Beckman Coulter公司;DYCZ-24KS型双板垂直电泳仪购自北京六一仪器厂;G:BOX型多功能凝胶成像系统购自Syngene公司。
1.4 实验方法
1.4.1 实时定量PCR法检测细胞miR-22表达水平:取对数生长期的W402、UW473、DAOY、ONS-76和RGC-5细胞,胰酶消化、2 000 r/min离心15 min后收集细胞沉淀,加入适量TRIzol裂解液提取细胞总RNA,检测RNA浓度和纯度后,按照反转录试剂盒说明书的步骤将RNA反转录为cDNA。PCR反应体系包括dNTPs 0.5 μL、5×Buffer 5 μL、Taq酶0.3 μL、MgCl21.5 μL、cDNA模板2 μL、上下游引物各1 μL,加去离子水至总体积为25 μL。反应参数为95℃ 5 min,95℃ 30 s、62℃ 30 s、72℃ 30 s,重复40个循环,最后72℃ 10 min,4℃ 5 min终止反应。以U6为内参基因,采用2-ΔΔCt的方法计算目的基因相对表达水平,实验重复3次。引物序列见表1。

表1 基因的引物序列
1.4.2 细胞转染及分组:收集对数生长期的DAOY细胞,以5×105个/孔接种到6孔板中,加入DMEM培养基。将DAOY细胞分为对照组、miR-22 NC组、miR-22 mimics组、miR-22 mimics+740Y-P组进行实验。当细胞生长融合至70%~80%时,参照LipofectamineTM2000试剂说明书给予miR-22 NC组、miR-22 mimics组、miR-22 mimics+740Y-P组细胞分别转染miR-22 NC、miR-22 mimics、miR-22 mimics,对照组仅加入LipofectamineTM2000试剂,miR-22 mimics+740Y-P组细胞转染miR-22 mimics 24 h后添加10 μmol/L的740Y-P 200 μL。各组转染6 h后更换为正常培养基,继续培养48 h后通过检测对照组、miR-22 NC组、miR-22 mimics组细胞的miR-22表达情况评估转染效率,然后进行后续实验。
1.4.3 CCK-8法检测细胞增殖能力:转染48 h后,收集各组细胞,消化、800 r/min离心5 min、重悬后计数,以3×103个/孔的浓度接种于96孔板中,置于5% CO2培养箱中37℃培养0 h、24 h、48 h、72 h、96 h、120 h后加入CCK-8试剂,继续放置于培养箱中孵育4 h,于酶标仪630 nm波长处读取光密度值。实验重复3次。
1.4.4 Transwell法检测细胞侵袭能力:转染48 h后,收集各组细胞,将细胞消化、800 r/min离心5 min、重悬后,采用无血清的DMEM培养基稀释细胞,按照2×104个/孔的浓度接种于已铺有基质胶的上室,每孔200 μL,下室加入600 μL的DMEM完全培养基,置5% CO2培养箱中37℃继续培养48 h后,取出上室,用甲醇固定20 min,棉签擦掉上室残余细胞,1%的结晶紫染色15 min,磷酸缓冲盐溶液冲洗2遍,置于显微镜下观察,选取4个高倍视野(400×)进行细胞计数,取平均值。实验重复3次。
1.4.5 流式细胞术检测细胞凋亡情况:转染48 h后,收集各组细胞,胰酶消化使用磷酸缓冲盐溶液洗涤3次,1 mL 结合缓冲液重悬,调整细胞密度为1×106个/mL,每管加入100 μL细胞,再加入5 μL Annexin V-FITC,室温避光孵育10 min,加入5 μL PI,室温避光孵育5 min,加入磷酸缓冲盐溶液至500 μL,混匀后使用流式细胞仪检测细胞凋亡率。实验重复3次。
1.4.6 蛋白免疫印迹法检测细胞PI3K/Akt信号通路蛋白磷酸化水平:转染48 h后,收集各组细胞,加入RIPA裂解液提取细胞蛋白,并采用二喹啉甲酸蛋白浓度测定试剂盒进行蛋白定量,测定蛋白浓度。每个样本取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,浓缩胶80 V、分离胶120 V电泳2 h,60 V转膜2 h将蛋白转移至聚偏二氟乙烯膜后,将膜置于5%脱脂奶粉中室温环境下封闭2 h,放入相应一抗(稀释比例均为1∶2 000)于4℃孵育过夜,第2天用TBST清洗3次,10 min/次,加入二抗(稀释比例为1∶1 000)于37℃孵育2 h,TBST清洗3次,滴加发光液,放入凝胶成像系统显影。ImageJ软件分析各个蛋白对应的灰度值,以GAPDH为内参照,计算蛋白的相对表达量。实验重复3次。
1.4.7 裸鼠皮下移植瘤实验:小鼠适应性饲养3 d后,按随机数字表法分为对照组、miR-22 NC组、miR-22 mimics 组、miR-22 mimics+ 740Y-P组,每组5只。将1.4.2中转染48 h后的对照组、miR-22 NC组、miR-22 mimics 组、miR-22 mimics+740Y-P组细胞(100 μL,1×107个/mL)注射至相应组别小鼠的右前肢皮下。待肿瘤组织生长至约100 mm3时,使用游标卡尺测量肿瘤体积,瘤体积(mm3)=0.5×长径(mm)×短径2(mm2),每周测量1次,取第4周(第28天)时的测量结果进行分析。
1.5 统计学分析 应用SPSS 25.0 软件进行统计分析,GraphPad Prism 8.0作图。计量资料以(x±s)表示,多样本比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 5种细胞中miR-22的表达水平 与正常人神经细胞RGC-5细胞比较,人髓母细胞瘤细胞系UW402、UW473、DAOY和ONS-76中miR-22细胞的相对表达水平均降低(均P<0.05),其中DAOY细胞miR-22的相对表达水平最低(均P<0.05),见表2。选择miR-22相对表达水平最低的DAOY细胞为研究对象进行后续实验。

表2 5种细胞的miR-22相对表达水平比较(x±s)
2.2 转染效率的评估结果 与对照组比较,转染miR-22 NC未改变DAOY细胞中miR-22的表达水平(P>0.05),转染miR-22 mimics后,DAOY细胞中miR-22的表达水平升高(P<0.01),证明转染成功。见表3。

表3 3组细胞的miR-22相对表达水平比较(x±s)
2.3 miR-22对DAOY细胞增殖能力的影响 转染48 h后,继续培养24~120 h,miR-22 NC组DAOY细胞的增殖能力与对照组差异无统计学意义(均P>0.05),而miR-22 mimics组DAOY细胞增殖能力均低于对照组和miR-22 NC组(均P<0.05),miR-22 mimics+740Y-P组DAOY细胞的增殖能力均高于miR-22 mimics组(均P<0.05)。见表4。

表4 4组细胞增殖能力的比较(x±s,吸光度值)
2.4 miR-22对DAOY细胞侵袭能力和凋亡情况的影响 与对照组比较,miR-22 NC组穿膜细胞数量和凋亡率差异无统计学意义(P>0.05);与对照组和miR-22 NC组比较,miR-22 mimics组的穿膜细胞数量减少,且凋亡率增加(P<0.05);与miR-22 mimics组比较,miR-22 mimics+740Y-P组的穿膜细胞数量增加,且凋亡率降低(P<0.05)。见表5和图1、图2。
表5 4组细胞侵袭能力和凋亡率的比较(x±s)
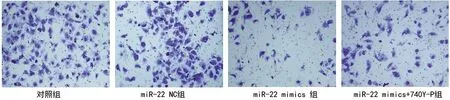
图1 4组DAOY细胞的侵袭能力(×400)

图2 4组DAOY细胞凋亡情况
2.5 miR-22对DAOY细胞PI3K/Akt信号通路蛋白磷酸化水平的影响 与对照组比较,miR-22 NC组DAOY细胞PI3K和Akt磷酸化水平差异无统计学意义(均P>0.05);与对照组和miR-22 NC组比较,miR-22 mimics 组PI3K和Akt磷酸化水平降低(均P<0.05);与miR-22 mimics组比较,miR-22 mimics+740Y-P组细胞PI3K和Akt磷酸化水平升高(均P<0.05)。见表6和图3。

表6 4组细胞DAOY细胞PI3K/Akt信号通路蛋白磷酸化水平的比较(x±s)
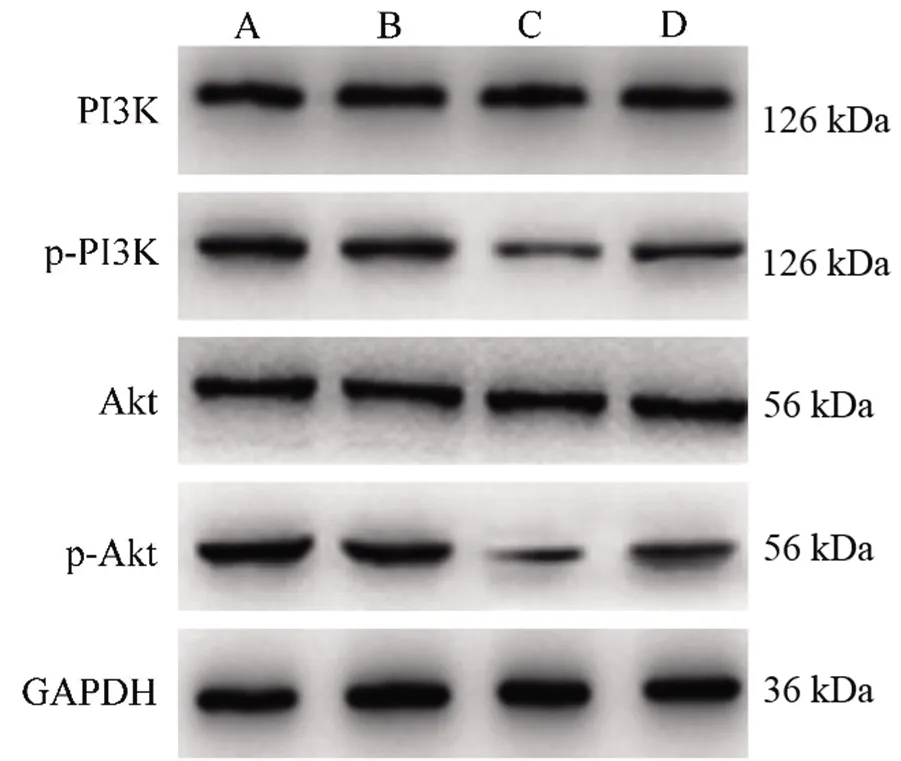
图3 miR-22对DAOY细胞PI3K/Akt信号通路蛋白的表达及磷酸化水平的影响
2.6 miR-22对DAOY细胞皮下移植瘤的影响 与对照组比较,miR-22 NC组裸鼠皮下移植瘤体积差异无统计学意义(P>0.05);与对照组和miR-22 NC组比较,miR-22 mimics组裸鼠皮下移植瘤体积减小(均P<0.05);与miR-22 mimics组比较,miR-22 mimics+740Y-P组裸鼠皮下移植瘤体积增大(P<0.05)。见表7和图4。

表7 4组裸鼠皮下移植瘤体积的比较(x±s,mm3)
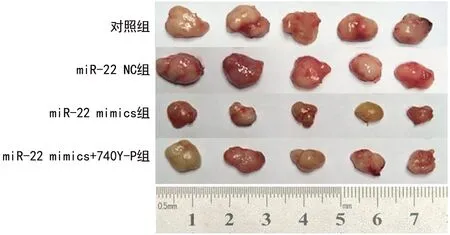
图4 4组裸鼠皮下移植瘤大小
3 讨 论
髓母细胞瘤是最常见的儿童恶性脑肿瘤,其5年总生存率低至40%,尽管髓母细胞瘤的早期检查和治疗方法已有很大改进,但该病仍是导致儿童死亡的主要原因之一,且其转移率和复发率均较高[9-10]。因此,寻找新的治疗靶标对于髓母细胞瘤的临床治疗具有重要意义。
人类基因组中所包含的具有编码蛋白质功能的基因约20 000个,仅占整个基因组的1.5%左右,其余的基因被称为非编码RNA[11]。非编码RNA最初被认为是基因组的转录“噪音”,随着研究的不断深入,学者们逐渐发现无论是长链或是短链非编码RNA,均对多种人类疾病具有调控作用[12]。研究证明,成熟的微小RNA可以通过3′-非翻译区、5′-非翻译区甚至mRNA编码序列的不精确互补来调节靶基因的表达[13]。最近的研究表明,miR-22是哺乳动物中高度保守的微小RNA,在肿瘤发生和进展过程中发挥双重作用,例如miR-22在白血病和前列腺癌中具有致癌作用,而在肺癌和结肠癌中发挥抑癌作用[14-15]。然而,目前miR-22在髓母细胞瘤中的作用尚未清楚。在本研究中,我们发现,与正常人神经细胞相比,髓母细胞瘤细胞系UW402、UW473、DAOY和ONS-76细胞中miR-22均呈低表达状态,提示miR-22的低表达可能与髓母细胞瘤的发生过程有关。为了进一步研究miR-22低表达与髓母细胞瘤的关系,本研究以miR-22表达水平最低的DAOY细胞为研究对象,给予转染miR-22后,采用CCK-8法、Transwell法和流式细胞仪分别检测细胞的增殖活性、侵袭能力及凋亡情况。结果表明,上调miR-22的表达可抑制DAOY细胞的增殖、侵袭等生物学行为,并促进细胞凋亡,提示在髓母细胞瘤中miR-22可能发挥抑癌作用。
PI3K信号通路对于机体正常发育,以及包括癌症在内的多种疾病的进展都具有重要作用,PI3K可通过与不同的结构域结合而被激活,Akt是PI3K下游关键蛋白之一,活化的p-PI3K可与Akt结合,促使Akt磷酸化活化,激活PI3K/Akt信号通路,进而影响肿瘤发生和发展过程[16]。例如,Duan等[17]研究发现,PI3K/Akt信号通路在结直肠癌细胞中处于活化状态,该信号通路的激活可促进结肠癌的发生和发展;Wang等[18]的研究表明,抑制PI3K/Akt信号通路可抑制肺癌A549细胞的迁移、侵袭及上皮细胞-间充质转化过程。研究表明,微小RNA可通过调节多种信号通路及基因表达参与恶性肿瘤的发生和发展[19]。因此我们进一步检测各组细胞中PI3K和Akt磷酸化水平,探讨miR-22的抑癌作用与PI3K/Akt信号通路的潜在关系。本研究结果显示,上调miR-22的表达可降低PI3K和Akt磷酸化水平,抑制PI3K/Akt信号通路激活,这提示miR-22改变DAOY细胞增殖、侵袭及促凋亡的作用可能与调节PI3K/Akt信号通路的表达有关。为了进一步验证miR-22是否通过PI3K/Akt信号通路发挥作用,本研究使用PI3K激活剂740Y-P对细胞进行干预,结果显示,740Y-P提高了PI3K和Akt磷酸化水平,激活PI3K/Akt信号通路,削弱了miR-22 mimics抑制细胞增殖、侵袭的作用,降低了细胞凋亡率。随后,我们将转染处理后的各组细胞移植于裸鼠皮下,观察miR-22对DAOY细胞体内成瘤能力的影响,发现miR-22表达上调后,DAOY细胞移植瘤的体积小于对照组和miR-22 NC组,使用740Y-P处理细胞后,DAOY细胞移植瘤的体积大于miR-22 mimics组,与上述研究结果一致。这提示,miR-22可能通过PI3K/Akt信号通路影响DAOY细胞的体内及体外恶性生物学行为。
综上所述,miR-22在髓母细胞瘤细胞系中表达下调,上调miR-22的表达可抑制DAOY细胞的增殖、侵袭并促进细胞凋亡,同时可抑制皮下移植瘤的生长,其作用机制可能与调节PI3K/Akt信号通路的表达有关,miR-22可作为髓母细胞瘤的潜在治疗靶点。
