水稻幼苗响应褐飞虱和稻瘿蚊的转录组分析
2022-06-15卢柏亦蒋哲鄢柳慧钟小惠李晶莹黄福钢李发活莫德原邱永福
卢柏亦 蒋哲 鄢柳慧 钟小惠 李晶莹 黄福钢 李发活 莫德原 邱永福

摘要:【目的】篩选出同时响应褐飞虱和稻瘿蚊取食的基因,揭示水稻幼苗应对2种害虫时基因表达层面的差异,为后续挖掘广谱抗虫基因和解析水稻抗虫机制打下理论基础。【方法】以水稻品种9311为供试植物,分别对15日龄的水稻幼苗进行褐飞虱和稻瘿蚊接虫处理,观测幼苗表型,并通过转录组测序技术分别对褐飞虱接入后24 h和稻瘿蚊接入后7 d的水稻幼苗进行转录组测序。以水稻日本晴基因组作为参考基因组进行对比,利用FPKM法计算基因表达量,设定参数(|log2FC|>1且P<0.05)筛选差异表达基因。结合基因差异表达分析和功能富集分析,研究水稻响应2种害虫的机制异同点。【结果】鉴定出响应褐飞虱取食的差异表达基因3963个,响应稻瘿蚊取食的差异表达基因1206个,有251个差异表达基因同时响应2种害虫,其中108个具有相同表达模式,143个具有相反表达模式。GO功能注释分析表明,褐飞虱取食显著影响植物体内细胞壁合成和缺水响应,而稻瘿蚊取食则对植物光合作用的影响更显著,具有相同表达模式的差异表达基因主要富集在光合作用、水杨酸合成、茉莉酸信号转导和伤害响应等生物学功能,而具有相反表达模式的差异表达基因仅富集在乙醛酸循环。KEGG信号通路富集分析表明,褐飞虱和稻瘿蚊取食均显著影响植物体内次生代谢物的合成,相同表达模式的差异表达基因富集到MAPK信号通路、植物激素信号转导通路及光合作用等6个通路,而相反表达模式的差异表达基因没有富集的通路。【结论】水稻应对褐飞虱和稻瘿蚊的基因表达调控存在相同点和不同之处,共响应2种害虫的调控通路可能在水稻抗虫过程中发挥重要作用。
关键词: 水稻;褐飞虱;稻瘿蚊;转录组
中图分类号: S435.112 文献标志码: A 文章编号:2095-1191(2022)03-0628-13
Transcriptome analysis of rice seedlings responding to brown planthopper infestation and to gall midge infestation
LU Bai-yi, JIANG Zhe, YAN Liu-hui, ZHONG Xiao-hui, LI Jing-ying,
HUANG Fu-gang, LI Fa-huo, MO De-yuan, QIU Yong-fu
(College of Agriculture, Guangxi University/State Key Laboratory for Conservation and Utilization of Subtropical
Agro-bioresources, Nanning, Guangxi 530004, China)
Abstract:【Objective】To screen out the functional genes that respond to both brown planthopper (BPH) infestation and rice gall midge (GM) infestation and reveal the difference of gene expression level in rice seedlings responding to the two pests, so as to provide theoretical basis for new broad-spectrum resistance and rice anti-insect mechanism. 【Method】Rice 9311 was the tested rice variety. Fifteen-day-old seedlings were treated with BPH and GM respectively to observe seedling phenotypes and to sample for transcriptome which sequence was performed on rice seedlings that were collected 24 hours after BPH infestation and 7 days after GM infestation, respectively. Taking the genome of Nipponbare (MSU7) as a reference to align the sequences, the differentially expressed genes (DEGs) were screened by calculating the gene expression level in Fragments Per Kilobase per Million (FPKM), with (|log2FC|≥1 and P≤0.05) as the parameter. Through gene differential expression analysis and functional enrichment analysis, the similarities and differences of rice response mechanisms to the two pests were identified. 【Result】The results showed that 3963 genes were differentially expressed in BPH infestation and 1206 genes were differentially expressed in GM infestation. And 251 genes were found responsive to both pests, of which 108 genes with the same expression pattern and 143 genes with opposite expression patterns. GO enrichment analysis showed that:BPH infestation significantly influenced the cell wall biogenesis and the response to water deprivation in rice seedlings; seedlings of GM infestation enriched GO terms were mostly chloroplast or photosynthesis-related; the DEGs with the same expression patterns of two pest stresses were enriched to some biological processes such as photosynthesis, salicylic acid biosynthetic process, regulation of jasmonic acid mediated signaling pathway and response to wounding; whereas the DEGs with the opposite expression patterns of two pest stresses were enriched to glyoxy-late cycle only. KEGG enrichment analysis indicated that:Both BPH infestation and GM infestationsignificantly affected the biosynthesis of secondary metabolites in seedlings; the DEGs with the same expression patterns in both treatments were enriched into six pathways mainly involved in MAPK signaling pathway, plant hormone signal transduction pathway, photosynthesis pathway; while no significant KEGG pathway was enriched in the DEGs with opposite expression patterns. 【Conclusion】These results suggest that the common pathways in two pest infestations probably play an important role in rice resistance while similarities and differences exist in the regulations of gene expression between BPH infestation and GM infestation.C3EF4567-7C12-48BB-84A9-C29F2CF52217
Key words: rice; brown planthopper; gall midge; transcriptome
Foundation items: Guangxi Natural Science Foundation (2020GXNSFDA297008)
0 引言
【研究意义】水稻是我国主要粮食作物,在第一次绿色革命后,水稻由高秆向矮秆转变,对水稻危害严重的害虫种类也发生了明显变化,且害虫种类不断增多,虫灾日益频繁(严火其,2021)。褐飞虱(Brown planthopper,BPH)和稻瘿蚊(Gall midge,GM)是我国南方灾害性害虫,因危害方式(褐飞虱通过刺吸,稻瘿蚊通过咀嚼)和危害部位的差异(Li et al.,2020;Shi et al.,2021),水稻对这2种害虫的防御机制也有所不同,只有极少数水稻品种可兼顾对2种害虫的抗性。因此,做好有效的防治,实现对褐飞虱和稻瘿蚊灾害发生风险的有力控制具有重要意义,而防治2种害虫最科学、安全的手段是挖掘和利用内源性广谱抗虫基因(杨利艳等,2020;严火其,2021),并以此培育抗虫品种,从而减少灾害损失和农药的施用。【前人研究进展】在褐飞虱和稻瘿蚊双抗材料研究方面,已报道并进行遗传分析的双抗水稻品种有:江潮、RP1976-18-6-4-2和ARC5833(黄凤宽等,2006;吴碧球等,2014;秦学毅等,2016;鄢柳慧等,2020)。RP1976-18-6-4-2对褐飞虱和稻瘿蚊的抗性评价为抗,由1对显性基因和1对隐性基因控制对褐飞虱的抗性,由1对显性基因控制对稻瘿蚊的抗性(黄凤宽等,2006)。江潮对2种害虫均表现为高抗,是由1对显性基因控制对稻瘿蚊的抗性、1对隐性基因控制对褐飞虱的抗性,2个基因间独立遗传(秦学毅等,2016)。ARC5833与江潮的抗性表现一致,对2种害虫表现为高抗,但在抗性基因的遗传上比江潮复杂。ARC5833对褐飞虱的抗性由单一显性基因控制,对稻瘿蚊中国II型由1对显性基因和1对隐性基因控制,而对稻瘿蚊中国IV型则由1对显性基因控制(吴碧球等,2014;鄢柳慧等,2020)。已发现的3个双抗褐飞虱和稻瘿蚊水稻品种对2种害虫的控制基因为分开独立遗传,增加了后期基因鉴定、抗虫机制解析及利用的复杂程度。在水稻抗虫机制研究方面,组学研究(主要包括转录组、蛋白组和代谢组等)作为了解植物对昆虫取食反应的重要技术途径之一,已有大量的组学研究揭示水稻幼苗响应褐飞虱取食的机制,却很少研究水稻对稻瘿蚊的响应机制。代谢组学相关的抗虫研究表明,GABA支路和莽草酸介导的次生代谢途径对水稻抗褐飞虱具有重要作用(Liu et al.,2010),而脂肪酸及其衍生物、氨基酸及次生代谢物则在水稻抗稻瘿蚊中发挥重要作用(陈灿等,2021)。利用抗虫激素组学对Bph6和Bph9的9311背景的近等基因系(NIL-Bph6和NIL-Bph9,以9311为背景材料)以及对照9311为材料进行检测,发现在褐飞虱取食过程中2个近等基因系的SA、JA和JA-Ile上调显著且响应速度快,而感性品种9311则激素水平变化小且反应时间滞后(Zhao et al.,2016;杜波等,2018;Guo et al.,2018)。通过转录组技术测定褐飞虱取食48 h后的水稻幼苗基因表达变化,揭示了褐飞虱取食能激发水稻的应激反应和保护机制,同时降低营养合成的过程,解释了褐飞虱为害造成水稻减产的原因(曹征鸿等,2020)。在水稻抗虫基因挖掘方面,已有研究利用抑制消减杂交技术(SSH)通过筛选差异表达基因,鉴定出OsERF3、OsWRKY70和OsHI-LOX等对水稻褐飞虱和二化螟抗性均具有显著影响的基因,这3个基因均能增强水稻对二化螟的抗性,而降低水稻对褐飞虱的抗性,在植株内表现出相反的调节模式(Zhou et al.,2009;Lu et al.,2011;Li et al.,2015)。OsERF3、OsWRKY70和OsHI-LOX等基因的研究结果说明,通过组学研究可筛选出具有调控水稻对刺吸式昆虫和咀嚼式昆虫抗性的基因,实现单一基因调控水稻对不同种类昆虫的抗性具有可行性。【本研究切入点】目前,关于单一基因控制水稻共调控褐飞虱和稻瘿蚊的抗性机理研究尚无文献报道,系统揭示水稻响应刺吸式昆虫和咀嚼式昆虫取食间的组学差异研究也鲜见报道。【拟解决的关键问题】通过研究水稻在褐飞虱和稻瘿蚊胁迫下的转录水平变化,比较2种胁迫下差异表达基因的功能异同,获得水稻对2种害虫取食共响应的基因,明确筛选出双抗基因的可行性,为后续挖掘广谱抗虫基因和解析水稻抗虫机制打下理论基础。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试植物 供试水稻品种为9311,于温室培育。温室条件:温度(26±2)℃,光周期 L∶D=16 h∶8 h,相对湿度(75±5)%。
1. 1. 2 供试害虫 供试褐飞虱采自广西南宁市广西大学,供试稻瘿蚊收集自广西崇左市大新县,2种害虫均在温室的9311植株上繁殖多代。
1. 2 樣品处理
在褐飞虱取食处理中,每杯(口径10 cm,深度16 cm)种植10株水稻幼苗,15日苗龄接入褐飞虱2~3龄若虫,每株苗8头虫,即每杯接入80头虫。在稻瘿蚊取食处理中,每杯种植8株稻苗,15日苗龄接入稻瘿蚊成虫,每杯苗接入4头虫。
1. 3 表型获取
加入褐飞虱若虫后第3 d,用佳能70D相机拍摄褐飞虱为害后的水稻植株表型;加入稻瘿蚊成虫后第16 d,拍摄稻瘿蚊为害后的植株表型。用小米11微距相机拍摄取食中的褐飞虱表型,用体式显微镜拍摄取食中的稻瘿蚊表型。
1. 4 测序样品采集
接入褐飞虱2~3龄若虫后昆虫立即取食,24 h可观测到苗尖轻微萎蔫症状,72 h可观测到稻苗完全干枯,因此选取24 h作为褐飞虱处理的取样时间点。接入稻瘿蚊成虫后前3 d为产卵孵化期,7 d为虫体快速增长期,因此选择7 d作为稻瘿蚊处理的取样时间点。褐飞虱取食24 h后,取出水稻,剪取茎秆组织即褐飞虱取食部位作为转录组测序样品存于液氮中。接入稻瘿蚊后第7 d,取出水稻,剪取靠近根部的茎秆组织即稻瘿蚊取食部位存于液氮中。褐飞虱和稻瘿蚊处理各设1个对照组,对照组不做任何处理,各处理设3个生物学重复,总计12个。C3EF4567-7C12-48BB-84A9-C29F2CF52217
1. 5 RNA处理与转录组测序
采用TRIzol法提取水稻样品总RNA,经琼脂糖凝胶电泳和微量分光光度计(NanoDrop 2000)检测样品合格后用于cDNA文库构建。利用PicoGreen和荧光分光光度计方法定量文库[双链DNA(dsDNA)定量检测试剂盒Quant-iT PicoGreen dsDNA Assay Kit购自Invitrogen公司;荧光分光光度计Quantifluor-ST fluorometer购自Promega公司]。使用Agilent 2100生物分析仪(购自Agilent公司,并搭配使用与其配套的DNA试剂盒Agilent High Sensitivity DNA Kit运行DNA样品分析)对PCR富集片段进行质量控制,验证DNA文库的片段大小及分布。将合格样品分别稀释至10 nmol/L后,逐步稀释定量至4~5 nmol/L进行上机测序,采用Illumina HiSeqTM 2000平台完成转录组测序。建库和测序均由上海派森诺生物科技有限公司完成。
1. 6 差异基因表达分析
测序原始数据序列经质量分析去除低质量序列和接头序列后,得到可供进行后续分析的序列。因9311基因组序列组装质量不如日本晴,因此选用水稻基因组注释数据库(http://rice.uga.edu/,日本晴基因组)作为参照基因组,使用HTSeq统计比对到每个基因上的Read count值,作为基因原始表达量,然后采用FPKM对表达量进行标准化。采用DESeq对基因表达量进行差异分析,差异表达基因(Differentially expressed genes,DEGs)筛选条件为:|log2 FC|>1且P<0.05。
1. 7 GO功能注释和KEGG信号通路富集分析
使用基迪奥云平台对差异基因进行数据分析(https://www.omicshare.com/)。差异表达基因的GO功能注释分析和KEGG信号通路富集分析分别通过云平台的动态GO功能注释分析云工具和动态KEGG信号通路富集分析云工具完成。
1. 8 转录组数据可视化
使用基迪奥云平台对差异基因进行数据可视化(https://www.omicshare.com/):差异表达基因数量的可视化由柱状图和维恩图云工具完成;GO功能注释分析和KEGG信号通路富集分析可视化由动态富集差异气泡图和动态富集条形图云工具完成;差异表达基因表达量可视化由动态热图云工具完成。
2 结果与分析
2. 1 褐飞虱和稻瘿蚊取食对9311幼苗的影响
2种害虫取食对9311水稻品种幼苗产生的影响不同。接入褐飞虱3 d后,幼苗表现枯死症状(图1-A);图1-B和图1-C展示在水稻茎秆外部吸食汁液的褐飞虱若虫。稻瘿蚊对稻苗的为害特点为生长点基部膨大,15 d左右可明显观察到稻瘿蚊取食后水稻顶叶转变为葱管(图1-D);图1-E和图1-F分别展示接入稻瘿蚊成虫16和7 d后正在水稻葱管内取食的稻瘿蚊若虫。
2. 2 差异表达基因分析结果
转录组测序共设12个样本,包括褐飞虱处理组、褐飞虱处理的对照组、稻瘿蚊处理组和稻瘿蚊处理的对照组,各3个样本。从整体上看,每个样本最后得到4000万~4700万条Reads,Q30为93%~96%。过滤后得到的高质量数据比对参考基因组,样本中有83%~87%的测序序列可定位到参考序列上。表明整体测序数据质量良好,数据可用于进一步的转录组分析。
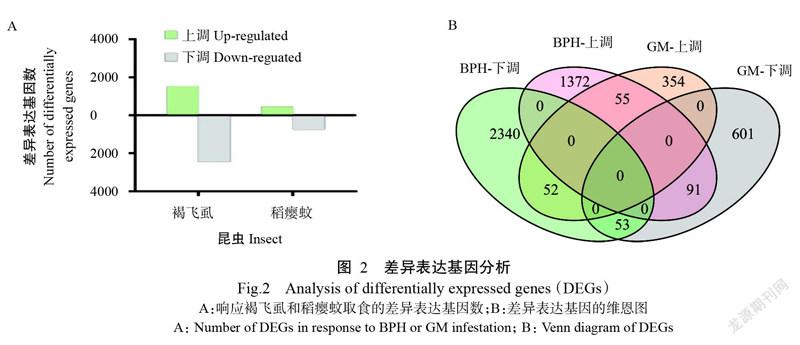
经过褐飞虱处理,共有3963个基因表达发生明显变化,其中有1518个基因上调,2445个基因下调。而稻瘿蚊处理下仅发现1206个差異表达基因,其中461个基因上调,745个基因下调(图2-A)。共有251个差异表达基因在2种害虫取食后表达量均发生明显变化,在251个基因中有55个基因在2种处理中表达量均上调;53个基因在2种处理中均下调;91个基因在褐飞虱处理中表达上调、在稻瘿蚊处理中表达下调;52个基因在褐飞虱处理中表达下调、在稻瘿蚊处理中表达上调(图2-B)。即本研究中对褐飞虱和稻瘿蚊具有相同的响应模式基因108个,具有相反响应模式基因143个。
2. 3 差异表达基因GO功能注释分析结果
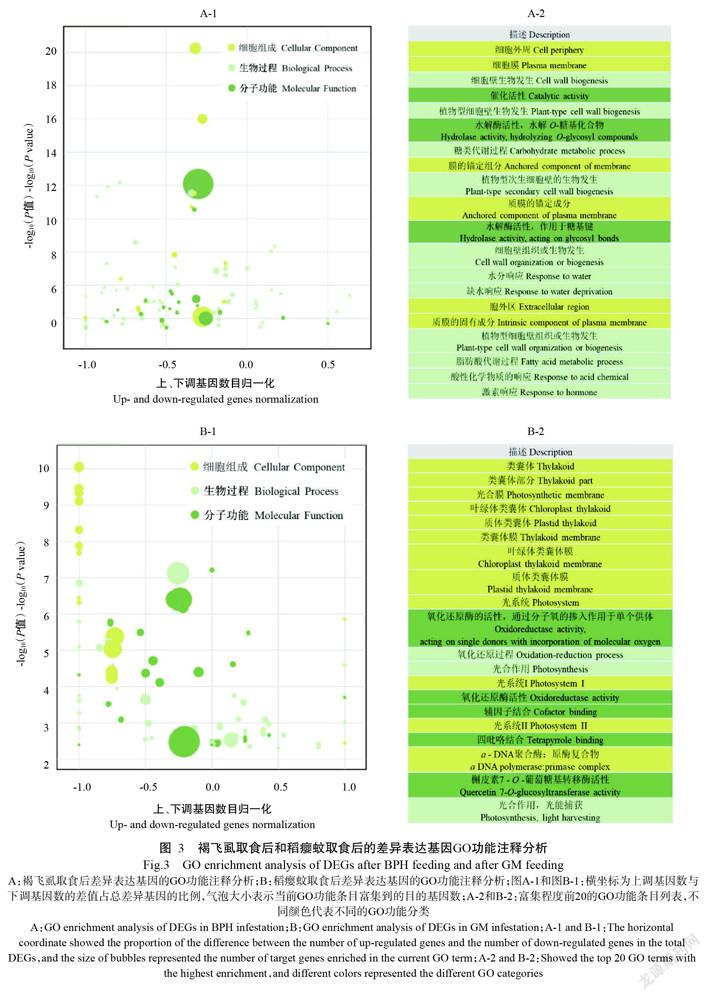
将差异表达基因进行GO功能注释分析,发现响应褐飞虱胁迫的基因和响应稻瘿蚊胁迫的基因在GO功能条目上具有较大差异。响应褐飞虱胁迫的基因参与的生物学过程主要注释在细胞壁合成、缺水响应、碳水化合物代谢、脂肪酸代谢、酸性化学物质响应和激素响应,基因的表达产物在细胞中的定位注释在细胞外周和细胞膜,基因的分子功能注释于水解酶活性和催化活性(图3-A)。响应稻瘿蚊胁迫的差异表达基因在光合作用和氧化还原等生物过程富集,在类囊体相关、光合膜、光合系统、叶绿体、质体和DNA聚合酶等细胞组分上富集,在氧化还原活性相关、四吡咯结合和辅因子结合等分子功能富集(图3-B)。
将2种害虫的251个共响应差异表达基因分为2类进行GO功能注释分析,一类是在共响应中具有相同响应模式的108个差异表达基因,另一类是在共响应中具有相反响应模式的143个差异表达基因。具有相同响应模式的差异表达基因在功能条目上主要包括:光合作用、水杨酸合成与代谢、茉莉酸介导的信号通路、细胞过程调节和伤害响应等生物过程;光合系统、光合膜、类囊体、叶绿体和质体等细胞组分(图4-A)。这些功能条目在整体上与响应稻瘿蚊胁迫的基因较相似,但在富集程度上也存在一定差异,如响应植物激素的基因在相同响应模式的基因中比在响应稻瘿蚊胁迫的基因中更富集(图4-A)。而在2种害虫胁迫过程中具有相反响应模式的差异表达基因最主要集中在乙醛酸循环相关的生物过程,只有乙醛酸循环、乙醛酸代谢过程和乙醛酸循环体3个生物过程的GO富集P<0.05(图4-B)。说明较多的生物学功能在水稻应对2种害虫时响应模式相似,而响应模式相反的生物学功能较少。C3EF4567-7C12-48BB-84A9-C29F2CF52217
2. 4 差异表达基因的KEGG信号通路富集分析结果
对差异表达基因前20个KEGG信号通路分析发现,在褐飞虱和稻瘿蚊胁迫富集基因最多的前3个通路均为次生代谢物的生物合成、代谢途径和苯丙素的生物合成。除该3条代谢通路外,在褐飞虱胁迫下基因在以下通路中富集:代谢通路中的脂肪酸合成与代谢、黄酮与类黄酮的生物合成、糖分代谢、酸类代谢及角质、木栓质和蜡质的生物合成等;环境信息处理通路中的植物激素信号传导;有机系统通路上的植物与病原菌互作(图5-A)。与褐飞虱的响应机制不同,稻瘿蚊处理后基因主要参与以下途径:代谢通路中的光合作用、玉米素合成、氨基酸代谢、亚油酸代谢、各种次生代谢物的生物合成;遗传信息处理通路中的DNA复制(图5-B)。此外,卟啉和叶绿素代谢通路及甘油磷脂代谢通路在2种害虫取食中的KEGG信号通路富集均为前20,但这2个通路的响应程度在褐飞虱与稻瘿蚊间存在明显差异,卟啉和叶绿素代谢通路对稻瘿蚊的响应程度高于褐飞虱,而甘油磷脂通路对褐飞虱的响应程度高于稻瘿蚊,且甘油磷脂通路在稻瘿蚊响应中不属于显著富集,富集程度位于阈值P=0.05之下(图5-A和图5-B)。
对共响应基因进行KEGG信号通路富集分析,发现在相同响应模式的基因中仅有6个通路表现为富集:MAPK信号通路、光合作用—天线蛋白、甜菜红碱生物合成、植物激素信号转导、氨基糖和核苷酸糖的代谢及光合作用(图6-A)。分析发现在相反响应模式的基因中没有可以被显著富集到的KEGG通路(图6-B)。综上分析表明,在统计学角度水稻内存在6个对2种害虫均具有一致响应模式的通路,无响应模式相反的通路。
2. 5 对2种害虫具有相同响应模式的基因分析结果
筛选出转录组中对2种害虫有相同响应模式的基因,分为共上调基因和共下调基因进行表达量可视化及功能注释。基因的功能注释由水稻基因组数据库网站(http://rice.uga.edu/)获得。利用log2 FC的值来表示表达量变化倍数的高低,上调为正值,下调为负值。由图5可明显看出,在共上调基因中,LOC_Os03g64260和LOC_Os11g47600表达量增加倍数显著高于其他基因,前者被注释为含AP2结构域的蛋白(AP2 domain containing protein),对褐飞虱的响应程度更高,而后者被注释为糖苷水解酶(Glycoside hydrolase),对稻瘿蚊的响应程度更高。共下调基因中的LOC_Os10g40520.1被注释为脂质转运家族蛋白前体145(LTPL145),在稻瘿蚊取食后表达量显著下调,下调倍数明显高于其他共下调基因。被注释为表达蛋白(Expressed protein)的基因无论是在共上调还是共下调基因中均数量最多。除了表达蛋白,在共上调基因中数量较多的还有被注释为以下蛋白质的基因:含有AP2结构域的蛋白(AP2 domain containing protein)、钙调素结合蛋白(Calmodulin binding protein)、糖苷水解酶(Glycoside hydrolase)和含有ZIM结构域的蛋白质(ZIM domain containing protein)(图7-A);在下调基因中注释为植物脂质转运家族蛋白前体的基因数量最多(LTPL145、LTPL20、LTPL52和LTPL66)(图7-B)。
3 讨论
通过分析褐飞虱和稻瘿蚊取食后苗期水稻的转录组情况,筛选得到3963个褐飞虱取食诱导的差异表达基因和1206个稻瘿蚊取食诱导的差异表达基因。响应褐飞虱的差异表达基因数较稻瘿蚊的多1倍以上,可能与稻苗的处理时长和伤害水平有关。褐飞虱处理的幼苗取样时间短,仅24 h,而稻瘿蚊处理为7 d后取样,植物拥有更长的缓冲平衡时间。不同的取样时间点,对差异基因数量的获得具有较大影响,如水稻品种Taichuang Native 1在褐飞虱取食6 h后引起1104个基因表达差异,取食48 h后则有2523个差异表达基因(曹征鸿等,2020;Liu et al.,2021)。除此之外,褐飞虱对水稻的伤害比稻瘿蚊严重,同时接入大量的褐飞虱若虫致使幼苗3 d内完全枯死,而稻瘿蚊若虫仅啃食咬小部分组织。因此,褐飞虱取食于水稻而言是突发的致死性伤害,导致應激的基因多于稻瘿蚊处理。
GO功能注释分析表明响应褐飞虱取食后差异基因的生物学功能最显著富集在细胞壁合成和缺水响应,而稻瘿蚊取食后差异基因的生物学功能最显著富集在光合作用上。差异基因富集的细胞定位与生物学功能具有密切联系,如褐飞虱的差异基因富集于细胞壁和细胞外周,而响应稻瘿蚊的差异基因富集在光合作用相关的细胞器,如类囊体、叶绿体和质体等。究其原因与水稻应对这2种胁迫的特征有关,褐飞虱是刺吸式昆虫,吸食水稻汁液导致稻苗缺水枯死,因此引起大量细胞壁合成相关基因响应和稻苗的缺水反应(Zhang et al.,2004);稻瘿蚊的取食则促使水稻发育形成标葱,影响植株形态发育,进而影响光合作用。已知的抗褐飞虱基因bph6和bph30被证实为通过增加细胞壁硬度和厚壁组织的厚度阻碍褐飞虱取食,前者通过胞泌蛋白调控细胞壁的形成,后者则通过上调薄壁组织纤维素与半纤维素相关基因增加厚壁组织细胞壁中纤维素和半纤维素的积累(Guo et al.,2018;Shi et al.,2021)。而水稻对咀嚼式昆虫一直缺乏有效的抗性资源,因此涉及的抗虫机理存在大量空白。但已有大量研究表明致瘿昆虫普遍削减寄主植物的光合作用,Huang等(2011,2015)通过测量叶绿素荧光发现红楠和长叶木姜子瘿蚊诱导的虫瘿部位光合效率显著低于健康部位。然而也有部分致瘿昆虫对植物没有显著影响或增强光合作用,如橄榄星室木虱和瘿蜂(Fay et al.,1993;Malenovsky et al.,2015)。此外,致瘿昆虫在虫瘿内完成整个生活史,对植物产生的影响丰富多样,研究表明致瘿昆虫还具有使植物细胞壁变薄、胞间连丝增大、细胞器变多等植物细胞重编程的功能(Florentine et al.,2005;Giron et al.,2016;杨孟可等,2021)。本研究中的GO富集分析结果与前人研究结论一致,在感性品种9311中,与细胞壁合成和光合作用相关的基因更多地呈现下调趋势,因此研究细胞壁的形成与水稻抗褐飞虱取食之间的关系有利于揭示水稻抗褐飞虱机理,而稻瘿蚊还需进一步研究探索增强植物光合作用以及增强植物细胞壁强度是否有助于抗虫功能。稻瘿蚊引起的水稻标葱是虫瘿的一种(Agarrwal et al.,2014),大部分关于致瘿昆虫与植物间互作关系的研究集中于林木,稻瘿蚊引起的水稻虫瘿未有深入研究,利用水稻作为模式植物进一步探明水稻标葱的形成与稻瘿蚊取食之间的关系是未来的研究方向,研究结果可为植物响应生物胁迫和致瘿昆虫与植物协同进化提供理论支撑。C3EF4567-7C12-48BB-84A9-C29F2CF52217
KEGG信號通路富集分析表明2种害虫取食均引起有关代谢通路、次生代谢物生物合成和苯丙素生物合成的显著变化。次生代谢物是植物长期进化中应对环境和胁迫所产生的结果,在植物对昆虫防御方面发挥着重要作用(张文辉和刘光杰,2003)。其中挥发性的次生代谢物可诱集植食性昆虫的寄生蜂和天敌,间接地进行植物防御(Howe and Jander,2008)。水稻氢过氧化物裂解酶OsHPL3通过调节羟磷脂途径,吸引稻虱缨小蜂寄生从而提高水稻对褐飞虱的抗性(Tong et al.,2012)。但最新研究表明植物次生代谢物不仅能被植物用于间接防御虫害,反之亦可被昆虫用于抵御天敌,如褐飞虱偏爱与二化螟共享寄主是因为褐飞虱可借助二化螟诱导水稻挥发物而规避稻虱缨小蜂对其卵的寄生(Hu et al.,2020);该团队随后又发现褐飞虱也能帮助二化螟实现对水稻的反防御,褐飞虱取食不仅可下调二化螟单独取食诱导的防御基因,而且能降低水稻利用信息挥发物吸引稻螟赤眼蜂,甚至做到排斥,极大降低二化螟卵的寄生率(Liu et al.,2021)。褐飞虱与二化螟作为水稻最主要的两大害虫,二者间可形成种间互利关系,携手对抗水稻。由此可见,植物的次生代谢物合成与昆虫间的关系非常复杂,褐飞虱与稻瘿蚊之间是否也具有互利的关系值得深入研究,为将来制定害虫生态防控打下理论基础。
对差异基因进行维恩分析,发现水稻对褐飞虱和稻瘿蚊的共响应基因有251个,其中108个基因表达模式相似,143个表达模式相反。对共响应基因进行富集分析,发现具有相同响应模式的差异表达基因具有多个显著富集的GO功能条目和6个KEGG信号通路,具有相反模式的差异表达基因仅有3个显著富集的GO功能条目。因此,水稻内存在较多的对2种害虫共响应的生物学功能和信号通路,寻找到一个能共同调控褐飞虱和稻瘿蚊抗性的通路具有可行性。具有相同表达模式的差异表达基因在生物学功能上主要与光合作用、激素信号转导和MAPK信号通路有关,其中激素调节主要涉及水杨酸的生物合成和茉莉酸信号途径。已有大量研究表明茉莉酸和水杨酸参与植物响应生物胁迫,调控褐飞虱的抗性(李毅等,2018;Xu et al.,2021)。如褐飞虱取食激活了水杨酸依赖的激素信号通路,并通过水杨酸信号通路抑制胼胝质降解,从而增强对褐飞虱的抗性(Ling and Weilin,2016)。另外,研究表明,MAPK参与调控植株体内的水杨酸与茉莉酸信号,在水稻信号传导中发挥重要作用(Yuan et al.,2005;Wang et al.,2008;Hu et al.,2011)。Li等(2019)研究表明,OsMAPK20-5基因负调控水稻对褐飞虱的抗性,该基因的表达量在褐飞虱怀孕的雌虫和成虫取食过程中上调迅速,将该基因沉默后显著提高植株乙烯和一氧化氮的积累,从而提高植株对褐飞虱成虫的抗性并降低褐飞虱的产卵水平。关于激素信号通路和MAPK信号通路在褐飞虱抗性研究中较为广泛,因这2个通路在2种害虫中具有相同的响应模式,因此后续在稻瘿蚊的抗虫机理解析中可借鉴褐飞虱的研究进展进行综合考量。具有相反表达模式的基因的GO功能注释,3个条目均与乙醛酸循环相关,乙醛酸循环可实现脂肪到糖的转变,褐飞虱取食增强感性材料的乙醛酸循环(Peng et al.,2016),而稻瘿蚊取食则降低乙醛酸循环相关基因的表达。此外,代谢组检测稻瘿蚊取食48 h后糖类的含量,其中果糖、葡萄糖和半乳糖均显著降低,抗性材料的下降程度比感性材料更剧烈(陈灿等,2021)。推测出现这种情形的原因与2种害虫对植物的伤害相关,褐飞虱取食后改变了植物体的渗透压,需要更多的糖分来维持平衡,而稻瘿蚊取食后,植物快速生长形成虫瘿,消耗大量糖分。因此,探清乙醛酸循环在植物抗性机制内的功能尚需更深入的研究。
4 结论
通过水稻幼苗的转录组分析,筛选出3963个响应褐飞虱取食的差异表达基因,1206个响应稻瘿蚊取食的差异表达基因,其中有251个基因对2种害虫的取食共响应,这些共响应基因主要富集在光合作用、激素信号传导、次生代谢物合成和乙醛酸循环等通路上。表明水稻幼苗响应这2种害虫具有相同点和不同之处,推测这些共响应通路在水稻广谱抗虫上可能发挥着重要作用。
参考文献:
曹征鸿,贺康,徐乐,汤沈杨,王亚琴,李飞. 2020. 苗期水稻响应褐飞虱取食的基因差异表达分析[J]. 应用昆虫学报,57(4):911-920. [Cao Z H,He K,Xu L,Tang S Y,Wang Y Q,Li F. 2020. Change in the gene expression of seedling stage rice in response to feeding by the brown planthopper Nilaparvata lugens (St?l)(Hemiptera: Delphaci-dae)[J]. Chinese Journal of Applied Entomology 57(4):911-920.] doi: 10.7679/j.issn.2095-1353. 2020.093.
陈灿,张宗琼,夏秀忠,杨行海,农保选,张晓丽,徐志健,李丹婷,郭辉,冯锐. 2021. 代谢组学揭示水稻—稻瘿蚊互作的潜在生化标识物[J]. 南方农业学报,52(10):2662-2670. [Chen C,Zhang Z Q,Xia X Z,Yang X H,Nong B X,Zhang X L,Xu Z J,Li D T,Guo H,Feng R. 2021. Metabolomics reveals potential biomarkers of rice gall midge(Orseolia oryzae) interactions[J]. Journal of Sou-thern Agriculture,52(10):2662-2670.] doi:10.3969/j.issn.2095-1191.2021.10.005.C3EF4567-7C12-48BB-84A9-C29F2CF52217
杜波,陳荣智,何光存. 2018. 抗褐飞虱基因的发掘、鉴定与利用[J]. 生命科学,30(10):1072-1082. [Du B,Chen R Z,He G C. 2018. The progress of functional genomics research of rice resistance to insect[J]. Chinese Bulletin of Life Sciences,30(10):1072-1082.] doi: 10.13376/j.cbls/2016158.
黄凤宽,韦素美,梁广文,黄所生,蒋显斌,罗善昱,李青. 2006. 水稻品种RP1976-18-6-4-2对褐飞虱和稻瘿蚊的抗性评价及其遗传分析[J]. 中国水稻科学,20(1):113-115. [Huang F K,Wei S M,Liang G W,Huang S S,Jiang X B,Luo S Y,Li Q. 2006. Genetic analysis on the resistance to the brown planthopper and rice gall midge in rice variety RP1976-18-6-4-2[J]. Chinese Journal of Rice Science,20(1):113-115.] doi: 10.16819/j.1001-7216.2006.01.021.
李毅,张嘉娇,杜波,何光存,李家儒. 2018. 水稻与褐飞虱化学关系的研究进展[J]. 植物生理学报,54(4):528-538. [Li Y,Zhang J J,Du B,He G C,Li J R. 2018. Research progress of chemical interactions between rice and brown planthopper[J]. Plant Physiology Journal,54(4):528-538.] doi: 10.13592/j.cnki.ppj.2017.0530.
秦学毅,邓国富,冯锐,郭辉,刘百龙. 2016. 稻褐飞虱和稻瘿蚊双抗种质的抗性基因精细定位及创新利用[Z]. 国家科技成果. [Qin X Y,Deng G F,Feng R,Guo H,Liu B L. 2016. Fine mapping and innovative utilization of resistance genes of rice brown planthopper and rice gall midge double resistant germplasm[Z]. National Scientific and Technological Achievements.]
吴碧球,黄凤宽,黄所生,韦素美. 2014. 水稻品种ARC5833对稻瘿蚊的抗性评价及其遗传分析[J]. 西南农业学报,27(4):1483-1487. [Wu B Q,Huang F K,Huang S S,Wei S M. 2014. Identification and genetic analysis of gall midge resistance in rice variety ARC5833[J]. Southwest China Journal of Agricultural Sciences,27(4):1483-1487.] doi: 10.16213/j.cnki.scjas.2014.04.017.
鄢柳慧,黄福钢,舒宛,张启明,赵能,莫心怡,王驰,曹凯,邱永福. 2020. 籼稻品种‘ARC5833抗褐飞虱基因的遗传分析与定位[J]. 分子植物育种,18(18):6038-6043. [Yan L H,Huang F G,Shu W,Zhang Q M,Zhao N,Mo X Y,Wang C,Cao K,Qiu Y F. 2020. Genetic analysis and mapping of brown planthopper resistance gene in indica rice variety ‘ARC5833[J]. Molecular Plant Breeding,18(18):6038-6043.] doi: 10.13271/j.mpb.018.006038.
严火其. 2021. 农业害虫危害何以越来越严重[J]. 中国农史,40(3):3-15. [Yan H Q. 2021. Why are agricultural pests becoming more and more harmful[J]. Agricultural History of China,40(3):3-15.]
杨利艳,张玉荣,杨雅舒,王美霞,陈保国,赵丽,张丽光,王创云. 2020. 基于RNA-seq数据分析玉米抗虫响应基因的可变剪接事件[J]. 河南农业大学学报,54(2):181-188. [Yang L Y,Zhang Y R,Yang Y S,Wang M X,Chen B G,Zhao L,Zhang L G,Wang C Y. 2020. Analysis of alternative splicing events of insect-resistant response genes based on RNA-seq data in Zea mays[J]. Journal of Henan Agricultural University,54(2):181-188.] doi:10.16445/j.cnki.1000-2340.20200403.009.
杨孟可,刘赛,乔海莉,郭昆,徐荣,徐常青,陈君. 2021. 致瘿昆虫对寄主植物生理和代谢的影响[J]. 昆虫学报,64(4):536-548. [Yang M K,Liu S,Qiao H L,Guo K,Xu R,Xu C Q,Chen J. 2021. Influences of gall-inducing insects on the physiology and metabolism of host plants[J]. Acta Entomologica Sinica,64(4):536-548.] doi: 10.16380/j.kcxb.2021.04.012.C3EF4567-7C12-48BB-84A9-C29F2CF52217
張文辉,刘光杰. 2003. 植物抗虫性次生物质的研究概况[J]. 植物学通报,20(5):522-530. [Zhang W H,Liu G J. 2003. A review on plant secondary substances in plant resistance to insect pests[J]. Chinese Bulletin of Botany,20(5):522-530.] doi:10.3969/j.issn.1674-3466.2003.05.002.
Agarrwal R,Bentur J S,Nair S. 2014. Gas chromatography mass spectrometry based metabolic profiling reveals biomarkers involved in rice-gall midge interactions[J]. Journal of Integrative Plant Biology,56(9):837-848. doi: 10.1111/jipb.12244.
Fay P A,Hartnett D C,Knapp A K. 1993. Increased photosynthesis and water potentials in Silphium integrifolium galled by cynipid wasps[J]. Oecologia,93(1):114-120. doi:10.1007/bf00321200.
Florentine S K,Raman A,Dhileepan K. 2005. Effects of gall induction by Epiblema strenuana on gas exchange,nutrien-ts,and energetics in Parthenium hysterophorus[J]. Biocontrol,50(5):787-801. doi:10.1007/s10526-004-5525-3.
Giron D,Huguet E,Stone G N,Body M. 2016. Insect-induced effects on plants and possible effectors used by galling and leaf-mining insects to manipulate their host-plant[J]. Journal of Insect Physiology,84:70-89. doi:10.1016/j.jinsphys.2015.12.009.
Guo J P,Xu C X,Wu D,Zhao Y,Qiu Y F,Wang X X,Ou-yang Y D,Cai B D,Liu X,Jing S L,Shangguan X X,Wang H Y,Ma Y H,Hu L,Wu Y,Shi S J,Wang W L,Zhu L L,Xu X,Chen R Z,Feng,Y Q,Du B,He G C. 2018. Bph6 encodes an exocyst-localized protein and confers broad resistance to planthoppers in rice[J]. Nature Genetics,50(2):297-306. doi:10.1038/s41588-018-0039-6.
Howe G A,Jander G. 2008. Plant immunity to insect herbivores[J]. Annual Review of Plant Biology,59:41-66. doi:10.1146/annurev.arplant.59.032607.092825.
Hu J,Zhou J B,Peng X X,Xu H H,Liu C X,Du B,Yuan H Y,Zhu L L,He G C. 2011. The Bphi008a gene interacts with the ethylene pathway and transcriptionally regulates MAPK genes in the response of rice to brown planthopper feeding[J]. Plant Physiology,156(2):856-872. doi:10.1104/pp.111.174334.
Hu X Y,Su S L,Liu Q S,Jiao Y Y,Peng Y F,Li Y H,Turlings T C. 2020. Caterpillar-induced rice volatiles provide enemy-free space for the offspring of the brown planthopper[J]. Elife,9:e55421. doi:10.7554/eLife.55421.
Huang M Y,Huang W D,Chou H M,Chen C C,Chen P J,Chang Y T,Yang C M. 2015. Structural,biochemical,and physiological characterization of photosynthesis in leaf-derived cup-shaped galls on Litsea acuminata[J]. BMC Plant Biology,15(1):61. doi:10.1186/s12870-015- 0446-0.
Huang M Y,Lin K H,Yang M M,Chou H M,Yang C M,Chang Y T. 2011. Chlorophyll fluorescence,spectral proper-ties,and pigment composition of galls on leaves of Machilus thunbergii[J]. International Journal of Plant Sciences,172(3):323-329. doi:10.1086/658157.C3EF4567-7C12-48BB-84A9-C29F2CF52217
Li J C,Liu X L,Wang Q,Huangfu J Y,Schuman M C,Lou,Y G. 2019. A group D MAPK protects plants from autotoxicity by suppressing herbivore-induced defense signaling[J]. Plant Physiology,179(4):1386-1401. doi:10.1104/pp. 18.01411.
Li R,Zhang J,Li J C,Zhou G X,Wang Q,Bian W B,Erb M,Lou Y G. 2015. Prioritizing plant defence over growth through WRKY regulation facilitates infestation by non-target herbivores[J]. Elife,4:e04805. doi:10.7554/elife. 04805.020.
Li Y,Mo Y,Li Z H,Yang M,Tang L H,Cheng L,Qiu Y F. 2020. Characterization and application of a gall midge resistance gene (Gm6) from Oryza sativa ‘Kangwenqingzhan[J]. Theoretical and Applied Genetics,133(2):579-591. doi:10.1007/s00122-019-03488-w.
Ling Y,Weilin Z. 2016. Genetic and biochemical mechanisms of rice resistance to planthopper[J]. Plant Cell Reports,35(8):1559-1572. doi:10.1007/s00299-016-1962-6.
Liu C X,Hao F H,Hu J,Zhang W L,Wan L L,Zhu L L,Tang H R,He G C. 2010. Revealing different systems responses to brown planthopper infestation for pest susceptible and resistant rice plants with the combined metabonomic and gene-expression analysis[J]. Journal of Proteome Research,9(12):6774-6785. doi:10.1021/pr100 970q.
Liu Q S,Hu X Y,Su S L,Ning Y S,Peng Y F,Ye G Y,Lou Y G,Turlings T C J,Li Y H. 2021. Cooperative herbivory between two important pests of rice[J]. Nature Communications,12(1):6772. doi:10.1038/s41467-021-270 21-0.
Lu J,Ju H P,Zhou G X,Zhu C S,Erb M,Wang X P,Wang P,Lou Y G. 2011. An EAR-motif-containing ERF transcription factor affects herbivore-induced signaling,defense and resistance in rice[J]. The Plant Journal,68(4):583-596. doi:10.1111/j.1365-313x.2011.04709.x.
Malenovsky I,Burckhardt D,Queiroz D L,Isaias R M S,Oliveira D C. 2015. Descriptions of two new Pseudophacopteron species(Hemiptera:Psylloidea:Phacopteronidae)inducing galls on Aspidosperma(Apocynaceae)in Brazil[J]. Acta Entomologica Musei Nationalis Pragae,55(2):513-538.
Peng L,Zhao Y,Wang H Y Zhang J J,Song C P,Shangguan X X,Zhu L L,He G C. 2016. Comparative metabolomics of the interaction between rice and the brown planthopper[J]. Metabolomics,12(8):1-15. doi:10.1007/s11306-016-1077-7.
Shi S J,Wang H Y,Nie L Y,Tan D,Zhou C,Zhang Q,Li Y,Du B,Guo J P,Huang J,Wu D,Zheng X H,Guan W,Shan J H,Zhu L L,Chen R Z,Xue L J,Walling L L,He G C. 2021. Bph30 confers resistance to brown planthopper by fortifying sclerenchyma in rice leaf sheaths[J]. Molecular Plant,14(10):1714-1732. doi:10.1016/j.molp. 2021.07.004.C3EF4567-7C12-48BB-84A9-C29F2CF52217
Tong X H,Qi J F,Zhu X D,Mao B Z,Zeng L J,Wang B H,Li Q,Zhou G X,Xu X J,Lou Y G,He Z H. 2012. The rice hydroperoxide lyase OsHPL3 functions in defense responses by modulating the oxylipin pathway[J]. The Plant Journal,71(5):763-775. doi:10.1111/j.1365-313x. 2012.05027.x.
Wang Y Y,Wang X L,Yuan H Y,Chen R Z,Zhu L L,He R F,He G C. 2008. Responses of two contrasting genotypes of rice to brown planthopper[J]. Molecular Plant-Microbe Interactions,21(1):122-132. doi:10.1094/mpmi-21-1-0122.
Xu J,Wang X J,Zu H Y,Zeng X,Baldwin I T,Lou Y G,Li R. 2021. Molecular dissection of rice phytohormone signaling involved in resistance to a piercing-sucking herbivore[J]. New Phytologist,230(4):1639-1652. doi:10. 1111/nph.17251.
Yuan H Y,Chen X P,Zhu L L,He G C. 2005. Identification of genes responsive to brown planthopper Nilaparvata lugens St?l (Homoptera: Delphacidae) feeding in rice[J]. Planta,221(1):105-112. doi:10.1007/s00425-004-1422-3.
Zhang F,Zhu L,He G C. 2004. Differential gene expression in response to brown planthopper feeding in rice[J]. Journal of Plant Physiology,161(1):53-62. doi:10.1078/0176-1617-01179.
Zhao Y,Huang J,Wang Z Z,Jing S L,Wang Y,Ouyang Y D,Cai B D,Xin X F,Liu X,Zhang C X,Pan Y F,Ma R,Li Q F,Jiang W H,Zeng Y,Shangguan X X,Wang H Y,Du B,Zhu L L,Xu X,Feng Y Q,He S Y,Chen R Z,Zhang Q F,He G C. 2016. Allelic diversity in an NLR gene BPH9 enables rice to combat planthopper variation[J]. Proceedings of the National Academy of Sciences,113(45):12850-12855. doi:10.1073/pnas.1614862113.
Zhou G X,Qi J F,Ren N,Cheng J A,Erb M,Mao B Z,Lou Y G. 2009. Silencing OsHI-LOX makes rice more susceptible to chewing herbivores,but enhances resistance to a phloem feeder[J]. The Plant Journal,60(4):638-648. doi:10.1111/j.1365-313x.2009.03988.x.
(責任编辑 麻小燕)C3EF4567-7C12-48BB-84A9-C29F2CF52217
