β-葡聚糖联合低交联透明质酸钠在机体内应用的再生评价
2022-06-15方明星吴伟东王瑛等
方明星 吴伟东 王瑛等
中图分类号:R622 文献标识码:A 文章编号:1004-4949(2022)02-0001-07
β-葡聚糖是一种天然的多糖类化合物,为水溶性或不溶性的颗粒,存在于细菌、真菌、植物等的细胞壁中[1,2]。研究发现[3-6],β-葡聚糖具有多种生物学活性,如抗炎、降血糖血脂以及抗肿瘤等,且其代谢产物能够调节胶原重组并刺激人Ⅰ型和Ⅲ型胶原再生等。β-葡聚糖注射进入皮肤组织后会激活朗氏细胞,且能与人成纤维细胞上特异性葡聚糖受体结合,被激活的朗氏细胞以及成纤维细胞能够分泌一些因子,如血管内皮生长因子、成纤维细胞生长因子、转化生长因子等的表达,这些因子能够促进成纤维细胞的增殖及皮肤基质(例如胶原蛋白、蛋白聚糖、弹性蛋白等)的合成[7-9],合成的成纤维细胞及胶原纤维等能够对葡聚糖形成包裹,形成Ⅰ型和Ⅲ型胶原,起到填充占位的效果。透明质酸钠是一种线性单链糖胺聚糖聚合物,由N-乙酰氨基葡萄糖和D-葡萄糖醛酸组成,其分子结构相对稳定,因此可在不冷藏的情况下储存长达2年[10,11]。此外,由于其极强的亲水性,可以为皮肤补充水份。研究表明[12],HA相对寡糖降解产物能够积极刺激内皮细胞的增殖和迁移,并在延迟血运重建模型中诱导血管生成,且通过交联的透明质酸钠具有较强的机械属性,能够在组织中维持更长的时间,进而达到促进组织再生的目的。透明质酸钠的粘弹性、生理活性和生物相容性使其成为药理学应用的理想材料,特别是在眼科和风湿病学方面。此外,基于透明质酸钠分子化学修饰产生的生物相容性和可降解的生物材料被广泛的应用于伤口覆盖、组织工程和医疗美容当中。但外源性的透明质酸在体内容易被透明质酸酶水解,且降解速度快,难以维持持久的效果[13]。因此,本研究主要探讨β-葡聚糖联合低交联透明质酸钠在机体内的安全性以及对新生血管及胶原生成的影响,现报道如下。
1.1实验主要材料 注射材料主要包括β-葡聚糖(上海源叶,S24487);注射用低交联透明质酸钠凝胶(广州小蛮腰医疗器械有限公司,国械注准20153130014,规格:1.0ml/支×30g注射针2只)。β-葡聚糖和低交联透明质酸钠配置方法:将3mlβ-葡聚糖溶液与1ml低交联透明质酸钠凝胶在室温下充分的混合至质地均匀。
1.2实验试剂的分组及配置 具体试剂组合及各组试剂成分见表1。

1.3实验动物分组及处理方法 选用周龄在6周,体重(200±20)g的SPF级Wistar大鼠30只。将大鼠分笼饲养,饲养条件为室温(25±2)℃,相对湿度(50±5)%,12h明暗交替,自由摄食、饮水。将Wistar大鼠按照实验组合①~⑤分为低交联透明质酸钠组、交联透明质酸钠(大分子)组、β-葡聚糖组、β-葡聚糖+低交联透明质酸钠组、交联透明质酸钠(大分子)+低交联透明质酸钠组,每组6只。选取脊柱旁两侧1.5~2cm皮下组织为注射中心点,利用针头刺入表皮至皮下组织层(深度约4mm),回抽无血液后进行注射,每个部位注射材料剂量为1ml。以注射点为中心对周围约1.5cm的范围进行标注。各组大鼠注射材料后分别饲养7、14、28d,然后采用脊髓脱臼法处死各组的大鼠。剔除大鼠背部毛发,对马克笔标注的注射区域用手术刀切开皮肤全层,取下组织样本,先用相机拍照,记录整体形态。切取包括植入材料在内的皮下组织,置于体积分数10%甲醛溶液中,固定48h后常规脱水、透明、浸润、包埋、常规切片、切片厚度为3μm。本研究符合动物伦理要求,且经医院伦理委员会审批通过。
1.4观察指标 比较各组苏木素-伊红染色(HE)结果、胶原纤维含量面积百分比、HE染色切片中毛细血管及小血管数量。
1.4.1HE结果 在第7、14及28天处死大鼠,取植入材料在内皮下组织制成病理切片,在光镜下观察各组大鼠皮下组织结构、细胞浸润情况、胶原纤维增生程度及新血管的生成情况等变化。
1.4.2胶原纤维含量面积百分比 参照相关文献[14],将制作好的病理切片用Canon450D数码相机进行拍照,将图片导入计算机Photoshop软件(版本:AdobePhotoshopCS4)测量出整张图片的面积测量值,然后用魔术棒功能选中胶原纤维区域再次进行测量记录,分别测量切片中胶原纤维的面积测量值,计算胶原纤维含量百分比。胶原纤维含量百分比=胶原纤维面积测量值/整个图片面积测量值×100%。
1.4.3HE染色切片中毛细血管及小血管数量 取注射部位皮下组织制作成HE染色切片,然后在显微镜下计数毛细血管密度,每个切片中取5个视野计数,然后取平均值作为毛细血管密度。
1.5统计学分析 采用SPSS 13.0软件进行分析。
计量资料以[n(%)]表示,组间比较分别采用H检验和SNK-q检验;计量资料以(x±s)表示,组间比较采用χ检验,以P<0.05表示差异有统计学意义。
2.1HE染色结果 低交联透明质酸钠组在第7天的HE染色切片中能够看到少量的纤维组织增生并伴有炎细胞浸润表现;第14和28天的HE染色切片中能够看到胶原纤维增生更加明显并伴有巨噬细胞、中性粒细胞等炎症细胞浸润;第28天的HE染色切片中毛线血管及小血管数量明显增多,见图1。交联透明质酸钠(大分子)组在第7天的HE染色切片中能够看到注射部位周围有胶原纤维及纤维组织增生,增生的胶原纤维及纤维组织内有较多的炎细胞浸润;第14及28天的HE染色切片中可见胶原纤维及纤维组织增生明显,增生的胶原纤维及纤维组织内伴有新生毛线血管及较多炎细胞浸润,炎性细胞包括中性粒细胞、巨噬细胞等,见图2。β-葡聚糖组在第7天HE染色切片中可以看到注射部位有胶原纤维及纤维组织增生,增生的胶原纤维排列紧密期间伴有少量炎细胞浸润,并且可以见到有少量新生毛细;第14及28天的HE染色切片中仍可见到胶原纤维及纤维组织增生,但排列更加疏松并且伴有脂肪细胞浸润,见图3。β-葡聚糖+低交联透明质酸组在第7天的HE染色切片中见注射部位周围胶原纤维及纤维组织增生伴炎细胞浸润,例如中性粒细胞、巨噬细胞等,增生的胶原纤维及纤维组织与周围组织排列紧密;第14及28天的HE染色切片中可见胶原纤维及纤维组织增生更加显著并且伴有毛细血管新生,增生的胶原纤维及纤维组织排列整齐,对注射部位的材料形成包裹,组织炎症细胞浸润较少,见图4。交联透明质酸钠(大分子)+低交联透明质酸钠组在第7天的HE染色切片中见胶原纤维围绕注射部位材料周围及中间增生;第14天HE染色切片中可见胶原纤维及纤维组织增生较第7天明顯并且对注射部位形成包饶,增生的胶原纤维及纤维组织密度不均并伴有新生的毛细血管及微小血管,炎细胞浸润明显;第28天HE染色切片可见这种增生更加明显并且密度不均匀、排列不整齐,见图5。
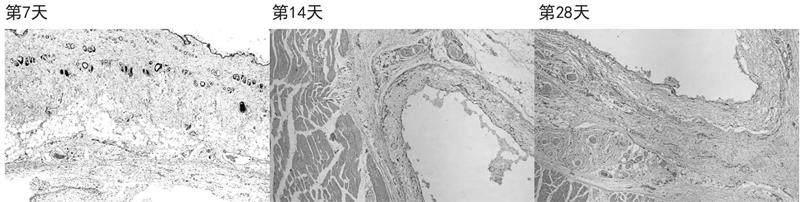
图1 低交联透明质酸钠组染色结果(HE×40)
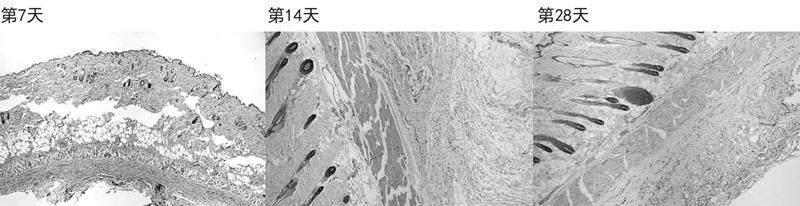
图2 交联透明质酸钠组染色结果(HE×40)

图3 β-葡聚糖组染色结果(HE×40)

图4 β-葡聚糖+低交联透明质酸钠组染色结果(HE×40)

图5 交联透明质酸钠+低交联透明质酸钠组染色结果(HE×40)
2.2各组大鼠胶原纤维含量面积比较 各组大鼠切片图像胶原纤维含量面积比较,差异有统计学意义(P<0.05),其中β-葡聚糖+低交联透明质酸钠组胶原纤维含量最高,其次是交联透明质酸钠+低交联透明质酸钠组,低交联透明质酸钠组、交联透明质酸钠组和β-葡聚糖组胶原纤维含量低于前两组,见表2。
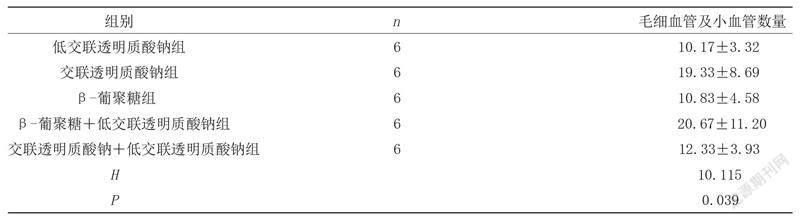
2.3各组大鼠HE染色切片中毛细血管及小血管数量比较 交联透明质酸钠组和β-葡聚糖+低交联透明质酸钠组的毛细血管及小血管数量高于低交联透明质酸钠组、β-葡聚糖组和交联透明质酸钠+低交联透明质酸钠组,差异有统计学意义(P<0.05);交联透明质酸钠组与β-葡聚糖+低交联透明质酸钠组的毛细血管及小血管数量比较,差异无统计学意义(P>0.05);低交联透明质酸钠组与β-葡聚糖组和交联透明质酸钠+低交联透明质酸钠组的毛细血管及小血管数量比较,差异无统计学意义(P>0.05),见表3。

透明质酸钠又可称为玻尿酸,因其含有大量的羟基和羧基,且能与水结合形成氢键,故具有很强的保水能力;能够吸进水分进入细胞间隙并且与体内的蛋白质结合形成蛋白凝胶,从而加快皮肤修复能力和伤口再生能力,目前已广泛应用于化妆品及组织工程中。但透明质酸钠易溶于水,且容易被透明质酸酶水解,在化妆品及组织工程等实际应用中难以维持持久的治疗效果,因此减缓其在体内的降解速度成为了研究重点。
近年来除了透明质酸钠外,具有修复功效的化妆品原料在也逐渐备受关注。继蛋白质、活性肽、氨基酸等修复成分之后,生物多糖成为了新的应用热点。葡聚糖就是一种典型的生物多糖,是以葡萄糖为单糖组成的的多糖且葡萄糖单元之间以糖苷键相连接,根据其糖苷键的类型可分为α-葡聚糖和β-葡聚糖。α-葡聚糖主要为机体供能而不具备生物活性功能,β-葡聚糖具有多种生物学功能,例如保湿、抗炎、抗过敏、降血糖、降血脂、增强免疫力等[15]。随着临床对葡聚糖不断深入的研究[16],发现β-葡聚糖还能够通过激活巨噬细胞产生表皮生长因子及胶原蛋白和血管生长因子,从而加速加速新血管测生成和皮肤再生能力。β-葡聚糖不仅能够增加巨噬细胞吞噬作用和增殖活性[17-19],而且能够增加巨噬细胞在创伤区域的渗入、胶原沉积并且能够增强伤口的抗牵拉强度[20]。另有研究表明[21-24],β-葡聚糖能够刺激血管内皮生长因子、成纤维细胞生长因子、转化生长因子等的表达。而血管内皮生长因子在调节内皮细胞迁移、存活、增殖、分化及新血管生成中起关键作用[25-27]。尽管β-葡聚糖有诸多优点,但β-葡聚糖在体内通常难以降解并且降解时间较长,但有研究发现[28-30],β-葡聚糖与透明质酸钠反应后不仅能够克服β-葡聚糖难以降解的缺点,还能够克服透明質酸钠极易水解的缺点,联合使用后能够集两者的生物活性为一体同时克服自身单独使用的缺点。
本研究以不同分子量的透明质酸钠和β-葡聚糖为实验试剂,通过不同的组合方式来评价β-葡聚糖和(或)透明质酸钠在体内应用的再生能力,结果发现注射β-葡聚糖+低交联透明质酸钠的实验方式相较于其他注射部位有更多的新生血管生成,镜下胶原纤维密度更高,考虑与β-葡聚糖能够增加巨噬细胞吞噬作用和增殖活性以及各种因子表达有关,从而促进胶原纤维在局部的沉积及新血管的生成。交联透明质酸钠组的胶原纤维增生及新生的毛细血管及小血管数量接近于β-葡聚糖+低交联透明质酸钠组,考虑到与交联透明质酸钠分子结构更加稳定,在体内分解速度更慢,维持时间长有关,能够在体内维持长时间的再生效果。当交联透明质酸钠与低交联透明质酸钠二者联合应用时,与β-葡聚糖+低交联透明质酸钠在体内的胶原纤维再生能力无明显差异,交联透明质酸钠能够在一定程度上弥补低交联透明质酸钠在体内被透明质酸酶分解过快的缺点,这一特性与β-葡聚糖类似,因此两种组合在体内再生能力也无明显差异。交联透明质酸钠+低交联透明质酸钠与β-葡聚糖+低交联透明质酸钠两种组合在体内再生效果虽然类似,但是在组织切片中交联透明质酸钠+低交联透明质酸注射材料周围炎性细胞浸润更为明显,表明β-葡聚糖+低交联透明质酸钠在体内应用时的组织相容性优于交联透明质酸钠+低交联透明质酸钠。低交联透明质酸钠、β-葡聚糖二者单独应用在体内再生效果类似,当二者联合应用时体内再生能力优于二者单独应用。本实验证明了β-葡聚糖联合透明质酸钠皮下注射在体内胶原纤维及毛细血管再生能力对比其他组合较强。在本实验中注射β-葡聚糖+低交联透明质酸钠的部位未见明显的炎性包裹,提示β-葡聚糖与低交联透明质酸能够二者互补并且克服自身单独应用的缺点。
综上所述,β-葡聚糖联合低交联透明质酸钠皮下注射具有良好的组织相容性,对新生血管生成及新生胶原具有明显且较安全的作用。但目前关于β-葡聚糖联合透明质酸钠的作用机制和理化性质认识较为有限,且二者联合应用的副作用研究甚少,如何制备出安全且而高效能的组合配方仍需进一步研究。另外,本实验并未对β-葡聚糖联合透明质酸钠最佳配比进行研究,且考虑到β-葡聚糖和交联透明质酸钠二者本身在体内代谢时间长的问题,并未对着两种试剂进行组合。在后续的研究中,还需进一步研究β-葡聚糖与透明质酸钠最优配比及不同配比在体内的再生评价。
