枸杞多糖的提取及其体外抗氧化活性
2022-06-14刘鹏李达纪海玉贾晓昱田凌
刘鹏,李达,纪海玉,贾晓昱,田凌
(1.天津现代职业技术学院生物工程学院,天津 300451;2.天津科技大学食品科学与工程学院,天津 300457;3.天津市农业科学院农产品保鲜与加工技术研究所,天津 300384;4.唐山市盛川农产品股份有限公司,河北 唐山 064105)
枸杞(Fructus Lycii)是我国传统的名贵中药材和重要经济作物,其营养丰富品种繁多,许多以枸杞子为基础材料的产品已被陆续开发出来,如枸杞酒、枸杞多糖、枸杞粉、枸杞浓缩原汁等[1]。枸杞多糖(Fructus Lycii polysaccharide,FLP)是一种具有水溶性的多糖成分,且是枸杞中重要的功能性成分。目前已有研究对枸杞中的多糖进行分离和纯化[2-3],并对其在调节机体免疫功能、增强记忆力、抗肿瘤、抗癌、降血脂等方面的作用进行测定[4-6]。然而,针对枸杞多糖的抗氧化功能,从体外组织水平,综合验证其对机体重要组织的抗氧化能力的研究较少,不利于其功能性食品的综合开发。因此,本文在对FLP进行分离以及纯化的基础上,确定了其单糖成分,并研究了其粗提物和纯化品的体外抗氧化活性,从而为枸杞多糖功能性食品的开发提供依据。
1 材料与方法
1.1 材料与试剂
枸杞:市售;鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖、葡萄糖单糖标准品(均为色谱纯):上海源叶生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒,丙二醛(malondialdehyde,MDA)检测生化试剂盒:南京建成生物工程研究所;吩嗪硫酸甲酯(分析纯)、2,2-联苯基-1-苦基肼基(2,2-Diphenyl-1-picrylhydrazyl,DPPH,分析纯):上海阿拉丁生化科技股份有限公司;硫代巴比妥酸(分析纯):中国医药(集团)上海化学试剂公司;抗坏血酸(分析纯):天津大茂化学试剂厂。
ICR小白鼠[清洁级,10~12周龄,雌性小鼠,体重(28±2)g]:北京维通利华试验动物技术有限公司。
1.2 仪器与设备
高效液相气相色谱仪(GC-2010 Pro):日本岛津公司;高速冷冻离心机(5804r):德国艾本德股份公司;紫外分光光度计(T6新世纪):北京普析通用仪器有限公司。
1.3 方法
1.3.1 枸杞多糖(FLP)的制备
1.3.1.1 枸杞粗多糖的提取
根据刘锐等[7]的方法,枸杞于烘箱中55℃干燥12h后,打浆机粉碎,定量称取枸杞干粉 20 g,按 1∶5(g/mL)比例加入蒸馏水,在90℃下提取4 h,离心后收集上清液,将收集到的上清液再进行抽滤后弃去残渣。真空浓缩至50 mL后加入无水乙醇180 mL,沉淀14 h后抽滤,滤渣回流浸提1 h,取沉淀,再重复浸提,直到沉淀变为白色,得到粗多糖样品。
1.3.1.2 糖蛋白脱除
依据缪风等[3]的方法将粗多糖用蒸馏水复溶,Sevage法脱蛋白。
1.3.1.3 多糖的纯化分级
根据Kumaran等[8]的方法,采用DEAE-cellulose-32(φ25 mm×450 mm)预处理后色谱柱层析对枸杞多糖进行纯化分离,取1.00 g脱蛋白多糖,溶于100 mL蒸馏水中,完全溶解后上柱吸附,以梯度洗脱法洗脱各级分,洗脱液分别为超纯水、0.05、0.10、0.25 mol/L NaCl,流速控制为12滴/min,用自动部分收集器收集洗脱液,每5 min 1管,每管3 mL,共收集150管,将收集到的样品溶液分别在280 nm波长下比色,并通过苯酚-硫酸法测定多糖,以洗脱管数以及测定的吸光度分别为横纵坐标可得出梯度洗脱曲线,色谱柱将枸杞多糖洗脱为4个组分,得到枸杞多糖纯化品FLP1~4。
1.3.2 测定FLP各组分的单糖组成
参考Altintas等[9]方法,精密称取5 mg纯化品多糖于安瓿瓶中,加入5mL的硫酸(2mol/L),充入氮气,安瓿瓶封口后,置于100℃恒温电烘箱中水解8 h。室温冷却后,加入研磨好的BaCO3粉末至中性,于4 000 r/min离心15 min,收集上清液,减压蒸干水解产物。量取5 mg单糖混合标准品和水解后的多糖样品溶液置于离心管中,加入5mg盐酸羟胺和0.5mL吡啶,于95℃水浴30 min后,加0.5 mL醋酸酐再于95℃水浴30 min,冷却后,减压蒸干,加1 mL蒸馏水溶解,用1 mL氯仿萃取,重复3次,合并氯仿层,蒸干,最后加0.5 mL氯仿溶解,过0.45 μm微孔滤膜后,备用。HP-5毛细管色谱柱(30 m×0.32 mm×0.25 μm),高纯氮为载气,分压80 kPa;氢火焰离子化检测器,温度250℃;进样口温度250℃。升温程序:初温150℃,保留1 min,以10℃/min升温至200℃,保留10 min,继续以5℃/min升温至220℃,保留5 min,最后以1.5℃/min升温至终温240℃,并保留20 min。
1.3.3 DPPH自由基清除率的测定
参考孙玉姣等[10]的方法,分别量取不同质量浓度的枸杞多糖粗制品和纯化品1 mL,随后再分别放进0.004%DPPH配制的甲醇溶液3 mL,摇匀,遮光搁置20 min,选用甲醇液为空白比对液,在517 nm处检测吸光度值,选用蒸馏水为阴性比对液,选用VC溶液为阳性比对液。
1.3.4 超氧阴离子自由基(O2-·)清除率的测定
参考张凤培等[11]的方法,对照组用不相同质量分数的枸杞多糖粗制品和纯化品1 mL,吩嗪硫酸甲酯溶液则被0.4 mL蒸馏水代替作为空白,选蒸馏水为阴性对比,VC溶液为阳性对比。
1.3.5 羟自由基(·OH)清除作用的测定
参考Yang等[12]方法,分别量取不同浓度的枸杞多糖粗制品和纯化品1 mL,再按次序滴进1.5 mL反应液 [含0.1 mmol/L乙二胺四乙酸、0.1 mmol/L FeCl3和2.8 mmol/L氯化钠的磷酸盐缓冲液(pH7.4)]和0.35 mL H2O2(20 mmol/L),在37℃水浴下反应40 min后停止,在532 nm处检测吸光度值,选用蒸馏水为阴性对比,VC为阳性对比。
1.3.6 FLP对机体重要组织抗氧化能力的影响
10%组织匀浆液制备:ICR小白鼠颈椎脱臼处死,解剖获得小鼠肝脏组织、脑组织和心脏组织,预冷生理盐水冲洗,滤纸吸干,称重。制备10%组织匀浆液。SOD活力和MDA含量依照试剂盒说明书测定。
2 结果与分析
2.1 DEAE-cellulose-32色谱柱对枸杞多糖的分离效果
用色谱柱对枸杞多糖进行洗脱,洗脱效果如图1所示。
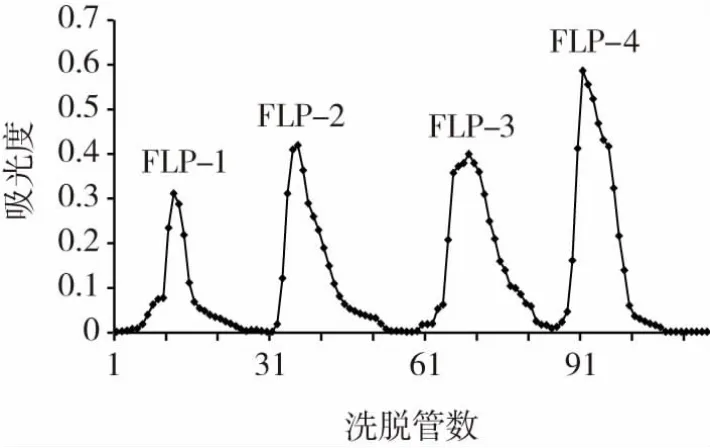
图1 FLP在DEAE-cellulose-32色谱柱上的洗脱曲线Fig.1 Elution curve of FLP on DEAE-cellulose-32 column
由图1可知,色谱柱将枸杞多糖洗脱为4个组分,分别表示为FLP1~FLP4。
2.2 FLP各组分单糖成分分析
气相色谱法对4组多糖的单糖组成的分析结果见图2。
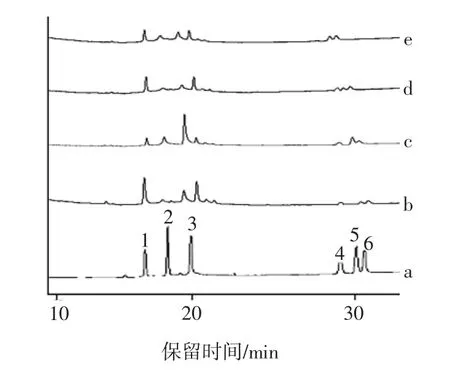
图2 FLP及其各组分气相色谱Fig.2 Gas chromatograms of FLP and FLP components
由试验可知枸杞多糖中含有鼠李糖、阿拉伯糖、葡萄糖、半乳糖、木糖和甘露糖,与文献中研究的枸杞类多糖的单糖组成一致[13-16],纯化后各组分的糖含量发生了变化。其中,FLP-2中木糖及半乳糖含量较多。与FLP-2相比,FLP-3、FLP-4中木糖含量依次减少,其余单糖含量未呈现规律性变化。
2.3 枸杞多糖清除DPPH·的能力
以VC对DPPH·的清除率作为对比,测定枸杞多糖粗制品以及纯化品对DPPH·的清除效果,结果如图3所示。
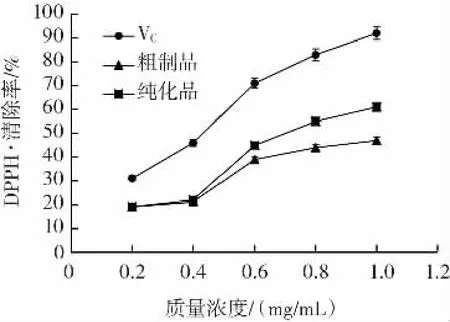
图3 FLP对DPPH·的清除率Fig.3 DPPH free radical scavenging rate of FLP
DPPH·的独对电子在517 nm附近有强吸收峰,并且由于其性质非常稳定常被用来作为测试底物,对其清除率的测定能够评价自由基清除剂的抗氧化活性[17]。结果表明,随着多糖质量浓度的增加,其抗氧化活性逐渐增强,且纯化品对DPPH·的抑制作用强于粗制品。
2.4 枸杞多糖清除O2-·的能力
以VC对O2-·的清除率作为对比,测定枸杞多糖粗制品以及纯化品对O2-·的清除效果,结果如图4所示。
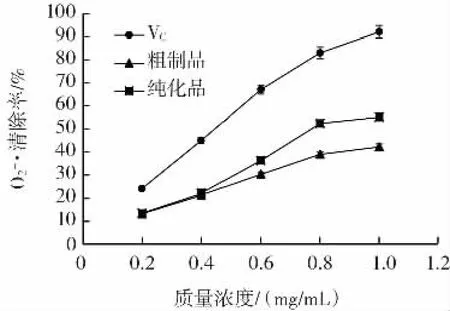
图4 FLP对超氧阴离子自由基清除率Fig.4 Superoxide anion free radical scavenging rate of FLP
对O2-·的清除能力,是衡量活性物质抗氧化能力的重要指标。O2-·在机体内可以形成氧化性较强且能裂解为单线态氧自由基或羟基自由基,使DNA的单股链开裂,从而对生物体形成损害[18]。枸杞多糖具有一定的清除O2-·的能力,且具有一定的质量浓度依赖性,并且,纯化品的O2-·清除能力优于粗制品。
2.5 枸杞多糖清除·OH的能力
以VC对·OH的清除率作为对比,测定枸杞多糖粗制品以及纯化品对·OH的清除效果,结果如图5所示。
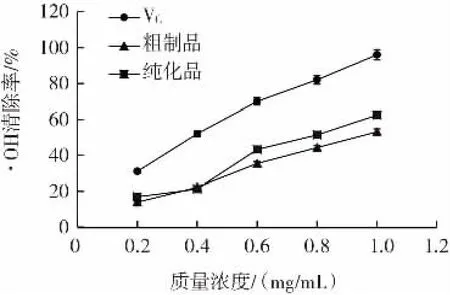
图5 FLP对羟自由基清除率Fig.5 Hydroxyl free radical scavenging rate of FLP
羟自由基是机体内较为活泼的自由基,其清除率对于评价活性物质的抗氧化活性具有重要的意义,结果表明,随着质量浓度的增加,枸杞多糖抑制·OH的效果逐渐增强,且纯化品的清除作用优于粗制品,当质量分数是1.0 mg/mL时,纯化品的·OH清除率明显高于粗制品。
2.6 FLP对机体重要组织抗氧化能力的影响
机体的心脏、脑及肝脏是重要的功能性器官,在衰老过程中,这些组织的抗氧化能力体现了衰老的进程和程度[19-21]。因此,在体外组织水平的试验研究中,主要关注这些组织在枸杞多糖和VC存在环境下,其SOD的活力以及指征非酶系抗氧化能力的脂质过氧化程度的MDA含量。
2.6.1 FLP在体外对小鼠心脏、脑、肝脏组织SOD活力的影响
以VC作为对比,测定枸杞多糖纯化品对小鼠心脏组织SOD活力的影响,结果如图6所示。
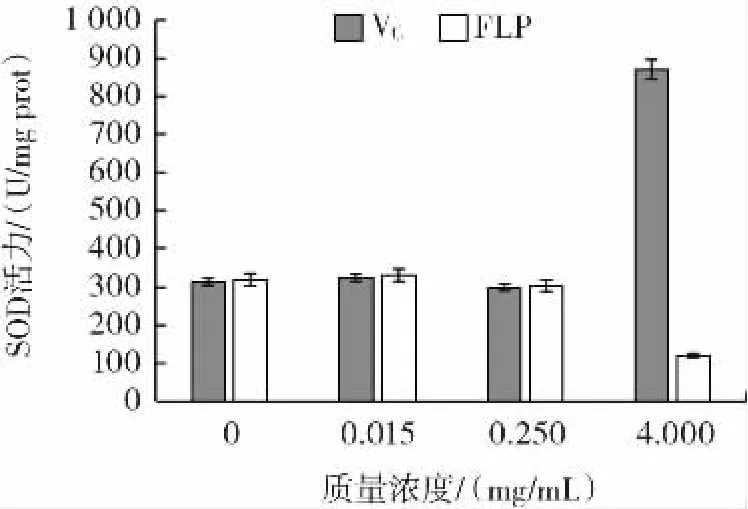
图6 FLP在体外对小鼠心脏组织中SOD活力的影响Fig.6 The effect of FLP on SOD activity in mouse heart tissue in vitro
SOD是机体内抗氧化酶类中的代表之一,其酶活力的高低对衡量活性物质的抗氧化能力具有重要的意义。由图6显示的试验结果可知,VC在较高浓度水平下可以提高小鼠心脏组织SOD活力,而随FLP浓度升高,小鼠心脏组织中SOD的活力呈现先升高后降低趋势。该结果显示低浓度的FLP与小鼠心脏组织中SOD活力没有明显的对应关系,并且当浓度升高为4.000 mg/mL,SOD活力反而有所下降。
SOD在脑抗氧化酶系统中有着重要的作用,FLP对小鼠脑组织中SOD活力的影响如图7所示。
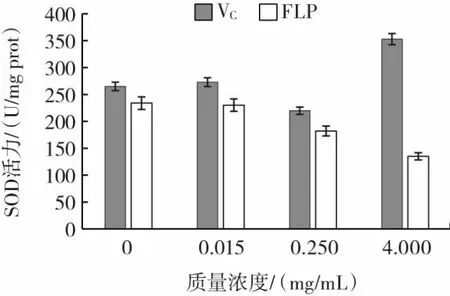
图7 FLP在体外对小鼠脑组织中SOD活力的影响Fig.7 The effect of FLP on SOD activity in mouse brain tissue in vitro
图7结果表明,VC对小鼠脑组织中SOD的活力有促进作用,并且在浓度为4.000 mg/mL时达到最大。而在FLP样品液浓度较高(4.000 mg/mL)时,脑组织中SOD活力降低。
SOD在肝脏的抗氧化酶系统中重要的组分,FLP对小鼠肝脏组织中SOD活力的影响如图8所示。

图8 FLP在体外对小鼠肝脏组织中SOD活力的影响Fig.8 The effect of FLP on SOD activity in mouse liver tissue in vitro
结果表明,在FLP样品液浓度较高(4.000 mg/mL)时,肝脏组织中SOD活力降低,并有随FLP样品液浓度升高,SOD活力降低的变化趋势。
综合体外组织水平的试验研究结果,随着样液浓度升高,SOD活力呈现不同变化趋势,FLP在心脏、脑和肝脏组织匀浆中的SOD的活力均呈现出伴随FLP样品液浓度升高而降低的趋势。
2.6.2 FLP在体外对小鼠心脏、脑、肝脏组织脂质过氧化反应的影响
丙二醛(MDA)含量能够有效地反映小鼠心脏、脑、肝脏组织脂质过氧化的程度,以VC作为对比,考察了枸杞多糖纯化品对小鼠心脏、脑和肝脏组织MDA含量的影响,结果如图9~图11所示。
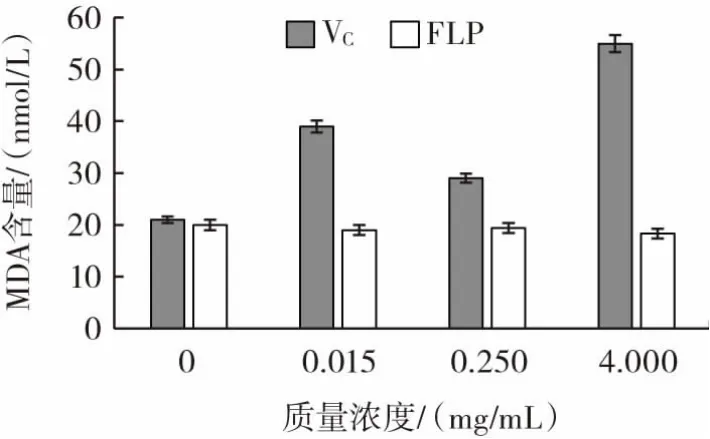
图9 FLP在体外对小鼠心脏组织中MDA含量的影响Fig.9 The effect of FLP on the MDA content in mouse heart tissue in vitro

图10 FLP在体外对小鼠脑组织中MDA含量的影响Fig.10 The effect of FLP on the MDA content in mouse brain tissue in vitro
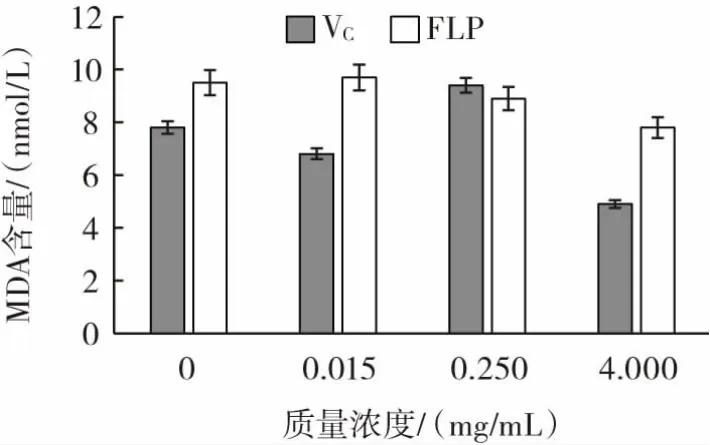
图11 FLP在体外对小鼠肝组织中MDA含量的影响Fig.11 The effect of FLP on the MDA content in mouse liver tissue in vitro
FLP对小鼠心脏组织的脂质过氧化反应影响不大,对脑组织的脂质过氧化产物丙二醛生成有抑制作用。对于肝组织的脂质过氧化反应具有一定抑制效果,并在试验浓度范围内呈现剂效关系。
通过上述对于小鼠心脏、脑、肝脏体外组织和细胞水平的抗氧化试验研究发现,FLP能够降低MDA的质量浓度,不能增强SOD活力,但却能在一定程度上抑制发生在细胞和组织水平的脂质过氧化,具有一定的抗氧化作用。
3 结论
本文对枸杞多糖进行分离纯化,制得其粗制品和纯化品,测定了纯化品的单糖组成,检验了其对DPPH·、O2-·和·OH的清除能力并利用小鼠心脏、脑和肝脏组织进行了体外抗氧化活性试验。研究表明,FLP的纯化品的抗氧化能力明显优于粗制品,且其对DPPH·、O2-·和·OH等自由基的清除能力呈剂量依赖型变化。在体外抗氧化试验中,FLP能够降低MDA含量,抑制发生在细胞和组织水平的脂质过氧化,具有抗氧化作用。与VC的对照试验表明,枸杞多糖虽然是一种有效的抗氧化剂,但其抗氧化性弱于VC。
