秘鲁鱿鱼肌动蛋白的分离纯化及结构初探
2022-06-14牛付阁胡得妹张秀真杜艺轩潘伟春
牛付阁,胡得妹,张秀真,杜艺轩,张 斌,马 爽,潘伟春
(浙江工商大学食品与生物工程学院 杭州 310018)
秘鲁鱿鱼产量丰富,物美价廉,特别是营养价值高。含有8 种人体必需氨基酸,且鱼肉中的微量元素具有高钾低钠的特点,这些特点足以让人们把目光聚焦在鱿鱼上,鱿鱼也因此成为销量逐年上升的海产品[1]。目前,鱿鱼的主要加工方式是制作成鱼糜,对鱼糜原材料的要求主要是凝胶性能好,然而受到所含蛋白溶解度高、凝胶性能差、有特定的异味(酸、涩)等的限制[2],鱿鱼在食品加工中的应用并不充分,利用价值低,导致资源的浪费。
蛋白质是一类复杂多变的生物大分子,其结构和性能密切相关。建立蛋白结构与蛋白凝胶特性间的联系,利用各种物理和化学手段调控蛋白的结构以优化其凝胶性能,是目前食品加工过程中常用的技术策略,如利用多糖与蛋白之间的互作形成多糖-蛋白凝胶[3],加入凝胶强化剂[4],改变其外界环境条件[5]等。肌原纤维蛋白是秘鲁鱿鱼蛋白形成凝胶过程中的主要作用成分,它由肌动蛋白(AC)、原肌球蛋白(TM)及副肌球蛋白(PM)等单质蛋白组成[6]。为生产出大众所接受和喜爱的产品,需进一步研究肌原纤维蛋白的结构与性能[7]。由于肌原纤维蛋白含多组分蛋白,且蛋白间存在强相互作用,这些作用力不仅会影响蛋白质整个失活过程,对调节不同分子间的交联过程也起到一定的作用[8]。因为这些表征参数大多取决于肌原纤维蛋白的组成成分,所以整体表征肌原纤维蛋白几乎是不可能的。肌原纤维蛋白组成的细微变化,可能引起这些理化指标的巨大差异,导致食品实际生产过程中经验远比理论模型更常用。理论系:Bottom-up 方法是目前解决这类问题很常见的科研策略。获取高纯度的单个组分是这一策略能否实施的关键。然而,秘鲁鱿鱼肌原纤维蛋白溶液中的蛋白纳米颗粒(Nano protein particle)的存在[9]揭示各组分间存在强相互作用,是分离纯化该体系的主要障碍。同时多组分的存在导致各组分在溶液中的浓度很低,进一步增大了体系分离纯化的难度;此外,分离纯化前目标蛋白质分子自身的折叠会影响分离纯化的pH 值、温度和压力等条件。因此常用的条件为室温或低温、常压以及pH 值接近等电点。这些制约条件使实验者不得不采用特殊的分离纯化仪器(蛋白纯化系统)和单元操作(色谱分离纯化技术)。同时,为达到分离纯化蛋白的目的,研究者需优化分离程序,包括色谱柱的选型,不同色谱柱的排序,色谱柱的操作条件。
目前,对肌原纤维蛋白的研究主要集中在外界环境条件,如pH 值、压强和温度等对其凝胶性能的影响,如林伟伟等[10]研究pH 值和KCl 对肌原纤维蛋白的影响;廖慧琦等[11]研究NaCl 不同添加量对大黄鱼肌原纤维蛋白凝胶性能的影响;韩柯颖等[12]通过控制微波功率和时间,研究温度对鸡胸肉肌原纤维蛋白凝胶性能的影响;李钊等[13]研究超高压对肌原纤维蛋白凝胶性能的影响。然而,目前尚未见从秘鲁鱿鱼中分离纯化出单体蛋白的报道。蛋白质结构复杂,为全面了解其结构和性能之间的关系,本研究通过阴离子交换层析和凝胶过滤层析联用的技术,从多组分且存在强相互作用的蛋白体系中分离纯化出较高纯度的单质蛋白,为食品蛋白构效关系的研究提供更精准的模型。
1 材料与方法
1.1 试验材料
秘鲁鱿鱼(4.5±1.5)kg,舟山第二海洋渔业公司;曲拉通-X10、Tris,美国Amrosco 公司;30%丙烯酰胺/甲叉双丙烯酰胺预混液(质量比29∶1)、十二烷基硫酸钠(SDS)、二硫苏糖醇(DTT)、过硫酸铵(APS)、四甲基乙二胺(TEMED),美国BIORAD 公司;即用型蛋白质分子质量标准Marker(6.5~200 ku),杭州宝诚生物技术有限公司;酸氢二钠、磷酸二氢钾、氯化钾、氢氧化钠、乙醇等分析纯级试剂均来自于杭州捷诚生物科技有限公司。
1.2 试剂制备
1.2.1 磷酸盐缓冲液 pH 7.5,10 mmol/L EDTA,3.5 mmol/L KH2PO4,15.6 mmol/L Na2HPO4。
1.2.2 上样缓冲液 2 mL 的Tris-HCl 0.5 mol/L,(pH 6.8)+4 mL 10% SDS+2 mL 甘油+0.05 mL 1% 溴酚蓝,超纯水定容至10 mL,4 ℃保存。试验前加入200 mmol/L DTT(v上样缓冲液∶mDTT=1∶0.03)。
1.2.3 脱色液 40%无水乙醇+10%冰醋酸+50%去离子水。
1.2.4 缓冲液 缓冲液A:含0.1 mol/L KCl 的磷酸盐缓冲溶液;缓冲液B:含0.15 mol/L KCl的磷酸盐缓冲溶液。
1.2.5 考马斯亮蓝染液 100 mg 考马斯亮蓝G-250+50 mL 90%的乙醇+100 mL 80%的磷酸,超纯水稀释至1 L。
1.3 试验仪器与设备
变性梯度凝胶电泳仪、GS800 高分辨光密度扫描仪,美国BIO-RAD 公司;HPLC-1260KW-804 液相色谱仪,美国Agilent 公司;Millipore-Q超纯水仪,美国MILLIPORE 有限公司;AKTA 蛋白纯化仪,美国GE 公司;ALVCGS-3 广角光散射仪,德国ALV 公司。
1.4 试验方法
1.4.1 肌原纤维蛋白的提取 参考Hashimoto等[14]的方法,称取25 g 秘鲁鱿鱼胴体肉(去除鱼皮、骨头、内脏、眼球、尾巴等),加入200 mL 磷酸盐缓冲液和50 mL 1%曲拉通(Triton),用IKA 组织匀浆机匀浆(1 000 r/min),整个匀浆过程在冰浴上进行,每匀浆30 s 停30 s,重复5 次,最后一次得到的匀浆液用2 层纱布过滤得到滤液,离心(冷冻离心机,8 000×g,10 min,4 ℃),沉淀用10 倍体积的缓冲液B 漂洗,离心,将以上过程重复进行3次,最后所得沉淀即为肌原纤维蛋白。
1.4.2 肌原纤维蛋白溶液的制备 磷酸盐缓冲液先抽滤(0.22 μm 滤膜)再超声30 min。将上述肌原纤维蛋白沉淀在4 ℃下按一定的质量比充分溶解在磷酸盐缓冲液中后离心,取上清液过0.45 μm滤膜即为目标溶液。
1.4.3 考马斯亮蓝G-250 染色法测定蛋白浓度采用Brodford 法对肌原纤维蛋白进行定量,以牛血清蛋白(BSA)为标准蛋白。配置浓度梯度的牛血清蛋白溶液1 mL,加入考马斯亮蓝染色液5 mL,充分混匀反应5 min,用紫外分光光度计测定溶液在波长595 nm 处的吸光值,绘制标准曲线。根据标准曲线计算出肌原纤维蛋白的浓度。
1.4.4 秘鲁鱿鱼肌原纤维蛋白分离纯化 将提取得到的肌原纤维蛋白溶液过HiTrap Q FF 16 离子交换层析,用含0.15~1 mol/L KCl 的磷酸盐缓冲溶液进行梯度洗脱,洗脱流速为3 mL/min,收集各峰洗脱液超滤浓缩脱盐,然后过SurperdexTM 200 10/300 凝胶层析,用1 mol/L KCl 的磷酸盐缓冲溶液进行洗脱,洗脱流速为0.5 mL/min,收集各峰洗脱液超滤浓缩脱盐,进行纯度鉴定[7]。
1.4.5 蛋白的SDS-PAGE 分析
1.4.5.1 梯度胶的制备 按配方配制6%~18%的梯度胶,然后用BioRad 梯度胶灌胶器进行灌胶,制成蛋白变性单向电泳所用的梯度胶。
1.4.5.2 制样 用提取液及盐溶液将蛋白溶液稀释至适合的倍数(3~5 mg/mL),然后按体积比1∶1加入上样缓冲液,于沸水中煮沸3~5 min。
1.4.5.3 上样 将10 μL 蛋白Marker 及煮沸过的样品依次加入胶孔。
1.4.5.4 电泳 凝胶板通电电泳,30 min 后将电压由70 V 调到110 V,当溴酚蓝移动到离胶板下沿约1 cm 时,停止电泳。
1.4.5.5 染色 取出凝胶放在考马斯亮蓝G-250染色液中染色2 h 以上,过程中保护胶面不被污染。
1.4.5.6 脱色 将染好的凝胶放入脱色液中脱色至蛋白条带清晰。
1.4.5.7 胶图像扫描和分析 用GS-800 光密度扫描仪对染色后的凝胶进行扫描(光学分辨率为300 DPx,像素标准为8 bits)。为保证重复性,对每个样品的蛋白质电泳重复3 次。
1.4.6 HiTrap Q FF 16 离子交换层析 在温度为4 ℃的冰箱中,将提取得到得肌原纤维蛋白按照质量比1∶3 溶解在缓冲液A 中,充分溶解过夜后离心10 min (5 000×g,4 ℃),取上清液过0.45 μm 的微孔滤膜;上样量5 mL,起始缓冲液为缓冲液A,洗脱缓冲液为缓冲液B,速度为2 mL/min,洗脱梯度为30%,50%和100%。
1.4.7 SurperdexTM 200 10/300 凝胶层析柱分离纯化 将离子交换层析得到的蛋白组分峰用Millipore 超滤管 (微孔超滤管) 浓缩脱盐,再用SurperdexTM 200 10/300 凝胶层析柱分离纯化,上样量500 μL,洗脱液用缓冲液A,洗脱流速为0.5 mL/min,用分步收集器收集,每管0.5 mL。
1.4.8 HPLC 测定蛋白的纯度 利用高效液相色谱仪自带的KW-804 凝胶蛋白柱(排阻极限为106Pa)分离纯化,所需的流动相为缓冲溶液A,在室温下以0.5 mL/min 的速度进行分离,在波长280 nm 处检测蛋白含量。
1.4.9 MALDI-TOF 蛋白的鉴定 收集经凝胶电泳分离得到的单一条带,重新溶解提取蛋白质,然后利用MALDI-TOF/MS 对分离得到的蛋白质进行鉴定,并将获得的信息与数据库进行比对。
1.4.10 动态光散射粒径分析 利用激光光散射仪对纯化得到的蛋白质粒径进行表征,测量参数为(波长628 nm,角度90°,温度25 ℃),每次累积30 s,平行测量3 次。
2 结果与分析
2.1 离子交换层析分离蛋白的结果分析
如图1所示,经过离子交换层析分离后,肌原纤维蛋白溶液中总共分离出5 个组分峰,峰A 为没有被凝胶柱吸附的组分;峰B 和C 显示这两组分峰没有完全分开,但依然依次收集;峰D 和E可单独收集,收集得到的各洗脱液取少量做SDSPAGE 检测,其余的用Millipore 超滤管进行浓缩脱盐处理。
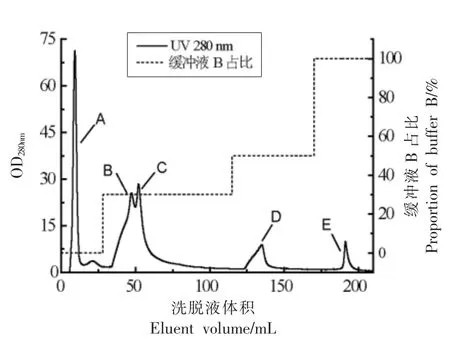
图1 肌原纤维蛋白的分离洗脱曲线图Fig.1 Isolation and elution diagram of myofibril protein
2.2 SDS-PAGE 凝胶电泳结果鉴定
由图2可知,电泳条带A 中颜色较深的为肌动蛋白,较浅的条带为少量的副肌球蛋白和肌球蛋白重链;电泳条带B 和C 为30%的洗脱液分离的组分峰,由于没有完全分离所以收集的时候界面不明确,导致电泳条带中两组分种类类似,都含有较多的副肌球蛋白、肌动蛋白和原肌球蛋白;电泳条带D 中主要成分是肌动蛋白和原肌球蛋白;在电泳条带E 中显示出单一条带,主要成分为肌动蛋白,分子质量为44.3 ku。单纯选择离子交换层析技术分离肌原纤维蛋白,仅能从洗脱峰E 中得到电泳纯的肌动蛋白,且纯化得到的蛋白量较少。而其它洗脱峰中肌动蛋白含量虽然高,但是不能得到较纯的单一蛋白质,因此还需要结合其它层析柱进一步分离纯化。
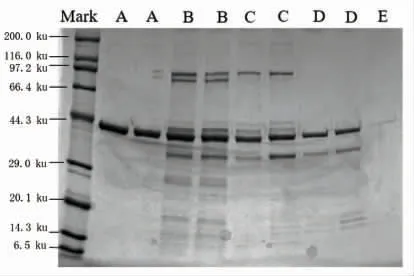
图2 离子柱分离得到的各洗脱液的SDS-PAGE 电泳图Fig.2 SDS-PAGE electrophoretogram of each eluent obtained by ion column separation
2.3 凝胶层析柱分离纯化的结果分析
如图3a所示,收集液A 用凝胶柱分离后得到3 个洗脱峰,分别标记为AA、AB 和AC;收集液B 进一步分离得到3~4 个洗脱峰,由图3b 可看出几个峰依然没有完全分离开;而50%洗脱峰被进一步分离出3 个峰,分别被命名为DA、DB、DC,由图3c(30%洗脱峰)可看出分离度良好。对比图3a 和3d 可以看出,峰AA 和DA 被分离出时所需的洗脱液的体积和出峰位置相似,初步猜测这两个峰可能含有相同的蛋白组分。收集每个洗脱峰溶液,经浓缩脱盐后用于SDS-PAGE 电泳鉴定。
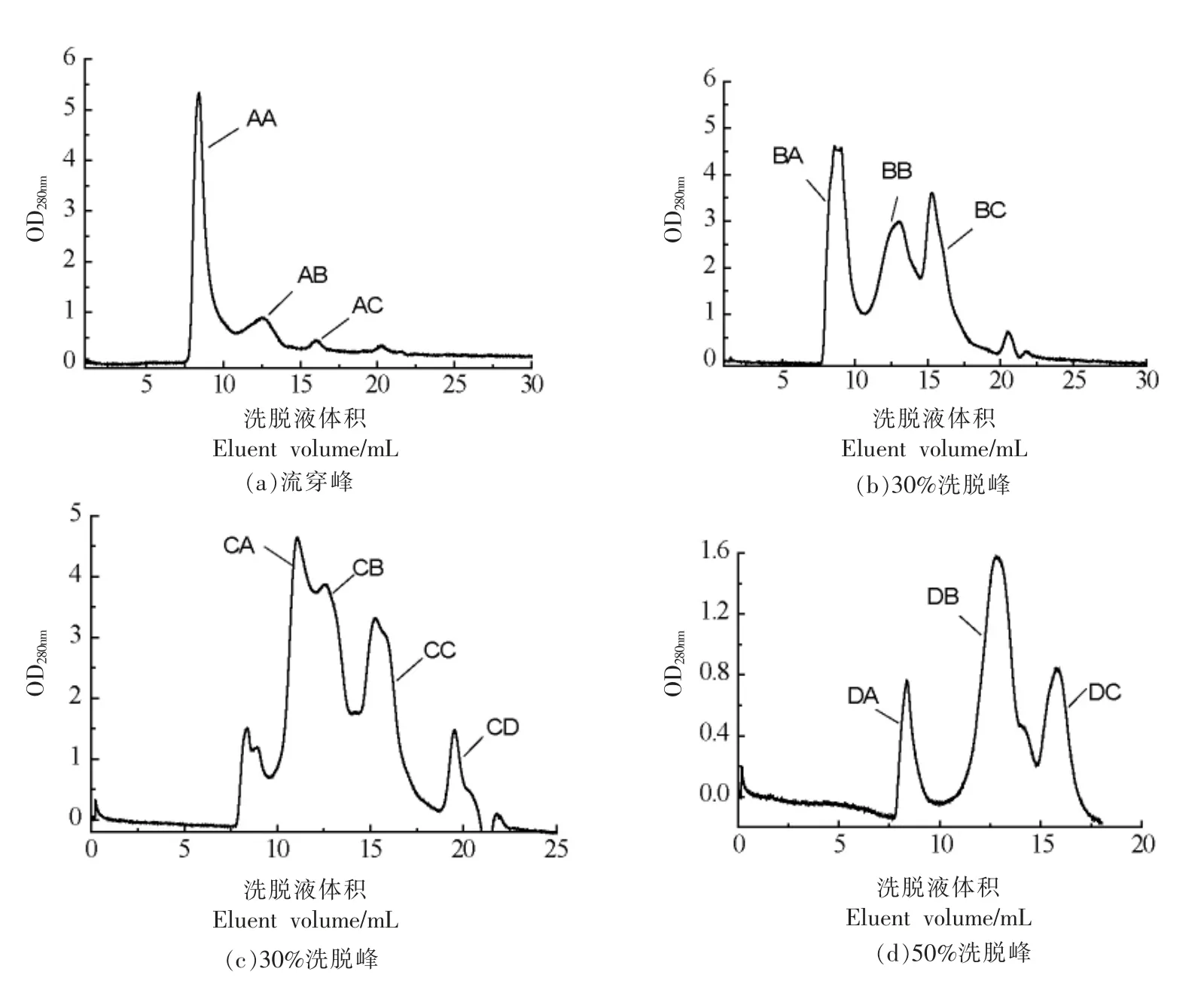
图3 凝胶柱分离肌原纤维蛋白的洗脱峰Fig.3 Separation of elution peak from myofibrillar protein by gel column
2.4 SDS-PAGE 凝胶电泳结果
用Millipore 超滤管(截留分子质量为10 ku)浓缩经凝胶层析得到的所有洗脱峰用于SDSPAGE 进行纯度鉴定,鉴定结果如图4所示。
如图4所示,泳道AA、AB、DA 和DC 均显示出分子质量约44.3 ku 的均匀单一条带。根据文献可知,这些条带均为电泳纯肌动蛋白。而BA 泳道中不仅含有肌动蛋白还有较多的复肌球;从BC泳道中分离得到了肌动蛋白、原肌球蛋白以及少量的副肌球蛋白;DB 峰只能得到肌动蛋白和原肌球蛋白的复合物;C 峰 (即CA、CB、CC、CD 峰)的副肌球蛋白、肌动蛋白和原肌球蛋白没有分离;AC 峰未检测到蛋白质。

图4 凝胶柱分离得到的各洗脱液的SDS-PAGE 电泳图Fig.4 SDS-PAGE electrophoretogram of each eluent obtained by gel column separation
综上所述,秘鲁鱿鱼肌原纤维蛋白经离子交换柱和凝胶色谱法柱联合处理后,可从AA、AB、DA 和DC 洗脱液中得到较纯的肌动蛋白(电泳纯级)。
2.5 肌动蛋白的高效液相色谱洗脱峰分布
由以上结果可知,肌动蛋白可从峰AA、AB、DA 及DC 中获得,对于该蛋白纯度的检测,以从DA 峰中收集到的蛋白液为代表,检测结果显示为单一、对称性良好的峰,说明肌动蛋白在层析介质上是均一的(除去盐离子所引起的吸收峰)。
2.6 肌动蛋白的MALDI-TOF-MS 鉴定及纯度分析
利用基质辅助激光解析电离飞行时间串联质谱分析分离纯化得到的肌动蛋白,然后根据数据库比对,获得肌动蛋白的信息(图6)。

图6 肌动蛋白的MS/MS 质谱图Fig.6 MS/MS mass spectra of actin
由表1可知,Mascot 峰值为829,而当Mascot峰值≥95 时即为鉴定成功,说明经过离子交换色谱和凝胶色谱联合从肌原纤维蛋白中分离得到了电泳纯和色谱纯的肌动蛋白。

表1 肌动蛋白的鉴定Table 1 Identification of actin
2.7 肌动蛋白粒径分布
由图7可知,在0.15 mol/L KCl 盐溶液条件下,肌动蛋白光强度自相关衰减速度较快,在弛豫时间为1.64 ms 时达到最低点,说明该溶液肌动蛋白溶解性良好。由图8可知,肌动蛋白溶液的粒径分布呈单峰状态,对称性好,说明溶液体系比较均匀,进一步间接说明本试验纯化的肌动蛋白相对纯净。肌动蛋白在0.15 mol/L KCl 中的平均水力半径(Rh)为3.46 nm,这与Kanzaki 等[15]的测定结果一致,说明该方法获得的肌动蛋白保持了其天然的结构,未发生变性聚集。
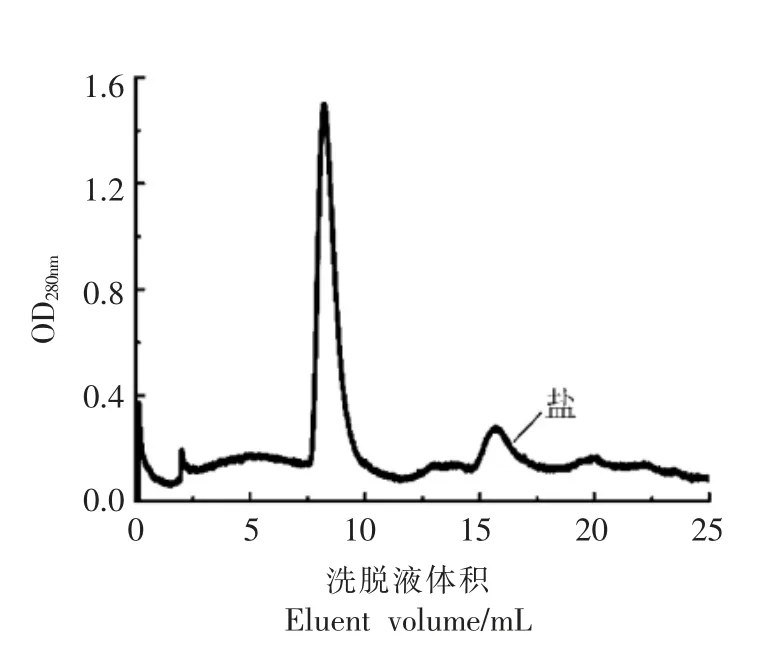
图5 肌动蛋白的高效液相色谱分析Fig.5 HPLC analysis of actin

图7 肌动蛋白溶液的自相关函数分布Fig.7 Autocorrelation function distribution of actin solution
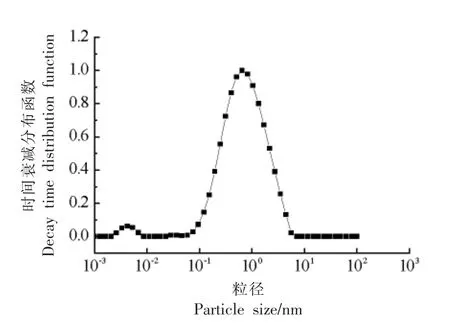
图8 肌动蛋白溶液的粒径分布图Fig.8 Particle size distribution of actin solution
3 结论
整个分离纯化肌动蛋白流程中均没有加入蛋白酶抑制剂EDTA,提取液用磷酸盐缓冲液分步洗脱,梯度30%,50%,100%,洗脱流速2 mL/min,肌原纤维蛋白过离子柱后,获得5 个洗脱峰,100%洗脱峰E 中获得电泳纯肌动蛋白,其余的洗脱峰再进一步利用凝胶柱分离纯化,在A 峰和D峰中获得较高纯度的肌动蛋白;SDS-PAGE 和HPLC 分析结果显示肌动蛋白为电泳纯级和色谱纯级蛋白,经MALDI-TOF-MS 进一步验证确定所得到的蛋白质为肌动蛋白。利用动态光散射多所获得的肌动蛋白进行了表征,0.15 mol/L KCl 中光强自相关衰减速率较快,弛豫时间1.64 ms 处达到最小值,肌动蛋白水力学半径(Rh)为3.46 nm,说
明获得的肌动蛋白保持了其天然结构,未发生变性聚集。本研究详细探讨了秘鲁鱿鱼肌动蛋白的分离纯化,对进一步分析秘鲁鱿鱼蛋白之间的构效关系和产品开发具有重要的意义。
