白芍总苷对肝郁脾虚模型大鼠脑-肠轴炎性因子表达的影响
2022-06-14彭志婷李晨周艳丽王新胡书群徐州市中医院药剂科江苏徐州00徐州医科大学江苏徐州009
★ 彭志婷 李晨 周艳丽 王新 胡书群(.徐州市中医院药剂科 江苏 徐州 00;.徐州医科大学 江苏 徐州 009)
腹泻常出现易痛易怒、情绪躁动不安、精神抑郁等问题[1],因此很多现代研究将其归结为脑-肠轴系统问题。由于肝郁脾虚病理机制复杂,其常与脑、肠组织中多种炎症因子如白介素1β(IL-1β)、肿瘤坏死因子(TNF-α)、P物质(SP)和干扰素-γ(IFN-γ)等相关[2-5]。目前临床多以抗抑郁药、胃肠动力调节药、调节免疫药和抗炎药等多种药物联合使用,治疗程序相对复杂,提高了药物在配伍禁忌和协同治疗过程中的潜在风险,不利于安全用药[6]。芍药归肝、脾经,具有养血柔肝的功效,用于多种胁痛、腹痛、四肢挛痛,是治疗肝郁脾虚证的组方中常用药物之一[7]。白芍总苷(total glucosides of paeonia,TGP)是从白芍中提取分离得到的苷类混合物,主要包括芍药苷、芍药内酯苷、羟基芍药苷以及芍药花苷等,临床多用于调节免疫和保肝等作用[8-9]。白芍总苷作为白芍的主要有效成分在治疗肝郁脾虚型腹泻的研究却相对较少。本研究通过慢性不可预知温和应激结合导泄药刺激的方法建立肝郁脾虚证模型[10-12],并观察白芍总苷对肝郁脾虚模型大鼠机械痛阈、肠推进和脑前额叶皮层组织,肠组织病理形态和肠道内IL-1β、SP、TNF-α和IFN-γ的影响,初步探讨白芍总苷对肝郁脾虚腹泻证脑肠轴组织的作用机制。
1 材料
1.1 仪器
酶标仪(美国赛默飞公司);电子天平(德国赛多利斯集团);Von Frey机械痛阈检测纤维丝(美国赛默飞公司);台式高速离心机(湖南湘仪离心机有限公司);动物呼吸麻醉剂(深圳市瑞沃德生命科技有限公司)。
1.2 材料
番泻叶(安徽亳千草国药业有限公司,批号:1807039)500 g,8倍水煎煮 2 h,煎煮两次,合并两次药液减压浓缩至每毫升含1 g药材,备用;IFN-γ 试 剂 盒( 批 号:JM-01762R1),SP试 剂盒(批号:JM-01851R1),IL-1β试剂盒(批号:JM-01454R1),IL-6试剂盒(批号:JM-01597R1),TNF-α试剂盒(批号:JM-01587R1),均购自江苏晶美生物科技有限公司。。活性炭粉、阿拉伯胶、羧甲基纤维素钠、高脂饲料为市售分析纯;马来酸曲美布汀胶囊(山西振东安特生物制药有限公司,批号:20200404),用生理盐水配制2 mg/mL 混悬液备用;白芍总苷胶囊(宁波立华制药有限公司,批号:200307)取白芍总苷胶囊内容物,加0.3%羧甲基纤维素钠溶液,分别配制成5、10、20 mg/mL的溶液。
1.3 动物
清洁级雄性SD大鼠60只,初始体重(220±20)g,购自徐州医科大学实验动物中心(生产许可证号:SCXK<苏>2015-0009),饲养环境为室温(25±2)℃,相对湿度为(50±10)%,每日随日光交替光照,自由进食饮水,适应性喂养一周后开始实验。
2 方法与结果
2.1 实验分组
SD雄性大鼠60只随机分为正常组、模型组、阳性对照组以及白芍总苷低、中、高剂量组,给药剂量分别为 50、100、200 mg/(kg·d);阳性对照组,给予马来酸曲美布汀20 mg/(kg·d)。每组各10只。
2.2 模型的建立
除正常组外,其余各组均采用高脂饮食喂养,每天冰水浴刺激 5 min、噪音刺激 1 h、束缚 8 h 和10 mL/(kg·d)番泻叶提取物导泻的方法持续6周,建立肝郁脾虚证大鼠模型,然后分别给予各设计药物,连续用药 7 d。
2.3 足底机械痛阈测试
给药第7天后,采用纤维丝法测量各组大鼠足底机械缩痛阈,依次使用不同强度的Von-Frey纤维丝刺激大鼠左后肢足底,记录实验大鼠最早出现缩足、甩足、抬足或舔足动作时的纤维丝强度为痛阈值。
2.4 肠推进实验
痛阈测试完毕后,间隔2 h给予各组动物10 mL/kg体重的10%活性碳与5%阿拉伯胶混悬液灌胃,计时30 min后将实验大鼠脱颈处死,分离完整的胃肠道,测定实验大鼠幽门至活性炭黑前沿的距离,以从幽门至回盲连接处全长为小肠全长,按照炭墨前端与幽门的距离/小肠全长×100%计算肠推进百分率。
2.5 病理学和相关炎症因子测定
各组大鼠麻醉后脱颈处死,取前额叶皮层组织,多聚甲醛固定后进行皮层组织的IL-1β、TNF-α免疫荧光染色,再另取前额叶皮层组织用Elisa法考察IL-1β、TNF-α的水平变化。取空肠道组织,多聚甲醛固定后HE染色观察病理学变化,另取空肠组织使用Elisa试剂盒法检测各组大鼠肠组织中IL-1β、TNF-α、SP和IFN-γ水平。
2.6 统计学方法
收集各实验组动物检测数据,采用SPSS 19.0软件分析,数据结果以(±s)表示,组间比较采用方差分析,P<0.05表示差异有统计学意义。
3 结果
3.1 机械痛阈和肠推进率实验结果
与正常组比较,模型组的肠推进率显著增加,痛阈显著降低(P<0.05),白芍总苷给药组和模型组比较,痛阈值均显著提高(P<0.05),其中白芍总苷低剂量组对痛阈的作用最显著,阳性对照组对痛阈值作用较弱;白芍总苷对肠推进作用有抑制效果,阳性对照组对肠推进作用最显著。见表1。
表1 各组动物机械痛阈和肠推进率实验结果(±s ,n=10)

表1 各组动物机械痛阈和肠推进率实验结果(±s ,n=10)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别 机械痛阈值/g 肠推进率/%正常组 24.17±4.49 45.86±6.25模型组 7.00±1.67 73.85±8.27白芍总苷高剂量组 15.63±6.67*# 55.73±9.5*#白芍总苷中剂量组 15.33±5.96*# 61.33±7.32*#白芍总苷低剂量组 17.50±7.12*# 62.50±5.58*#阳性对照组 11.92±7.76*# 49.67±6.33#
3.2 前额叶皮层免疫荧光结果
模型组大鼠前额叶皮层组织较正常组IL-1β的绿色荧光和TNF-α的粉色荧光显著增加,且IL-1β和TNF-α的荧光共定位不在同一区域,IL-1β的绿色荧光只在皮层外侧和细胞核中,而TNF-α的粉色荧响应较多,在皮层实质非核区域也有显著响应;白芍总苷中剂量组、高剂量组和阳性对照组IL-1β的绿色荧光显著减少;给药后TNF-α的粉色荧光响应皮层实质区有所减少,作用较阳性对照组弱。见图1。

图1 大鼠前额叶皮层组织免疫荧光染色(IL-1β、TNF-α,IF×40)
3.3 皮层组织IL-1β和TNF-α水平
与正常组比较,模型组大鼠皮层组织中IL-1β、和TNF-α水平均显著升高(P<0.05),与模型组相比,各给药组均可不同程度降低大鼠肠道组织中的炎性因子,其中中剂量白芍总苷对皮层IL-1β水平作用最显著(P<0.05),随白芍总苷剂量增加,皮层TNF-α水平现在降低,中、高剂量组作用较阳性对照药作用更显著(P<0.05)。见表2。
表2 大鼠皮层组织中IL-1β和TNF-α水平(±s ,n=10) pg/g

表2 大鼠皮层组织中IL-1β和TNF-α水平(±s ,n=10) pg/g
注:与模型组比较,*P<0.05;与阳性对照组比较,#P<0.05。
组别 IL-1β TNF-α正常组 92.43±7.30 4.53±1.18模型组 131.96±10.53 11.35±2.89白芍总苷高剂量组 122.05±20.58* 5.29±1.05*#白芍总苷中剂量组 105.37±13.06*# 5.81±0.98*#白芍总苷低剂量组 115.39±18.96* 6.54±1.76*阳性对照组 118.40±14.61* 7.35±1.42*
3.4 肠组织病理结果
模型组大鼠肠道组织较正常组出现明显的肠道绒毛损伤,组织结构有不清晰,有部分绒毛断裂和炎性聚集,白芍总苷低剂量组肠道绒毛结构有断裂,中、高剂量组和阳性对照组肠道绒毛结构相对完整。见图2。

图2 大鼠肠组织病理切片(HE,×40)
3.5 肠道组织IL-1β、SP、TNF-α和IFN-γ水平
与正常组比较,模型组大鼠肠道组织中IL-1β、SP、TNF-α和IFN-γ水平均显著升高(P<0.05),与模型组相比,各给药组均可不同程度降低大鼠肠道组织中的炎性因子(P<0.05),其中IL-1β、SP、TNF-α水平变化随白芍总苷剂量增加,而低剂量组对肠道组织中IFN-γ水平作用最显著。见表3。
表3 大鼠肠道组织中IL-1β、SP、TNF-α和IFN-γ水平(±s ,n=10) pg/g
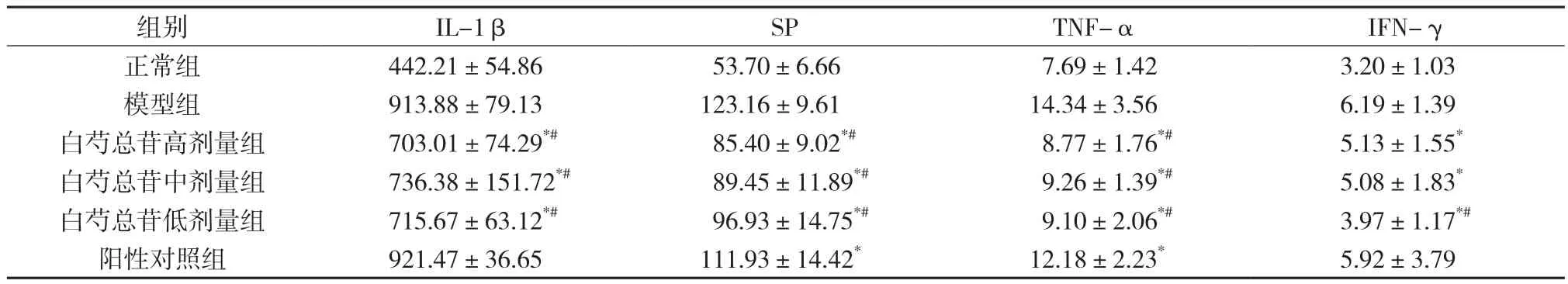
表3 大鼠肠道组织中IL-1β、SP、TNF-α和IFN-γ水平(±s ,n=10) pg/g
注:与模型组比较,*P<0.05;与阳性对照组比较,#P<0.05。
组别 IL-1β SP TNF-α IFN-γ正常组 442.21±54.86 53.70±6.66 7.69±1.42 3.20±1.03模型组 913.88±79.13 123.16±9.61 14.34±3.56 6.19±1.39白芍总苷高剂量组 703.01±74.29*# 85.40±9.02*# 8.77±1.76*# 5.13±1.55*白芍总苷中剂量组 736.38±151.72*# 89.45±11.89*# 9.26±1.39*# 5.08±1.83*白芍总苷低剂量组 715.67±63.12*# 96.93±14.75*# 9.10±2.06*# 3.97±1.17*#阳性对照组 921.47±36.65 111.93±14.42* 12.18±2.23* 5.92±3.79
4 讨论
在临床中肝郁脾虚引起的肠道功能紊乱,其病因病机与肝脾气机不畅有关。如张子和曰:“夫愤郁不伸,则肝气乘脾”,意为肝气郁结,情志抑郁,气血不畅,可致疏泄失常,气机郁滞,引起脾胃功能失常。肝郁脾虚证与现代医学中的心身应激反应相似,常与人体在非正常情况下或高负荷的压力事件以及受到的强烈刺激因素有关[13]。长期的心身应激状态造成机体整体较高的负荷[14],引起抑郁或中枢的氧化应激损伤,继而出现中枢皮层炎性因子高表达,也能引起疼痛的敏感化。应激反应在外周消化道组织则主要表现为腹泻或便秘以及肠道的炎症反应,同时引起消化系统组织血管收缩,供血减少,阻碍肠道屏障功能修复[15]。
白芍功效偏重养血柔肝、缓中止痛、敛阴收汗,主治胸腹胁肋疼痛、泻痢腹痛等疾病,是经典的平肝止痛中药。白芍总苷具有显著的抗抑郁功效,具有显著的抗应激作用,可有效缓解焦虑抑郁状态[16-17]。本实验研究了白芍总苷干预动物模型的机械痛阈和肠推进,研究结果发现,白芍总苷可以现在提高肝郁脾虚证大鼠模型的机械痛阈值,并且抑制肠推进率的亢进,其中高剂量效果更显著。
由于肝郁脾虚证病理机制复杂,涉及中枢皮层的多种炎症因子IL-1β、TNF-α和肠道神经递质如SP[3-4]。IL-1β在产生炎性反应和疼痛敏感化过程中发挥着重要作用,当机体受到应激刺激,可激活皮层和肠道组织的免疫细胞迅速释放IL-1β,并诱导产生早期炎症反应,并刺激炎症组织释放TNF-α、SP等更多种炎性介质使炎症反应扩散,其中SP是重要的肠道神经递质,不仅加重炎性反应,还可引起肠道平滑肌兴奋,肠推进增加,并且降低肠道痛觉阈值,是现成痛觉敏感的重要因素[14]。因此,肠道组织中IL-1β、SP、TNF-α的水平可以作为研究肝郁脾虚证肠道炎症反应的重要指标。
近年来研究发现部分免疫因子干扰素如IFN-γ也和肝郁脾虚证关系密切[3]。IFN-γ又称免疫干扰素,由T细胞产生,干扰素不仅可以增强中性粒细胞的吞噬能力,还可增强毛细血管内皮细胞、组织上皮细胞以及部分结缔组织细胞对中性粒细胞的黏附作用,达到聚集淋巴细胞,增强TNF-α生物学作用的效果,对研究肝郁脾虚证整体疾病进程具有重要意义。
本实验的组织病理切片结果发现,白芍总苷可以显著减轻肝郁脾虚模型组大鼠前额叶皮层组织IL-1β和TNF-α的响应,其中白芍总苷对IL-1β的作用较显著,阳性对照药曲美布汀对皮层TNF-α的作用较白芍总苷更显著。白芍总苷可有效减轻肠道组织中的炎性反应,抑制炎性细胞的渗出和聚集。炎性因子的检测结果显示,白芍总苷可抑制肠道组织中相关炎性因子IL-1β、SP、TNF-α的水平,而对IFN-γ的作用结果并未随剂量增加,白芍总苷低剂量组的抑制效果优于高剂量组。
综上所述,肝郁脾虚证的慢性应激过程是肠道功能紊乱发生的重要病因,本研究对比了白芍总苷对肝郁脾虚大鼠的干预作用,发现白芍总苷对肝郁脾虚模型大鼠的痛阈和肠推进率具有显著作用,其中低剂量的白芍总苷可显著的提高痛阈、抑制痛觉敏感,高剂量白芍总苷抑制对模型的肠推进效果更显著,组织病理学显示白芍总苷可显著抑制肝郁脾虚型脑-肠轴的炎症反应,抑制炎性因子IL-1β、SP、TNF-α和IFN-γ水平。由此可见白芍总苷在肝郁脾虚证IBS的治疗过程中具有较好的应用前景和深入挖掘研究的价值。
