彩色多普勒超声在儿童先天性门体静脉分流诊断及治疗中的应用
2022-06-14闫加勇霍亚玲刘杨赵晓宁王丹
闫加勇,霍亚玲,刘杨,赵晓宁,王丹
郑州大学附属儿童医院 河南省儿童医院郑州儿童医院超声医学科,河南 郑州 450000;*通信作者 王丹wangdan158975@163.com
先天性门体静脉分流(congenital portosystemic shunt,CPS)是一种罕见的先天性胚胎发育畸形,使门静脉血液直接流入体静脉系统,引起肝门静脉血液灌注不足和门腔静脉分流,最终可导致肝功能受损、肝性脑病、肺动脉高压和肝肺综合征[1]。CPS在新生儿中的发病率为1/50 000[2],其发病机制尚不明确,但对患儿预后影响重大。以往诊断CPS主要使用血管造影检查,近年来随着彩色多普勒超声分辨率的不断提升和各类探头功能的多元化应用,其在儿童腹部和血管检查中采用高频与低频探头相结合,可以直接诊断CPS,尤其是肝内型。本研究通过分析彩色多普勒超声诊断CPS的直接或间接征象,并对比CPS治疗前后门静脉相关参数的变化,探讨彩色多普勒超声在CPS中的临床应用价值。
1 资料与方法
1.1 研究对象 回顾性分析2015年1月—2020年10月河南省儿童医院收治的CPS患儿36例,均经血管造影确诊。其中男19例,女17例,年龄1个月~13.6岁,平均(5.4±4.0)岁。纳入标准:无肝硬化门静脉高压、门静脉海绵样变性、门静脉阻塞性疾病以及造成门静脉系统血流动力学改变的其他疾病,无腹部手术史。本研究经河南省儿童医院医学伦理委员会批准(备案号:2021-K-077),所有患儿监护人均知情同意。
1.2 仪器与方法 所有患儿入院后行常规腹部超声检查,平静状态下取平卧位检查,对不能配合的患儿镇静后检查,采用Philips EPIQ7C彩色多普勒超声仪行常规腹部彩色多普勒超声,C5-1凸阵探头频率为3.5~5.0 MHz,C12-3线阵探头频率为7~12 MHz,采用多切面扫查,重点观察肝脏各切面、门静脉、肠系膜上静脉、脾静脉、肝动脉、肝静脉、下腔静脉、静脉导管、髂静脉、肾静脉等。若肝内门静脉与肝静脉之间出现异常分流,提示肝内型CPS;测量分流内径,结合彩色多普勒血流显像(CDFI)和脉冲多普勒判断血流方向、频谱类型,并测量流速,超声束与血管角度<60°。若肝外门静脉系与腔静脉之间见异常分流,则提示肝外型CPS;除测量与肝内型CPS相同的指标外,同时需评估肝脏及门静脉发育情况,并关注是否合并其他畸形,如肝脏占位、胆道闭锁等。
对门静脉发育不良或发育较细的CPS患儿,术前测量门静脉主干及分支内径、血流束宽、血流速度,术后在同一位置、同一切面测量上述数据。体重≥60 kg者用3.5~5.0 MHz和5.0~8.0 MHz探头,必要时局部放大;体重<60 kg者用7~12 MHz和5.0~8.0 MHz探头。所有患儿均测量3次以上,取平均值。CPS介入封堵患儿术后重点观察分流是否阻断、封堵器位置是否正常、对周围组织是否有压迫、肝内外门静脉血流是否通畅、门静脉系统中有无血栓等。
1.3 统计学分析 采用SPSS 22.0软件,计量资料以±s表示,采用配对样本t检验评估术前及术后不同时间点测量参数的变化;计数资料以例数(%)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 36例CPS患儿临床分型:肝内型11例(其中静脉导管未闭6例)、肝外型21例(I型3例、Ⅱ型18例)、混合型4例(肝内型+肝外型)。合并症:高氨血症26例(72%),肺动脉高压16例(44%),肝肺综合征6例(17%),黄疸3例(8%),肝占位6例(17%,其中肝母细胞瘤1例,肝结节性增生2例,肝血管瘤3例),低氧血症2例(5%),血尿、血便2例(5%),肝性脑病1例(2%)。
治疗:10例行手术结扎,7例行介入封堵,1例肝移植,2例死亡,16例为随访病例,平均随访时间为6~12个月。截至2021年7月30日,6例年龄<2岁的肝内型CPS患儿中,2例在1岁以内自然闭合,其余患儿未出现明显并发症。
36例CPS中,通过腹部彩色多普勒超声诊断14例,其中肝内型7例,诊断符合率为64%;肝外型5例,包括I型2例,诊断符合率为67%,Ⅱ型3例,诊断符合率为17%;混合型2例,诊断符合率为50%。
2.2 彩色多普勒超声表现 36例CPS患儿彩色多普勒超声主要表现:肝内型:肝内迂曲走行异常管状或囊状回声(图1A),部分可融合呈团块状;静脉导管未闭连于下腔静脉与门静脉之间(图2A)。CDFI:肝内门静脉分支至肝静脉的异常分流信号(图1B),无搏动性,部分可融合呈毛细血管团;静脉导管内充满血流信号由门静脉向下腔静脉内分流(图2B)。肝外型:I型:肝体积偏小,门静脉主干及分支未能显示(图3A)。CDFI:未见明显门静脉血流灌注,肝静脉代偿性增宽(图3B);Ⅱ型:门静脉内径正常或变细,肝动脉可不同程度增宽(图4A),CDFI:门静脉内可见血流灌注,血流束较正常偏细。根据分流管径大小及分流量多少,门静脉发育程度差异较大,两者呈反向关系。下腔静脉、肾静脉、髂静脉可见异常血管连接(图4B),肠系膜上静脉及脾静脉汇合后汇入或各自汇入下腔静脉、肾静脉、髂静脉等(图4C)。分流血管内探及连续性单向血流频谱,平均流速31 cm/s,最高流速63 cm/s。混合型:上述两种类型共同出现。
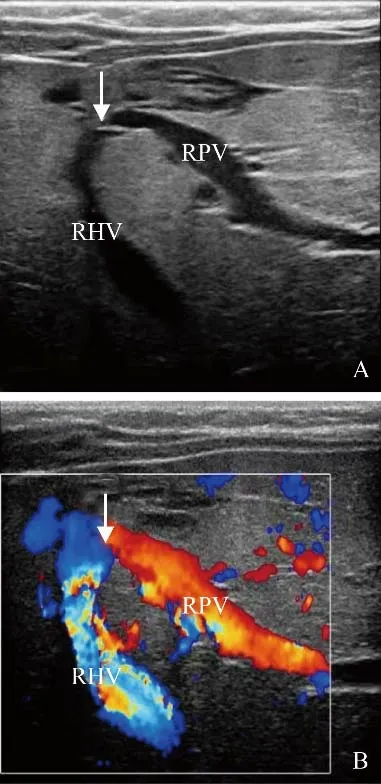
图1 男,1岁,肝内型CPS。A.门静脉右支与肝右静脉之间直接相通(箭);B. CDFI可见自RPV流向RHV的血流信号(箭);CPS:先天性门体静脉分流;RPV:门静脉右支;RHV:肝右静脉

图2 男,5岁,肝内型CPS。A.肝左叶静脉导管未闭(箭)连接门静脉左支与下腔静脉之间;B. CDFI可见静脉导管内蓝色分流信号(箭);C.静脉导管介入封堵后复查,封堵器回声(箭);D.封堵处(箭)未见明显分流;CPS:先天性门体静脉分流;PDV:静脉导管
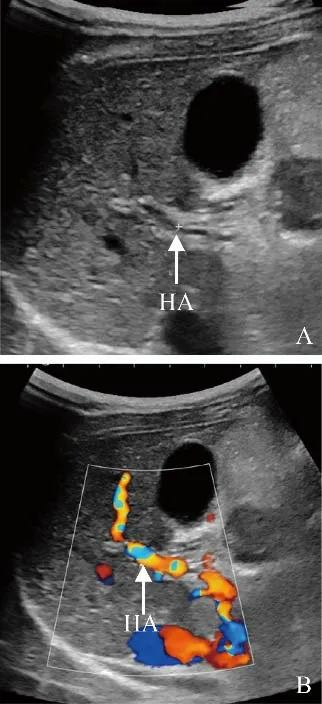
图3 女,3岁5个月,肝外I型CPS。A.第一肝门处未显示门静脉主干及分支,肝动脉增宽(箭);B. CDFI第一肝门处未见门静脉血流灌注,肝动脉内血流丰富(箭);CPS:先天性门体静脉分流;HA:肝动脉
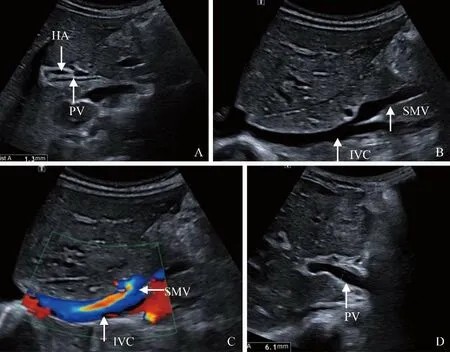
图4 男,7岁,肝外Ⅱ型CPS。A.门静脉内径变细,肝动脉代偿增宽(箭);B.肠系膜上静脉直接与下腔静脉相通(箭);C.肠系膜上静脉血流直接回流入下腔静脉(箭);D.治疗后12个月复查门静脉较前明显增宽(箭);CPS:先天性门体静脉分流;HA:肝动脉;PV:门静脉;IVC:下腔静脉;SMV:肠系膜上静脉
36例患儿中,30例(83%)表现为第一肝门部及肝内格林森鞘不同程度增厚,回声增强,肝回声不同程度改变,如增粗、回声增强等,其中6例合并肝占位性病变,肝动脉可不同程度增宽。5例(14%)合并脾大,脾静脉、肠系膜上静脉增宽,肠系膜增厚等。
2.3 CPS患儿治疗后情况 18例伴有门静脉发育不良或发育较细的CPS患儿中,10例行手术结扎,7例行介入封堵,1例肝移植;治疗后3、6、12个月定期随访。彩色多普勒超声重点测量门静脉内径、血流束宽、血流速度,与术前比较均有不同程度增加(P均<0.05,表1),其中门静脉内径增加最显著(图4D)。
表1 18例CPS患儿治疗前后门静脉内径、血流束宽、流速彩色多普勒超声参数比较(±s)
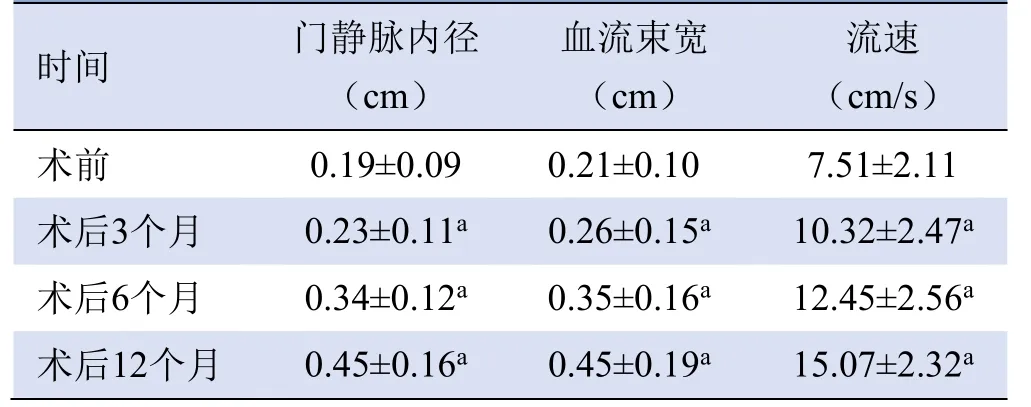
表1 18例CPS患儿治疗前后门静脉内径、血流束宽、流速彩色多普勒超声参数比较(±s)
注:a与术前比较,P<0.05
时间门静脉内径(cm)血流束宽(cm)流速(cm/s)术前 0.19±0.09 0.21±0.10 7.51±2.11 10.32±2.47a术后6个月 0.34±0.12a 0.35±0.16a 12.45±2.56a术后3个月0.23±0.11a 0.26±0.15a术后12个月0.45±0.16a 0.45±0.19a 15.07±2.32a
2例以低氧血症就诊患儿治疗后3个月复查症状明显好转,6个月复查低氧血症完全消失。1例肝性脑病患儿术后症状逐渐减轻,12个月复查时临床症状基本消失。1例肝结节性增生患儿术后12个月复查肿块较前缩小。14例高血氨患儿术后监测血氨逐渐下降,12个月复查血氨均降至正常水平。肝功能异常患儿在术后随访中均逐渐好转。3例肝外I型CPS患儿,1例肝移植术后各项指标恢复良好,2例死亡。
3 讨论
CPS发生于胚胎发育的4~10周,该阶段为门静脉和体静脉的发育时期[3]。患儿临床可能表现为无症状偶然发现的肝酶升高或肝脏影像学表现异常,有症状的严重疾病患儿表现为多器官受累[4]。CPS分为肝内型和肝外型,肝外型又称为Abernethy畸形,最早由John Abernethy于1793年描述,共分为两型[5],I型:门静脉未发育或发育极差,门静脉血未进入肝脏完全流入腔静脉;Ⅱ型:门静脉发育正常或偏小,有门静脉灌注,部分门静脉血回流入腔静脉。既往诊断CPS主要通过血管造影,因血管造影有创伤、有辐射,且不能用于长期复查,通常首选彩色多普勒超声[6-7]。近年来随着彩色多普勒超声分辨率的不断提升和各类探头功能的多元化应用,加上儿童腹壁较薄,易于加压探查等先天优势,采用高频与低频探头相结合,对本病的诊断符合率明显提高,尤其是肝内型CPS。可以通过彩色多普勒超声完成准确诊断和随访,典型病例不再依赖血管造影,有效减少了对儿童心理和身体的创伤。
本研究纳入36例CPS患儿中,彩色多普勒超声通过直接征象检出14例,分析因素如下:①本病发病率低,属于罕见病,国内外以个案报道为主,超声医师缺乏认识,临床诊断经验不足。②肝内型CPS的检出率较高,占64%,本组4例漏诊因肝内较大占位,血管受压变形,未显示出直接分流血管。肝外I型检出率为67%,因肝体积偏小,门静脉未发育或发育细小,会引起对本病的高度怀疑,重点探查检出率较高。肝外Ⅱ型检出率仅为17%,部分患儿肝脏和门静脉发育无明显异常,易忽视较细血管分流,加之受患儿体格及肠气影响大、视野较小、图像分辨率低、操作人员技术水平等因素影响,诊断较困难。③多数患儿以并发症就诊,易诱导医师诊断思路。经分析发现,肝内型和肝外I型CPS患儿彩色多普勒超声可表现为直接诊断征象;而肝外Ⅱ型CPS患儿仅少部分表现为直接诊断征象,大部分患儿表现为间接超声征象。近年来随着影像技术的发展,CPS报道次数增多及对其临床认识不断加深,其诊断率逐渐提高。彩色多普勒超声可以直接诊断CPS,并评估分型,尤其对于肝内型和肝外I型CPS的检出率更高、优点更显著。
彩色多普勒超声在CPS术前能观察分流内径、分流方向、分流速度及门静脉发育情况等,并能在术后复查分流关闭后的并发症情况,为临床提供重要影像学依据,是术后患者随访的必要检查。因分流关闭后,门静脉血液增多,相应门静脉压力升高,适当的高压可诱导门静脉进一步生长,使发育不良的门静脉系统再发育。肝内门静脉分支的血运重建可能通过胆管周围丛发展而来的门静脉海绵体瘤发生[8],本组CPS患儿中18例伴有门静脉发育不良或发育较细,经不同治疗方式根治后分别于3、6、12个月采用超声多普勒定期随访,发现门静脉内径、血流束宽、血流速度均较术前不同程度增加,以发育不良的门静脉增加最显著,其病理机制可能与门静脉再发育密切相关,与上述研究报道相符。极少数CPS患儿可出现特发性门静脉高压[9]。
CPS治疗主要取决于分流的类型和并发症的发展[10]。多数情况下,分流关闭或肝移植后,低氧血症可以完全消退[11];肝外I型CPS是最严重的一种,目前最有效的治疗是肝移植。有学者提出,对于年龄>2岁的肝外型CPS、较粗大分流的肝内型CPS或伴有严重并发症者,应早期积极治疗,不仅能改善临床症状,还可以预防发生较严重的并发症,如肝肿瘤、肺动脉高压、肝性脑病等[12-13]。然而对于早期的关闭仍存在争议,有研究报道[2,14-16]2岁以内肝内型CPS患儿有自愈可能,临床以定期随访为主。本组16例随访病例中,6例年龄<2岁的肝内型CPS,临床未发现明显严重并发症,行彩色多普勒超声密切随访观察,2例患儿1岁以内自然闭合。分流血管直径与患儿年龄呈正向关系,提示分流血管越大,随着年龄增长分流闭合越困难,有学者建议患儿应在学龄前接受根治性治疗[17-19]。因此,彩色多普勒超声对CPS的早发现和早诊断至关重要,不仅能直接诊断本病,还能评估分型:对肝外I型CPS提早预防并发症,及时治疗;对肝内型及肝外Ⅱ型无症状CPS定期监测分流,定量评估;对CPS术后定期随访门静脉再发育情况,综合评估术后效果。
本研究的局限性:①由于CPS罕见,本研究纳入病例数较少;②CPS关闭后的随访时间较短,不足以全面评估门静脉系统的整体预后情况。
总之,彩色多普勒超声能方便、快捷、无创诊断CPS,可实时动态监测术后门静脉及分支发育变化。定量分析有较高的敏感度和特异度,是目前筛查CPS最主要的检查方法,尽管血管造影是诊断CPS的“金标准”,但X线有辐射、手术有创伤,不适合作为筛查CPS及术后随访的常规检查。彩色多普勒超声在诊断和随访CPS中具有较好的临床应用价值,可以作为首选的辅助影像学检查。
