精氨酸-甘氨酸-天冬氨酸环肽修饰的纳米粒在小鼠乳腺癌细胞中的靶向性及超声成像研究
2022-06-14申洪远陶宏宇张芙蓉王晨雨米成嵘
申洪远,陶宏宇,张芙蓉,王晨雨,米成嵘
1.宁夏医科大学临床医学院,宁夏 银川 750004;2.宁夏医科大学总医院超声科,宁夏 银川 750004;*通信作者 米成嵘mcr69333@163.com
近年来,乳腺癌已居女性恶性肿瘤患病率的第一位[1-3]。手术、新辅助化疗、内分泌治疗等在临床上较为常见,但存在创伤面积大、易复发、全身副作用大、易耐药等缺点,会降低患者的远期生存率,并加重患者的身心负担。越来越多的学者开始关注肿瘤给药方式的研究,纳米粒(nanoparticles,NPs)作为载药系统,在提高现有癌症治疗药物的安全性和有效性方面具有巨大的潜力[4-5],其具备的主动靶向性为实现肿瘤区域的精准给药及提高治疗效率打下了良好基础。整合素αvβ3广泛表达于多种恶性肿瘤细胞表面及肿瘤新生血管表面(包括神经母细胞瘤、骨肉瘤、黑色素瘤、胶质母细胞瘤、乳腺癌和肺癌等),且极少表达于正常细胞表面[6],精氨酸-甘氨酸-天冬氨酸环肽(cRGD肽)能够选择性结合αvβ3,并可通过良好的细胞摄取能力有效靶向至肿瘤部位,在精准纳米载药系统的靶向性方面发挥巨大作用[7]。近年来,聚乙二醇(polyethylene glycol,PEG)作为亲水组分引入到聚合物载体的研究较多,PEG主要通过嵌段或枝接,可有效改善药物水溶性、增加药物稳定性和减轻免疫原性[8-13]。本研究将cRGD肽枝接于嵌段共聚物PEG-PLGA,构建高分子复合纳米造影剂cRGD-PEG-PLGA@PFP(cRGD-NPs),通过低强度聚焦超声治疗仪(LIFU),观察其体内外靶向性造影情况,探讨cRGD-NPs作为靶向纳米造影剂及载体精准治疗乳腺癌的可行性。
1 材料与方法
1.1 主要试剂与仪器 cRGD-PEG-PLGA(MW∶14 579 D,cRGD∶578 D,PEG∶2 000 D,PLGA∶12 000 D,广东碳水科技有限公司)、PEG-PLGA(MW∶14 000 D,PEG∶2 000 D,PLGA∶12 000 D,广东碳水科技有限公司)、全氟戊烷(perfluoropentane,PFP)、二氯甲烷(天津市瑞金特化学品有限公司)、异丙醇(徐州天鸿化工有限公司)、聚乙烯醇(PVA,上海Aladdin),小鼠乳腺癌细胞(4T1)细胞株(中科院上海细胞库),激光粒径仪(Zetasizer Nano ZS-90,Malvern)、倒置光学显微镜(Olympus)、透射电镜(Olympus)、激光共聚焦显微镜(Olympus)、LIFU(重庆海扶技术有限公司),BALB/c小鼠(4周,18~20 g,宁夏医科大学动物实验中心提供)分为靶向组及非靶向组,每组3只。
1.2 cRGD-NPs的制备 双乳化法制得cRGD-NPs,用磁力搅拌器室温搅拌3~5 h使微球表面固化,尽量使二氯甲烷完全挥发,4℃离心3次(11 190 g,5 min),弃上清液,收集纳米颗粒,于4℃冰箱保存。非靶向纳米粒的制作:将无cRGD肽标记的PEG-PLGA溶于有机溶剂二氯甲烷中,其余制作步骤与cRGD-NPs一致。
1.3 cRGD-NPs的基本特征检测 核磁氢谱验证cRGD-PEG-PLGA连接情况,溶剂为DMSO;使用Malvern粒度仪、光学显微镜、透射电镜观察cRGD-NPs大小、电位特征及分布情况。
1.4 cRGD-NPs体外生物安全性 应用CCK8溶液检测不同时间、不同浓度(0、0.2、0.4、0.8 mg/ml)cRGD-NPs对细胞活力产生的影响,将4T1细胞接种于96孔板,每孔细胞数约1×105个/ml,37℃、5% CO2常规培养24 h,将不同浓度PBS稀释的cRGD-NPs(0、0.2、0.4、0.8 mg/ml)加入不同复孔中,共同孵育24 h。于不同时间段(6、12、24 h)每孔加入100 μl配置好的CCK8溶液,1~4 h后,酶标仪测量450 nm波长下的吸光值,检测细胞存活率,计算方法:细胞存活率(%)=[(实验孔吸光度-空白孔吸光度)/(对照组吸光度-空白孔吸光度)]×100%。
1.5 cRGD-NPs体外靶向性的评估 取对数生长期4T1细胞,以1×105个/ml每孔接种于共聚焦培养皿,培养24 h,分为cRGD-NPs组和非靶向纳米粒组。DiL标记cRGD-NPs制作方法:将DiL染料在超声乳化前溶于二氯甲烷中,其余步骤同cRGD-NPs制作,每个培养皿加入1 ml DiL标记的cRGD-NPs/非靶向纳米粒。将两组处理后,细胞正常培养条件下孵育4 h,4%多聚甲醛1 ml固定15 min,PBS冲洗3次,加入DAPI染色剂对细胞核进行染色。激光共聚焦显微镜下观察每组与细胞的结合情况。
1.6 体内寻靶实验 乳腺癌小鼠模型建立后(4T1细胞剂量:104~105/ml,0.2 ml/只),待肿瘤长至100 mm3,应用IVIS光谱成像系统,采用组织荧光成像技术检测肿瘤组织中纳米粒的分布和代谢情况。DiL标记两组纳米粒,标记方法同上;具体操作:裸鼠吸入麻醉后,分别经尾静脉注射相同剂量、相同浓度(100 μl,0.1 mg/ml)的cRGD-NPs/非靶向纳米粒,观察纳米粒在体内聚集情况,荧光观察条件:激发波长480 nm,发射波长510 nm。
1.7 cRGD-NPs相变及体外显影 制作琼脂糖模型进行体外成像,取16 g琼脂糖粉末加入400 ml双蒸水,加热溶解,冷却后置于4℃等待模型固化。取1 mg/ml cRGD-NPs,经LIFU(4 W/cm2)辐照不同时间(辐照前、60 s、120 s、辐照后),光镜下观察声致相变变化;另取部分样品置于EP管中,观察不同温度条件下(室温、40℃、45℃、50℃、55℃)cRGD-NPs的变化趋势,从而探求cRGD-NPs稳定性及热致相变能力。使用Simons超声诊断仪(探头频率4~10 MHz,MI:0.12)观察cRGD-NPs常规超声及超声造影(CEUS)模式下不同显影效果。
1.8 cRGD-NPs体内显影 待乳腺癌肿瘤体积长至100 mm3左右时,每只小鼠经鼠尾静脉注入100 μl浓度为1 mg/ml的cRGD-NPs,经LIFU(4 W/cm2,120 s)辐照后,使用迈瑞超声诊断仪(探头深度0.05 cm,探头频率4~12 MHz,MI:0.06)进行二维超声及CEUS评估。
2 结果
2.1 cRGD-NPs的基本表征 将制得的cRGDPEG-PLGA溶解于DMSO溶液,获得核磁氢谱扫描分析结果(图1),HNMR光谱法测定产物的组成和分子量。以DMSO为溶剂,观察到cRGD(多个氢键峰)、PEG(3.580 ppm)和PLGA(1.464、4.906、5.205 ppm)的特征化学位移,显示cRGD与PEG-PLGA,cRGD连接成功占比含量约4%。制得cRGD-NPs呈乳白色悬浮液;光学显微镜下形态规则、大小均一(图2A);透射电镜下cRGD-NPs外观呈球形,表面光滑(图2B、C);Malvin粒度仪测量其平均粒径为(93.19±31.41)nm,多分散指数为0.11,Zeta电位为8.25 mV(图2D、E);载药结果显示,cRGD-NPs包载率可达(80.13±4.81)%。CCK8试验结果显示将不同浓度(0、0.2、0.4、0.8 mg/ml)cRGD-NPs混悬液与细胞孵育不同时间段(6、12、24 h),细胞活力均高于85%(图2F)。
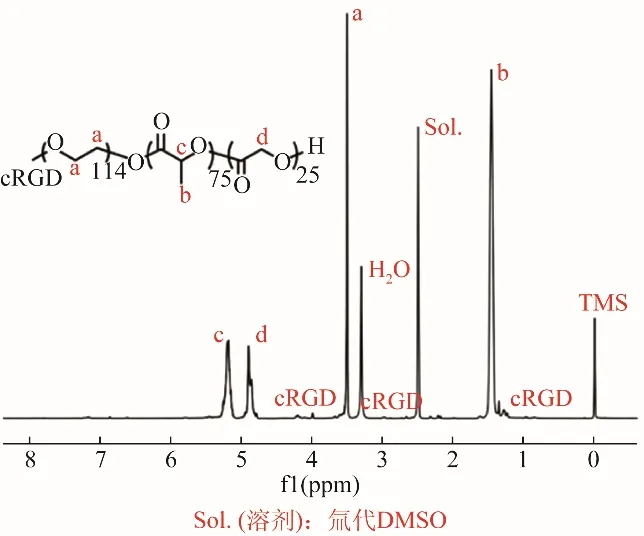
图1 cRGD与PEG-PLGA连接情况

图2 cRGD-NPs的基本特征。A.光学显微镜下cRGD-NPs形态(×4);B、C.透射电镜下cRGD-NPs为大小均一、形态规则的球形结构(×20);D、E. Malvin粒度仪测量cRGD-NPs,Zeta电位呈负电,单一峰;F. CCK8溶液检测cRGD-NPs安全性
2.2 体外靶向性评价 纳米粒经DiL染色后呈红色,4T1细胞经DAPI染色后显示为蓝色,荧光显微镜及激光共聚焦显微镜下观察,cRGD-NPs组蓝色染色区及周围显示大量红色荧光(即被荧光染色后的小鼠乳腺癌细胞吞噬吸收纳米粒于细胞核周围),部分可穿透核膜(即少部分cRGD-NPs可穿透细胞膜进入细胞核内);非靶向纳米粒组大部分荧光散在分布,并未进入细胞内,细胞核及周围仅显示少量红色荧光,且荧光强度明显少于cRGD-NPs组(图3)。
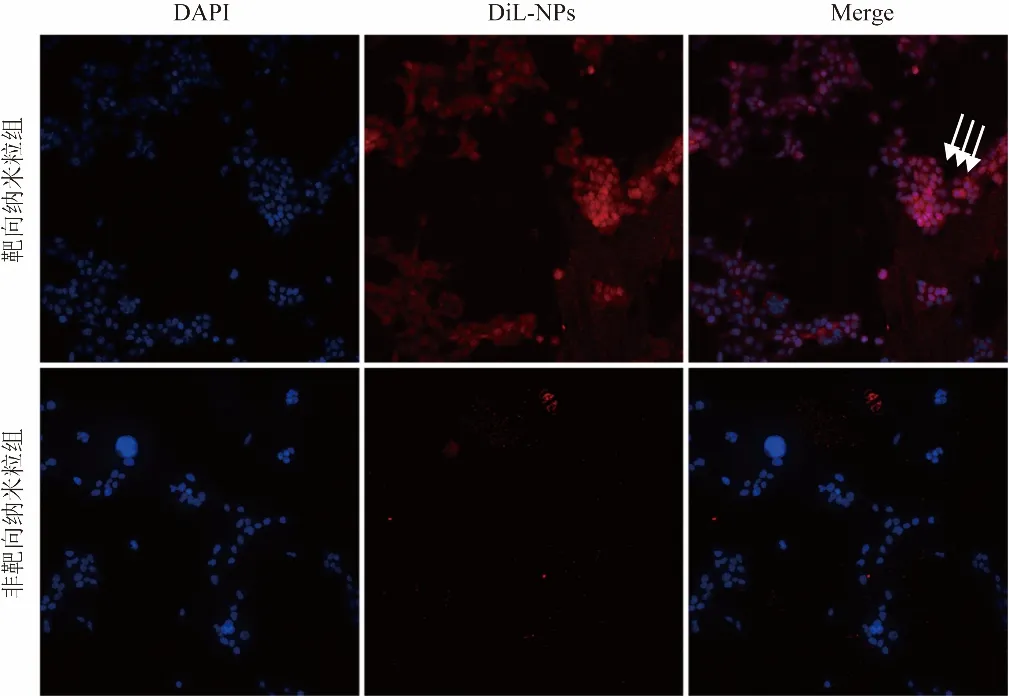
图3 激光共聚焦显微镜观察细胞摄取纳米粒情况。DiL标记的cRGD-NPs较多聚集于DAPI染色的细胞核周围,红色荧光与蓝色荧光存在重叠,且荧光强度明显强于非靶向纳米粒组,放大倍数为20倍;箭示红色荧光代表的cRGD-NPs出现在细胞核内
2.3 动物体内靶向性验证 裸鼠背部偏右侧种瘤3 d后,即可触及米粒大小瘤块组织,1~2周左右肿瘤体积可长至80~100 mm3大小。按照上述分组在注射DiL标记cRGD-NPs/非靶向纳米粒后1 h内行小动物活体成像。与健康小鼠成像图像比较发现,cRGD-NPs组荧光强度大多出现在肿瘤及周围区域,非靶向纳米粒组荧光强度明显低于cRGD-NPs组,且肿瘤部位荧光聚集程度较差(图4)。
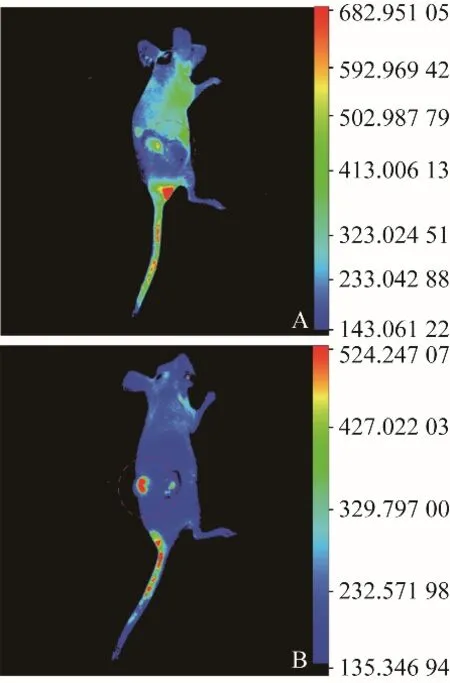
图4 小动物活体成像。A.非靶向纳米粒组;B. cRGD-NPs组;红圈区域为肿瘤组织
2.4 cRGD-NPs相变能力及体外显影 热致相变显示cRGD-NPs随着温度升高,粒径不断增大,不断产生新的气泡,cRGD-NPs可在50℃左右仍然保持结构稳定,形状呈规则球形,温度达到55℃时cRGD-NPs开始破裂,此外,45℃条件下持续加热2 min,cRGD-NPs直径未继续变大但其规则球形外壳发生改变,趋于破裂状态(图5)。经LIFU(4 W/cm2)辐照后,随辐照时间增加,可观察到cRGD-NPs直径逐渐增大直至破裂(图6),并且伴随LIFU辐照,琼脂糖模型中cRGD-NPs的二维及造影效果也随之呈现逐渐增强的趋势变化(图6D~G)。
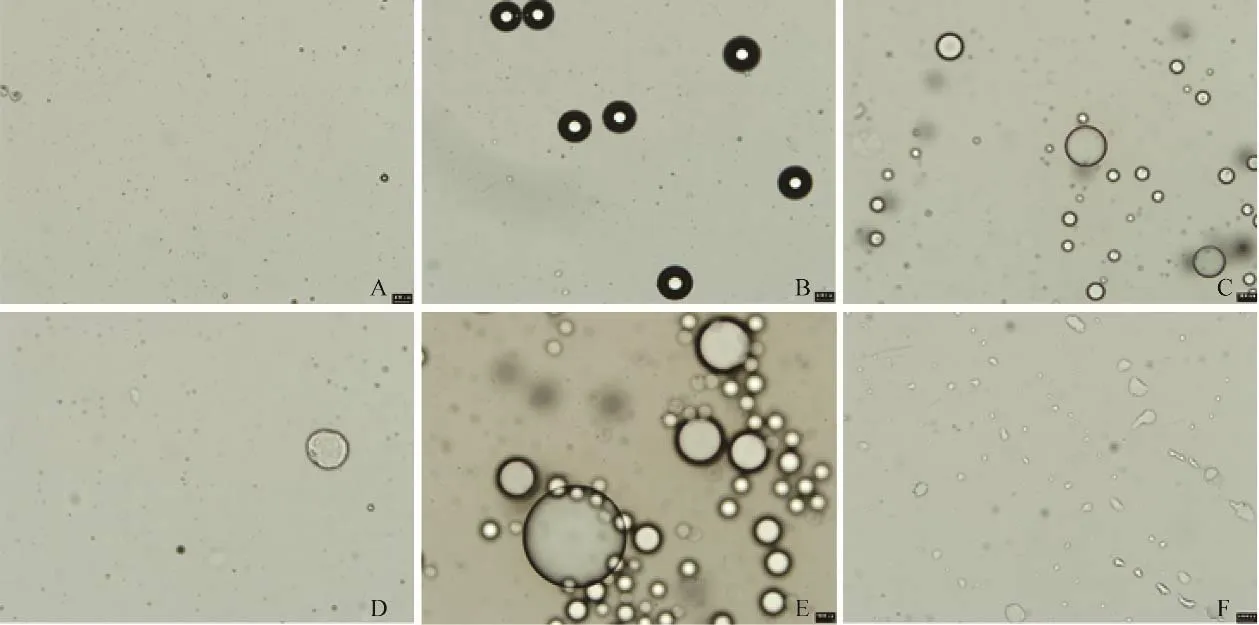
图5 光学显微镜观察不同温度下cRGD-NPs变化趋势(×20)。A.室温;B.加热至40℃,直径增大,开始产生气泡;C.加热至45℃,直径变大,并产生新的气泡;D. 45℃持续加热2 min后,增大的气泡不再呈规整球形,接近破裂形态;E.加热至50℃,大量cRGD-NPs直径增大,之前增大的气泡再次增大,增大的气泡越来越多;F.继续加热至55℃,大量气泡破裂,仅剩外壳
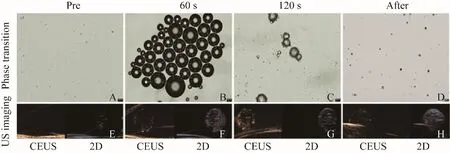
图6 光学显微镜观察cRGD-NPs相变及相应体外成像效果(×20)。A~D为经LIFU辐照前、辐照60 s、辐照120 s及辐照后光镜下cRGD-NPs变化情况,E~H为其对应造影效果;cRGD-NPs直径伴随LIFU辐射,粒径逐渐增大,造影效果也逐渐增强,辐照120 s后可观察到许多衍生小气泡产生,增强效果达到最佳;辐照结束后cRGD-NPs破碎,且数量减少,超声增强造影效果也随之减弱
2.5 cRGD-NPs体内显影 对小鼠乳腺肿瘤进行二维超声及CEUS检查,观察到cRGD-NPs经LIFU辐照后,肿瘤内部呈不均匀增强效果(图7)。
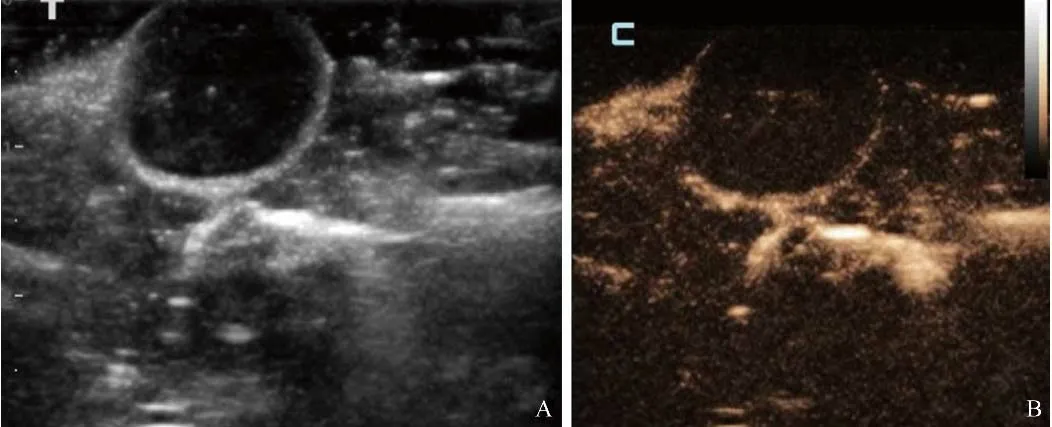
图7 注射cRGD-NPs经LIFU辐照后体内显影。A.二维超声肿瘤成像;B.注射cRGD-NPs后CEUS模式成像
3 讨论
超声医学及造影剂的革新推动着其在诊断成像中的应用。在材料合成、安全性能的推动下,CEUS已经从单纯的超声诊断应用到临床治疗,为基于超声的精准治疗应用研究奠定了良好的基础[11-13]。近年来,纳米级造影剂因其精细的大小和较长的体内循环时间,已经成为造影剂研究的重点,特别是针对肿瘤区域的成像及癌症治疗获得国内外学者的广泛关注。本研究制得的cRGD-NPs呈大小均一、具有良好壳核结构的球形结构,细胞毒性较小,可作为优质外壳为后续载药、载基因等研究提供基础,是一种可以在体内循环时间更长、免疫原性低的载药载基因载体。
3.1 cRGD-NPs实现主动靶向乳腺癌肿瘤细胞 高通透性和滞留效应可以使纳米粒或微泡在体内实现被动靶向效应,但其靶向性效率低限制了其后续发展。以细胞表面受体为目标的主动靶向递送大大改善了这一不足,受到广泛关注[7,14-17]。cRGD可与整合素竞争性抑制结合肿瘤细胞及新生血管表面受体,实现主动靶向肿瘤细胞。本实验利用cRGD与肿瘤表面特异标志物整合素αvβ3实现纳米粒主动靶向乳腺癌细胞,纳米粒体外摄取实验发现cRGD-NPs较多聚集于细胞核周围,提示cRGD显著提高了体外纳米粒靶向效率;小动物活体成像结果证实cRGD-NPs在体内亦具有对乳腺癌细胞的主动靶向性。
3.2 cRGD-NPs相变能力具有实现超声显影及定点释药的潜能 PFP是一种压力与温度敏感的相变材料,沸点为29℃,当到达沸点时极易发生液-气相变,极易从液态变为气体,但在不同材料包括脂质及其他高分子聚合物的纳米载体中,气化阈值会升高,实现稳定相变[18-19]。本课题组前期研究[20-21]发现在4 W/cm2、120 s条件下,LIFU辐照成像效果最佳;由于LIFU本身能量可产生热效应,有研究发现同样型号的LIFU仪器产生热量最高可达43℃,其分别观察了LIFU声致相变与热致相变变化趋势,热致相变实验发现经纳米粒包裹后,PFP阈值明显升高,40℃时开始发生液气相变,此过程可持续至55℃,并且在此过程中发现惯性空化效应,即增大气泡会衍生出更小的气泡的现象。本研究进行声致相变实验发现,两种相变模式具有相似的变化趋势,即在经过功率4 W/cm2的LIFU辐照后,cRGD-NPs刚开始不断产生逐渐增大的气泡,并且120 s后,惯性空化效应使小气泡产生。此外,本研究选择在LIFU产生热量最高温度(43℃左右)对cRGD-NPs进行2 min(声致相变及造影最佳条件)热致相变观察,观察到接近爆破的塌陷纳米粒,选取相同浓度cRGD-NPs进行体外造影,显示在不同辐照时间后,随着时间延长,造影能力不断增强;选取体外实验成像最佳条件下进行体内成像,发现肿瘤呈不均匀增强模式,以上实验证实了纳米粒成功包裹相变材料PFP,具有良好的热致相变及声致相变能力,并可进一步实现超声显影,而且成功包裹PFP并实现不同辐照时间下造影,也反映该纳米粒递送药物系统定点释药的潜能,为通过控制相变条件控制纳米粒相变、纳米粒的惯性空化效应及药物缓释提供了可能。
3.3 不足与展望 本实验通过多种方法证实cRGD-NPs是一种具有主动靶向肿瘤细胞,并具有实现定点释药以及药物缓释潜能,同时获得CEUS的诊疗一体化的载药系统。然而,本研究并未对cRGD-NPs靶向于肿瘤细胞的能力进行定量分析,且并未对载药后cRGD-NPs的抗肿瘤疗效进行研究,课题组将在后续研究中对cRGD-NPs的安全性、多模态成像及诊疗效果进行深入探讨。
