儿童鼻腔鼻窦恶性肿瘤及肿瘤样病变的影像表现
2022-06-14刘心怡罗益镇林洁琼叶文宏干芸根曾洪武
刘心怡,罗益镇,林洁琼,叶文宏,干芸根,曾洪武*
1.深圳市儿童医院放射科,广东 深圳 518038;2.汕头大学医学院,广东 汕头 515000;*通信作者 曾洪武homerzeng@126.com
鼻腔鼻窦恶性肿瘤在临床中少见,成人发病率约为0.83/10万[1],儿童发病率约为0.036/10万[2],常不易引起临床重视。儿童时期鼻腔鼻窦正处于动态发育过程,临床上不易区分恶性病变与正常发育过程表现,且儿童发病早期常无症状,中后期临床症状缺乏特异性,均为临床诊断带来困难。此外,朗格汉斯细胞组织细胞增生症(langerhans cell histiocytosis,LCH)等肿瘤样病变也可侵及头颈部[3],如鼻腔鼻窦部位,与恶性肿瘤难以鉴别。
目前关于儿童鼻腔鼻窦恶性肿瘤的综合影像学表现报道较少,且以淋巴瘤为主[4],本研究回顾性分析鼻腔鼻窦常见恶性肿瘤及肿瘤样病变患儿的临床及影像学资料,分析其影像学特征,以提高该部位病变的影像诊断水平。
1 资料与方法
1.1 研究对象 回顾性分析2014年8月—2021年1月于深圳市儿童医院经病理诊断为鼻腔鼻窦恶性肿瘤及肿瘤样病变患儿29例。纳入标准:①术前于本院行CT和(或)MRI检查;②术后病理确诊为鼻腔鼻窦恶性肿瘤及肿瘤样病变。排除标准:①临床病史或病理资料不完整;②影像图像质量差。其中男22例,女7例;年龄4个月~14岁,中位年龄3.5岁;病程2 d~6个月,中位病程0.5个月。主要临床表现:眼突、眼眶肿胀11例,鼻塞流涕5例,鼻出血3例。29例患儿中,8例仅行CT扫描(其中3例行CT平扫及增强扫描),9例仅行MRI平扫及增强扫描,12例同时行CT和MRI扫描。本研究通过深圳市儿童医院医学伦理委员会批准[批件号:深儿医伦审(科研)批件2021118号],免除患儿及家属知情同意。
1.2 检查方法
1.2.1 CT检查 20例患儿进行CT检查,其中14例行平扫,6例行平扫加增强扫描。使用GE Optima CT 680 Quantum 64排128层容积螺旋CT扫描仪,同时采用软组织算法和骨算法重建。扫描参数:管电压100 kV,管电流250 mA,螺距0.984,层厚5 mm,间隔5 mm,重建层厚及间隔均为0.625 mm。增强扫描经患儿静脉注入300 mgI/ml优维显2 ml/kg,注射速度与扫描时间按照患儿年龄、体重、静脉情况及病情需要进行个性化设置。对于年龄过小不配合的患儿,口服0.5 ml/kg 10%水合氯醛或直肠给药镇静,最大剂量为10 ml。
1.2.2 MRI检查 21例患儿进行MRI检查,其中2例行平扫,19例行平扫加增强扫描。采用1.5T (GE Signa Exicte HD)和3.0T(Siemens Skyra)MRI系统。副鼻窦扫描应用FSE或TSE序列,层厚3.0~4.2 mm,层间距0.5~1.0 mm,矩阵320×260~320×320,激励次数1~2次,常规行横断位T1WI、T2WI、加脂肪抑制技术(fat suppression,FS)的T1WI和T2WI,以及冠状位T1WI扫描,平扫采用SE T1WI,TR 400~600 ms,TE 6~15 ms;FSE T2WI,TR 3 000~4 500 ms,TE 80~120 ms。增强扫描为横断位、冠状位及矢状位T1WI-FS,静脉推注对比剂钆喷替酸葡甲胺(拜耳),剂量0.2 ml/kg。年龄过小不配合者,镇静方案同上。另外12例加行横断位扩散加权成像(DWI)序列扫描(b=0、1 000 s/mm2)。所有影像学检查均在入院后3 d内完成。
1.3 影像分析 由从事儿童头颈系统影像诊断工作的1名副主任医师和1名高年资主治医师采用双盲法独立阅片,综合CT和(或)MRI图像,观察鼻腔鼻窦占位病变的数目、原发中心部位、大小、形态、边界、CT密度、MRI信号、强化情况、是否有瘤内出血、钙化或囊变坏死、病变侵及范围、邻近骨质改变、周围淋巴结有无转移、硬脑膜有无受累等影像学表现。意见不统一时协商讨论达成一致。
2 结果
2.1 病理组织学类型 29例儿童鼻腔鼻窦恶性肿瘤及肿瘤样病变的病理类型见表1。7例淋巴瘤中,Burkitt淋巴瘤5例,弥漫大B淋巴瘤1例,B淋巴母细胞淋巴瘤1例;3例白血病中,急性淋巴细胞白血病2例,粒细胞肉瘤/绿色瘤1例。患儿病变类型及年龄、性别构成见表1,其中神经母细胞瘤骨转移患儿原发肿瘤均起源于后纵隔或腹膜后;肿瘤样病变均为LCH,均通过免疫组化确诊。
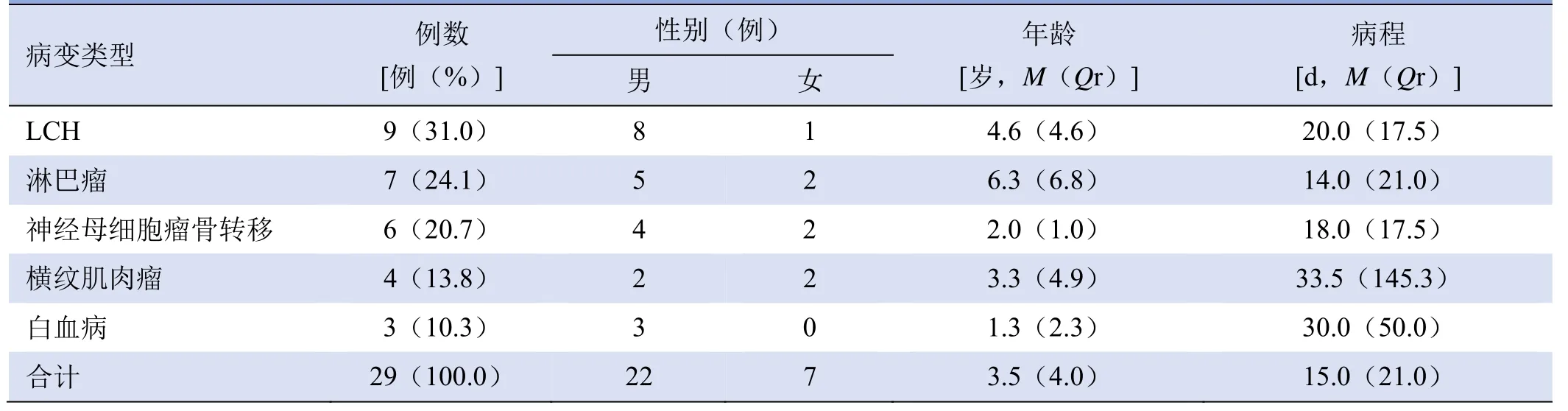
表1 29例患儿鼻腔鼻窦恶性肿瘤及肿瘤样病变的类型及人口学资料
2.2 CT及MRI表现
2.2.1 病灶数量及部位 单发15例(其中右侧8例、左侧6例、正中1例),多发14例;累及鼻腔11例,副鼻窦20例(其中上颌窦17例),眼眶20例,蝶骨大翼17例,脑内结构1例,见表2。

表2 儿童鼻腔鼻窦恶性肿瘤及肿瘤样病变侵犯部位分布(例)
2.2.2 病灶形态及大小 所有病灶均呈软组织肿块影,其中8例形态规则,呈类椭圆形,21例形态不规则;16例边界清晰,13例边界不清晰;病灶直径最小12.2 mm,最大85.6 mm。
2.2.3 病灶CT密度特点 20例患儿行CT检查,3例神经母细胞瘤转移灶以不均匀等密度为主,其中1例增强扫描呈轻度强化;4例淋巴瘤呈均匀等稍低密度;3例横纹肌肉瘤中,2例平扫呈均匀等密度,1例呈不均匀等稍低密度,增强扫描均呈不均匀明显强化;2例白血病平扫均呈均匀稍高密度,其中1例增强扫描呈轻度强化;以上12例病灶均未见明确钙化或出血密度。其余8例LCH中,CT平扫显示3例呈不均匀混杂密度(1例可见散在少许钙化),5例呈均匀等密度,增强扫描呈不均匀明显强化。
2.2.4 病灶MRI信号特点 21例患儿行MRI检查,4例神经母细胞瘤转移灶T1WI呈等信号,T2WI呈不均匀高信号,增强扫描呈明显不均匀强化;6例淋巴瘤中4例T1WI呈等信号,T2WI呈稍高信号,2例T1WI及T2WI呈等低信号,增强扫描均呈明显强化;3例横纹肌肉瘤T2WI呈稍高信号,均为不均匀明显强化,可见小环状强化(图1);2例白血病均呈等T1及T2信号,其中1例增强扫描明显强化;6例LCH中3例信号不均匀,其余T1WI呈等信号,T2WI呈稍高或高信号,2例增强扫描明显不均匀环形强化。12例行DWI检查,10例提示扩散受限,其中神经母细胞瘤骨转移4例、白血病3例、淋巴瘤2例、横纹肌肉瘤1例。
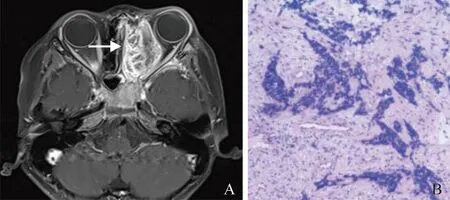
图1 男,7岁,鼻窦横纹肌肉瘤。T1WI增强扫描示左侧上颌窦-筛窦-眼眶肿块呈葡萄状强化,可见粗大血管影(箭,A);HE染色示横纹肌肉瘤病灶见幼稚的小蓝圆肿瘤细胞,表面被覆假复层纤毛柱状上皮(×100,B)
2.2.5 病灶周围组织受累情况 ①骨质破坏:28例可见不同程度骨质破坏,9例LCH中5例骨质破坏呈纽扣征、刀切征或火山口征(图2),边缘较清晰锐利。本组近86%的淋巴瘤骨质破坏呈非对称性,即骨质破坏多集中于内侧壁,外侧壁骨质破坏相对轻微(图3)。②骨膜反应:4例神经母细胞瘤骨转移可见垂直骨针样骨膜反应(图4);2例白血病可见少许短粗针状骨膜反应,边缘模糊(图5);本组淋巴瘤及横纹肌肉瘤均未见骨膜反应,9例LCH中仅1例可见Codman三角形成。③颈部淋巴结:2例横纹肌肉瘤,1例神经母细胞瘤骨转移及1例淋巴瘤出现颈部淋巴结肿大,白血病及LCH均未见颈部淋巴结肿大。④硬脑膜:4例神经母细胞瘤骨转移MRI增强扫描中,3例显示硬脑膜增厚超过3 mm并明显强化。
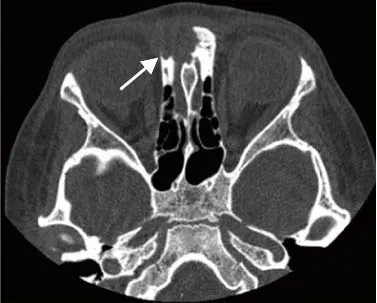
图2 男,5岁,LCH。CT骨窗示筛骨右前份见溶骨性骨质破坏,边缘清晰,呈火山口征(箭),无骨膜反应
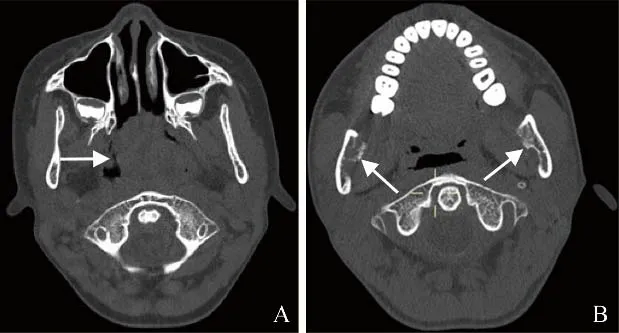
图3 男,14岁1个月,鼻腔弥漫大B淋巴瘤。CT骨窗示占位位于鼻腔后部(箭,A),累及双侧下颌支,骨质破坏呈非对称性,多集中于内侧壁(箭,B),外侧壁骨质破坏相对轻微
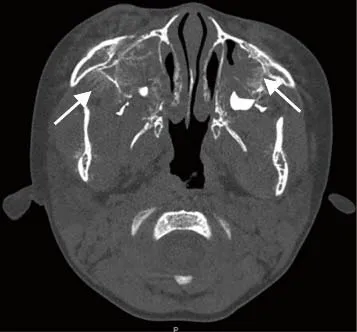
图4 男,3岁7个月,神经母细胞瘤骨转移。CT骨窗示双侧上颌窦壁、蝶骨大翼及下颌骨均可见不同程度骨质破坏,伴垂直骨针样骨膜反应(箭)
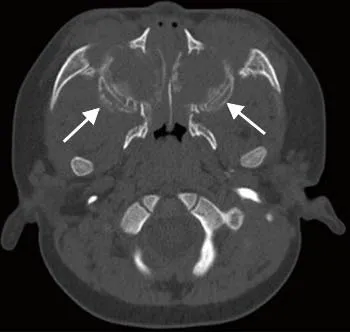
图5 男,1岁3个月,急性淋巴细胞白血病。CT骨窗示双侧上颌窦壁对称性骨质破坏,骨膜反应短粗且模糊,呈“擦拭样”(箭)
3 讨论
本组儿童鼻腔鼻窦恶性病变以血液系统肿瘤及神经源性肿瘤最常见,与刘薇等[4]的研究结果一致。病变可不同程度累及眼眶,患儿多因眼部症状就诊后发现病灶,可能与儿童鼻腔鼻窦部骨质发育成熟度相关。儿童该部位发育过程中骨质较薄弱,恶性肿瘤在早期阶段容易侵袭鼻腔鼻窦骨质并直接蔓延向同侧眼眶[5]。本组儿童鼻腔鼻窦恶性肿瘤中淋巴瘤占比最大,与国内文献报道相符[6],而国外文献报道以横纹肌肉瘤最常见[2],可能因人种差异所致。
3.1 淋巴瘤 发生于鼻腔鼻窦的淋巴瘤大多数为非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL),是儿童常见的高度恶性肿瘤,主要来源包括T细胞、B细胞和NK/T细胞,本研究中儿童B细胞来源的NHL(BNHL)以Burkitt淋巴瘤最为常见,与临床报道相符[7]。B-NHL在影像学中具有相对特异性,本组以Burkitt淋巴瘤好发于双侧鼻腔或上颌窦,成分均匀,病变肿块范围大于骨质破坏范围,无骨膜反应,增强扫描后多呈轻度-明显均匀强化,常伴硬脑膜强化,与文献报道相符[8-9]。本研究中2例淋巴瘤T2WI呈等低信号,提示细胞密集,核浆比大,可鉴别其他恶性肿瘤。此外,本组淋巴瘤骨质破坏多集中于内侧壁,外侧壁骨质破坏相对轻微,考虑可能与肿瘤中心位置和直接侵袭趋势相关,可鉴别神经母细胞瘤骨转移与白血病,后者多同时侵犯内外侧骨皮质。而针对淋巴瘤细胞来源影像鉴别,有研究表明侵及面部皮下软组织更多地提示为NK/T细胞来源的NHL[10-11],本组B-NHL均无侵及皮下软组织,与上述研究相符,推测原因为B-NHL常沿黏膜蔓延生长。
3.2 神经母细胞瘤骨转移 神经母细胞瘤是来源于肾上腺髓质和交感神经丛的原始胚胎性恶性肿瘤,是儿童最常见的颅外实体肿瘤[12]。神经母细胞瘤骨转移常好发于富含红骨髓的颅面骨,常累及鼻腔鼻窦和蝶骨大翼区域。软组织沙砾样钙化及放射状垂直骨针是神经母细胞瘤骨转移的特征性改变,有利于与LCH进行鉴别[13]。尽管本组3例神经母细胞瘤骨转移CT平扫未见钙化形成,但依靠双侧对称性垂直骨针及原发肿瘤病史,可以做出神经母细胞瘤骨转移的影像诊断。而对于初次就诊发现鼻腔鼻窦软组织肿块伴垂直骨针的患者,提示临床需进一步完善胸部平片或腹部超声检查,排除后纵隔或腹膜后神经母细胞瘤的可能。
3.3 横纹肌肉瘤 横纹肌肉瘤是具有分化为骨骼肌潜能的高度恶性原始间质肿瘤,也是最常见的儿童软组织肉瘤,横纹肌肉瘤与染色体异常及分子通路改变有关,2017年WHO病理分型包括胚胎型、腺泡型、多形型和梭形细胞型[14-15]。横纹肌肉瘤侵袭性强,进展迅速,常发生于头颈部及腹膜后,可侵犯鼻腔及鼻旁窦区,甚至眼眶及颅内,早期手术切除有助于提高生存率[16]。鼻腔鼻窦横纹肌肉瘤在影像学上无特异性[17],本组横纹肌肉瘤共性特点为增强扫描后不均匀明显强化,少见钙化坏死出血,脑膜结节可出现增厚强化,周围可见溶骨性骨质破坏或肿块生长迅速直接包埋骨质,常有颈部淋巴结肿大,与既往研究结果一致[18]。相关研究[19]显示葡萄状强化可能是横纹肌肉瘤具有特征性的影像学表现,即呈多个小环状强化,病理表现为肿瘤细胞包裹黏液基质。本组研究中横纹肌肉瘤强化模式与上述研究相符,且部分可见粗大血管影。此外,彭媛媛等[20]基于纹理分析表明,横纹肌肉瘤的表观扩散系数低于淋巴瘤等非小圆细胞肿瘤。因此,延迟强化扫描及测量瘤体表观扩散系数有利于鉴别横纹肌肉瘤和淋巴瘤或LCH。
3.4 白血病 白血病是好发于儿童造血系统的恶性克隆性疾病,其中以急性淋巴细胞性白血病最常见,随着化疗水平进步,近20年来五年生存率已提高约20%[21]。导致白血病的异常增殖细胞可沿哈弗斯系统浸润全身骨髓,多以中轴骨开始,包括上颌窦、筛窦及蝶窦等鼻窦壁。本研究中的粒细胞肉瘤增强扫描后呈明显强化,与樊红光等[22]的研究相符,但与戴望春等[23]的研究结果不一致,考虑强化表现多样性与肿瘤具体组织分化类型和血供有关,因此不建议把强化模式作为白血病的重要鉴别要点。此外,本研究发现白血病的针状骨膜反应较为短粗,且边界模糊呈“擦拭样”,与神经母细胞瘤骨转移存在差异,后者所致的骨膜反应通常细长而清晰,推测可能是因为白血病的成骨细胞生长速度慢于神经母细胞瘤骨转移。
3.5 LCH LCH是一种少见的骨髓单核细胞-巨噬细胞系统克隆性肿瘤样病变,可累及全身各部位骨骼,但发生于鼻腔鼻窦区罕见,临床容易误诊误治[24]。在临床治疗中,局限性LCH以化疗为主,与恶性肿瘤治疗思路存在差异,因此有必要挖掘LCH与恶性肿瘤之间的影像特异性,实现早期精准诊治。本组9例LCH中2例术前误诊为横纹肌肉瘤,2例术前诊断为考虑恶性肿瘤,其原因是对LCH病理及影像进展特点掌握不足。LCH侵犯骨质时可分为3期[25]:早期朗格汉斯细胞聚集,骨皮质多呈扇贝样压迹,未见骨膜反应;中期病变形成肉芽肿,肿块较小,突破骨皮质,可刺激骨膜形成层状骨膜反应;晚期出现边缘硬化、死骨或骨膜融合等修复表现,由此可见LCH影像表现复杂多样。本组LCH骨质破坏均为穿凿样或虫蚀样,边界清楚,与文献报道相符[26-27],多无骨膜反应,考虑处于早中期。此外,LCH属于中间型肿瘤样变,进展较慢,骨质破坏与肉芽肿形成的速度相对持平,DWI多表现为低信号,无粗大血管及延迟强化,可与淋巴瘤或横纹肌肉瘤等恶性程度较高的肿瘤相鉴别。
3.6 本研究的局限性 ①单个病种的样本量较少,后续有待继续增加样本量;②部分病例仅进行CT或MRI扫描,造成部分影像信息不完整;③剔除了无最终病理结果的病例,可能存在偏倚。
总之,儿童鼻腔鼻窦恶性肿瘤及肿瘤样病变影像学表现具有相对特异的鉴别要点,综合分析CT及MRI表现,细致观察病变软组织内部和范围特点,骨质改变及邻近结构侵犯情况,是鉴别诊断此类病变的关键,未来有望结合影像组学方法提取分析肿瘤影像特征,为儿童鼻腔鼻窦恶性肿瘤构建生存预后预测模型。
