基于临床、超声及基因特征列线图预测甲状腺乳头状癌侵袭性
2022-06-14严继萍王金萍
朱 琳,严继萍,*,王金萍,刘 莎
(1.山西医科大学医学影像学院,山西 太原 030001;2.山西省人民医院超声科,山西 太原 030012)
近年来,甲状腺癌发病率持续上升,甲状腺乳头状癌(papillary thyroid carcinoma, PTC)为其最常见病理类型[1]。多数PTC分化良好,局部侵犯、区域淋巴结转移及复发率均较低[2],其生物学行为具有惰性[3],患者术后5年死亡率低于2%,术后10年生存率约93%;但部分亚型的PTC具有异质性,侵袭性及变异能力较强[4]。采用超声评估PTC甲状腺外侵犯或颈部淋巴结转移的文献[4]较多,但少见以列线图作为预测工具的研究。本研究基于临床、超声及基因特征建立列线图模型,观察其预测PTC侵袭性的价值。
1 资料与方法
1.1 一般资料 收集2020年6月—2021年1月207例于山西省人民医院接受手术(甲状腺腺叶及峡部切除或次全/全甲状腺切除+中央区淋巴结清扫+纳米碳染色可疑颈侧区转移淋巴结清扫)治疗且经术后病理证实的PTC患者,男79例,女128例,年龄16~77岁,平均(43.3±11.6)岁;根据术后病理所示PTC病灶侵及甲状腺被膜和/或患侧颈部淋巴结转移与否分为侵袭组(n=130)及非侵袭组(n=77):侵袭组男56例、女74例,年龄16~67岁,平均(42.2±11.1)岁,其中单纯颈部淋巴结转移102例、单纯侵及甲状腺被膜10例、同时发生18例;非侵袭组男23例、女54例,年龄24~77岁,平均(45.2±12.3)岁。纳入标准:①明确PTC是否侵及甲状腺被膜及有无患侧颈部淋巴结转移;②基因检测结果仅示BRAFV600E基因突变;③术前超声资料完整。排除标准:①合并其他类型甲状腺恶性肿瘤;②发生对侧颈部淋巴结跳跃式转移;③术前接受甲状腺结节微创消融/外科手术/放射治疗。本研究获院伦理委员会批准,检查前患者或监护人均签署知情同意书。
1.2 仪器与方法 采用GE Logiq E9型超声诊断仪,L9线阵探头,频率6~15 MHz; Siemens ACUSON Sequoia型超声诊断仪,10L4、18L6线阵探头,频率4~10、6~18 MHz;或Supersonic Imagine Alxplorer型超声诊断仪,15L4线阵探头,频率4~15 MHz。嘱患者仰卧,充分暴露颈前区,以高频探头扫查甲状腺,记录腺体内可疑恶性结节位置、最大径、与甲状腺被膜直线距离、内部回声和成分、边界、纵横比及微钙化,观察有无弥漫性甲状腺炎性病变,并依据美国放射学会(American College of Radiology, ACR)甲状腺影像报告和数据系统(thyroid imaging reporting and data system, TI-RADS)进行分级。由2名具8年以上工作经验的超声科主治医师完成以上操作,有分歧时提请另一名具有30年以上工作经验的主任医师协助确认。
1.3 评估可疑恶性结节 ①位置:除峡部外,将甲状腺两侧叶均分为上部、中部及下部;②与甲状腺被膜直线距离:测量结节与被膜最近点的距离,以0~2 mm或与25%以下被膜接触面距离≤2 mm为无侵及,将与被膜接触面达25%及以上>2 mm或被膜回声中断视为侵及被膜;③内部回声:以甲状腺实质对照,判断结节为低/等/高回声,以低于颈前肌群者为极低回声;④内部成分、边界:根据2017版ACR TI-RADS委员会白皮书[5]分类标准进行记录;⑤纵横比:于结节横切面目测,前后径≥左右径为纵横比≥1,反之纵横比<1;⑥微钙化:指结节实性成分中可见而不可测的点状强回声。
1.4 基因检测 采用二代测序(next-generation sequencing, NGS)平台对标本进行基因检测。
1.5 统计学分析 采用SPSS 25.0统计分析软件。以频数或率表示计数资料;对二分类或无序多分类指标行χ2检验或Fisher精确概率法检验,对有序多分类指标行Wilcoxon秩和检验;采用二元logistic回归模型进行多因素分析。采用R 3.6.3软件Regression Modeling Strategies(rms)构建列线图模型,以一致性指数(index of concordance, C-index)及受试者工作特征(receiver operating characteristic, ROC)曲线评估偏差校正。P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析 2组患者年龄,结节最大径、与被膜直线距离、微钙化、数目和分布,以及BRAFV600E基因检测差异均有统计学意义(P均<0.05)。见表1及图1。

表1 PTC患者临床及超声资料(例)

图1 患者男,55岁,双侧PTC伴中央区淋巴结转移(2/10),突变型BRAF V600E A、B.声像图示甲状腺左(A)、右(B)侧叶病灶; C、D.甲状腺左(C)、右(D)侧叶切除后病理图(HE,×100)示典型乳头状结构,部分呈分枝状,中心见纤维血管轴心,表面被覆瘤细胞,符合PTC改变
2.2 logistic回归分析 对单因素分析显示组间差异有统计学意义的参数行二元logistic回归分析,筛选与PTC侵袭性相关的危险因素,纳入标准=0.050,排除标准=0.100,变量筛选方法为Backward:LR。最大径>1 cm[OR=2.540,95%CI(1.341,4.810),P=0.004]、微钙化[OR=2.276,95%CI(1.203,4.308),P=0.011]、双侧叶多灶[OR=3.414,95%CI(1.578,7.385),P=0.002]及突变型BRAFV600E[OR=2.663,95%CI(1.147,6.182),P=0.023]为PTC侵袭性的独立危险因素。
2.3 侵袭性风险列线图 基于多因素logistic回归模型构建列线图模型,根据分数尺度为各指标分配相应分数,得到各项指标得分,相加后可用于评估总侵袭性风险;结节数目及分布对预测PTC侵袭性的贡献最大,其次是BRAFV600E基因检测结果。见图2。列线图模型预测PTC侵袭性的曲线下面积(area under the curve, AUC)为0.747[95%CI(0.679,0.815)],平均绝对误差为0.045,见图3、4。
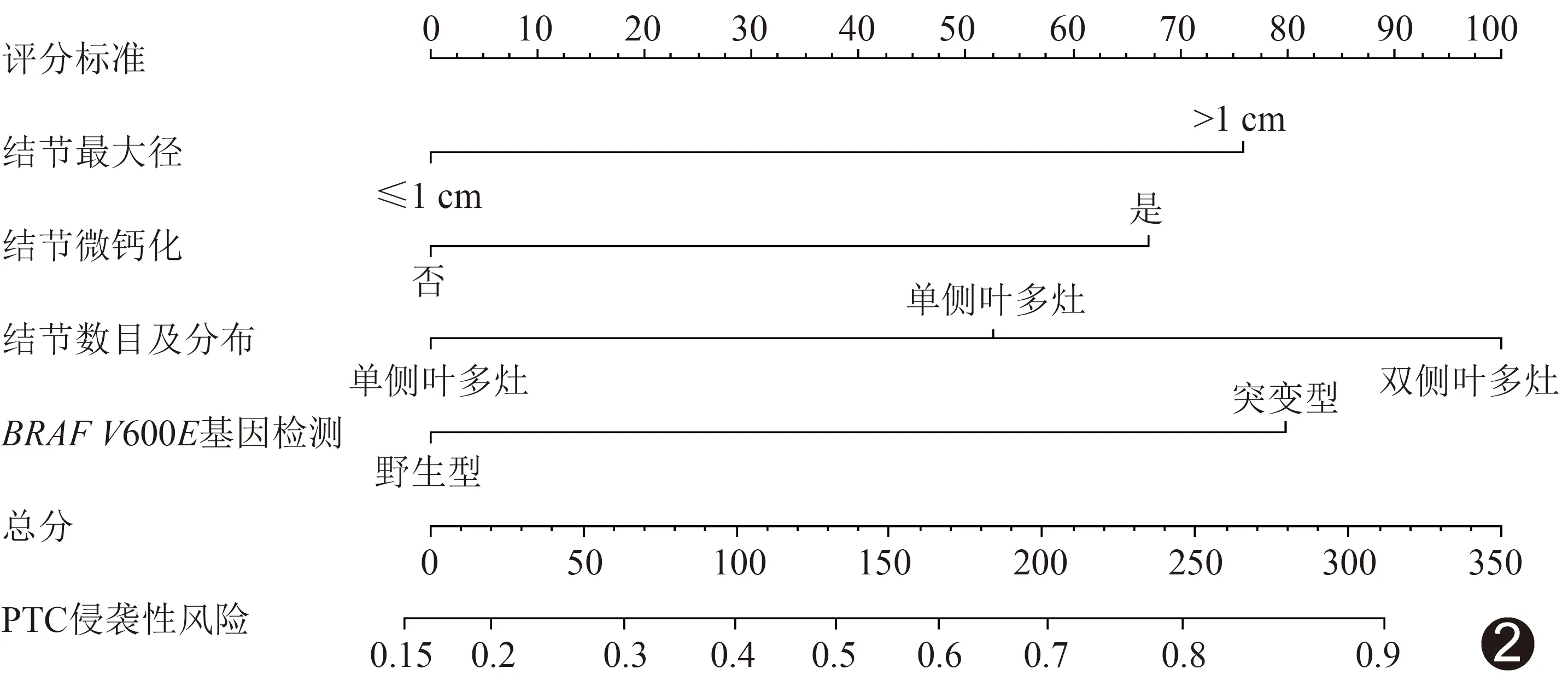
图2 PTC侵袭性风险列线图

图3 列线图模型预测PTC侵袭性的ROC曲线 图4 PTC侵袭性风险列线图校准示意图
3 讨论
PTC多见于女性,预后较好,但被膜侵犯或颈部淋巴结转移等可影响预后[4,6]。男性是PTC发生局部侵犯或颈部淋巴结转移的危险因素[7]。本研究组间患者性别差异无统计学意义,可能为选择偏倚所致,且目前对将性别作为PTC侵袭性的独立危险因素与否尚存较大争议。既往研究[7-8]报道,年龄与PTC颈部淋巴结转移相关,且年龄越小、转移率越高。本研究单因素分析显示组间患者年龄差异有统计学意义,但多因素分析显示年龄并非PTC侵袭性的危险因素,可能原因在于年龄与PTC侵袭性存在假关联或间接关联。
肿瘤大小可影响T分期,PTC病灶越大,越易发生被膜侵犯或区域淋巴结转移[9]。GUO等[10]发现,以PTC病灶最大径预测颈部淋巴结转移的最佳截断值为0.95 cm。微小PTC多灶性病变的侵袭性更强,复发及死亡率更高[11]。存在BRAF基因突变的PTC组织学上可表现为“经典型”和“浸润型”,且与不良预后及疾病进展密切相关[12]。本研究发现结节最大径>1 cm、微钙化、双侧叶多灶及针对术后标本进行的基因检测结果显示突变型BRAFV600E为PTC侵袭性的独立危险因素。术前行细针穿刺活检(fine-needle aspiration cytology, FNAC)亦有助于预测PTC侵袭性风险。有学者[13]认为针对术前FNAC组织标本与术后病理切片所示BRAFV600E基因突变结果预测甲状腺癌颈部淋巴结转移的效能相当,二者联合预测甲状腺结节良、恶性的效能优于单纯FNAC[14]。
高频超声是术前诊断PTC颈部淋巴结转移的首选影像学检查方式,但中央区淋巴结位置较深,且受气管声影遮挡,影响其诊断能力[11]。常规超声显示颈侧区淋巴结较好,发现PTC可疑颈侧区淋巴结转移时,可行淋巴结细针穿刺-甲状腺球蛋白测定,以获得较准确的术前评估[15]。本研究术后病理显示32例同时存在中央区和颈侧区淋巴结转移,且其列线图模型得分均较高,表明其原发病灶侵袭性风险较高。但是,常规超声诊断PTC侵及被膜、特别是微侵及与病理结果存在较大差异,要时可行超声造影检查[16-17]。
本研究的主要局限性:①单中心、回顾性研究,可能存在选择偏倚;②对多灶性PTC仅取其最大结节进行分析;③存在操作者主观性。
综上所述,以基于结节最大径、微钙化、数目及分布、BRAFV600E基因检测的列线图预测PTC侵袭性具有一定价值。