对比观察不可逆电穿孔与射频消融治疗肝癌
2022-06-14李学达杨莉莉刘国平刘士锋王从晓胡效坤
李学达,杨莉莉,张 浩,刘国平,张 伟,李 伟,刘士锋,王从晓,王 松,胡效坤
(青岛大学附属医院介入医学中心,山东 青岛 266000)
肝癌是临床常见恶性肿瘤之一。射频消融治疗肝恶性结节可获得几乎等同于外科切除的效果,已广泛用于临床[1-2],但对于毗邻肝门区血管、胆管、心脏、膈肌或胃肠道等特殊部位的肿瘤,射频消融易受“热沉效应”影响,损伤邻近结构的风险较高,其治疗后肿瘤局部残留、复发[3-4]甚为常见。不可逆电穿孔(irreversible electroporation, IRE)消融为新兴消融技术,通过瞬时在正负电极之间产生高压突变陡脉冲电场而击穿电极之间组织的细胞膜,在其表面形成不可逆的纳米级微穿孔,导致细胞凋亡[5];用于治疗肝肿瘤可有效保留消融区血管、胆管等重要组织结构及其功能而替代传统物理消融,应用前景广阔[5]。本研究通过与射频消融进行随机对比,观察IRE消融治疗肝癌的疗效及其安全性。
1 资料与方法
1.1 一般资料 前瞻性纳入2019年4月—9月青岛大学附属医院收治的48例肝癌患者,男37例、女11例,年龄31~70岁、平均(58.7±8.5)岁;以SAS 9.4统计软件随机将其均分为试验组与对照组。试验组男17例、女7例,年龄43~70岁、平均(60.0±8.9)岁;包括21例原发性肝癌、2例直肠癌肝转移癌及1例胆管癌肝转移,共29处癌灶,平均直径(23.64±8.51)mm;肝功能为Child A/B级。对照组男20例、女4例,年龄47~69岁、平均(57.6±8.1)岁;含22例原发性肝癌及直肠癌、结肠癌肝转移各1例,共33处癌灶,平均直径(19.14±8.39)mm;肝功能为Child A/B级。纳入标准:①年龄18~70岁;②临床和影像学诊断为肝癌,无肝外转移及门静脉侵犯;③肿瘤最大径≤4 cm,癌灶数量≤3个;④术前美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≤2分;⑤预计生存期>6个月;⑥拒绝外科手术;⑦术前相关实验室检查、增强CT/增强MR检查资料完整。排除标准:①合并感染性疾病、严重凝血功能障碍及严重的心、脑、肺等疾病;②心律失常或癫痫病史;③6个月内发生急性心肌梗死;④体内存在心脏起搏器或除颤器、电子设备与金属零件;⑤不能耐受气管插管全身麻醉。本研究经院学术及伦理委员会审查并批准,所有患者均签署知情同意书。
1.2 治疗方法
1.2.1 IRE 消融 术前患者禁食12 h。行全身麻醉,予足量肌松药,确保肌肉完全松弛,术中进行肌松监测及心电同步监测。以GE Optima620 CT扫描仪作为引导设备引导穿刺,于每个消融部位排布2~4支电极针并确保其平行排列。采用YTL-GM01高压陡脉冲治疗仪(天津市鹰泰利安康医疗科技有限责任公司)进行消融,电压3 000 V,根据癌灶大小选择10~60组输出脉冲。消融结束后经肘静脉以3 ml/s流率注射80 ml碘海醇对比剂行增强CT扫描,评估消融范围,确保癌灶完全消融,观察消融区改变及并发症等(图1)。
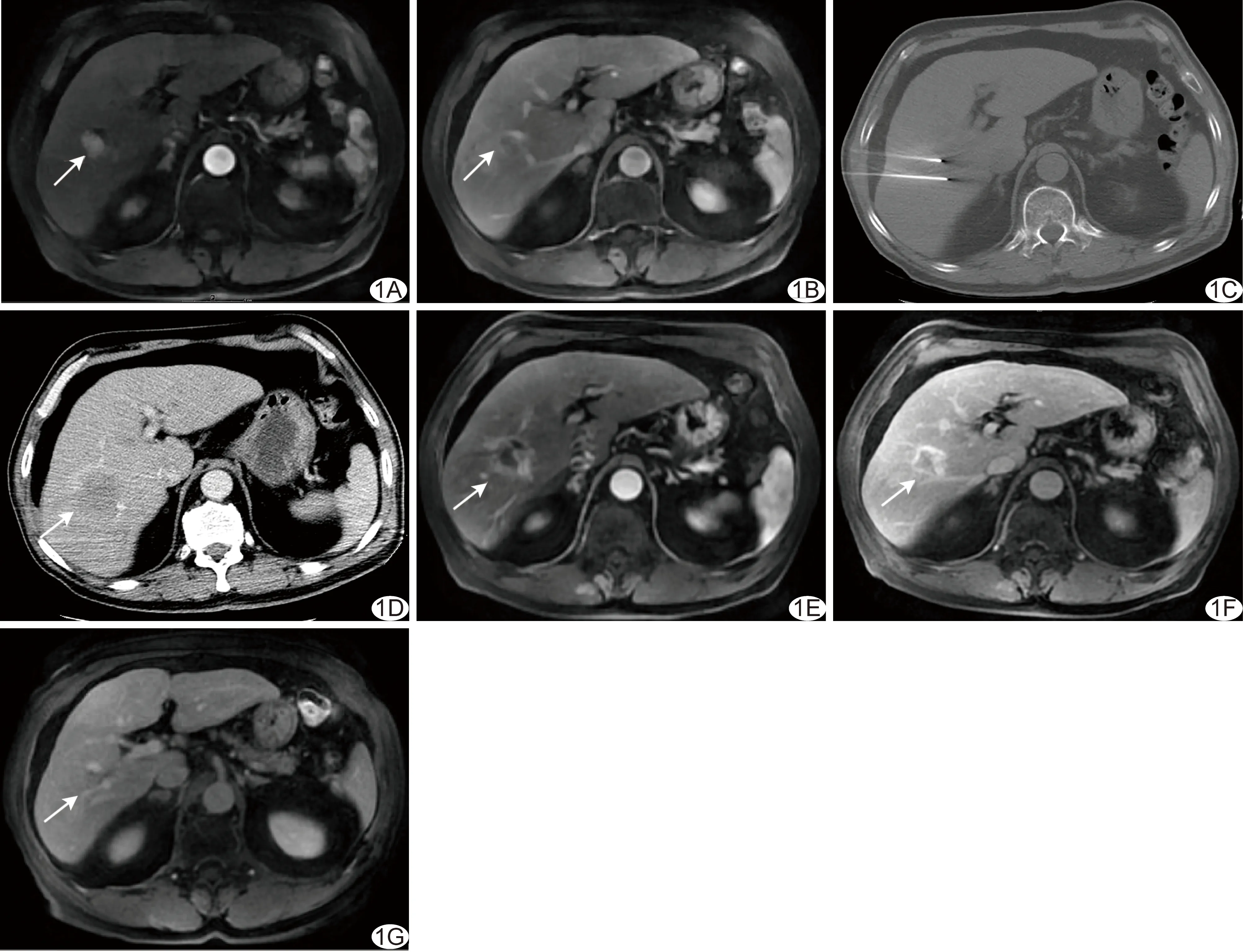
图1 试验组患者,男,64岁,肝癌 A、B.术前增强MRI示肝右叶肿瘤,长径23 mm,邻近2支门静脉属支,动脉期明显强化(A),门静脉期强化消退(B); C.术中于CT引导下穿刺,以2支电极针进行消融,消融电压为3 000 V,共计输出21组脉冲; D.消融后即刻行增强CT图示消融范围超过肿瘤边界1 cm; E.术后7天增强MRI示肿瘤无明显强化,消融区周边见环形延迟强化信号,邻近门静脉属支无异常; F.术后30天增强MRI示消融区较前缩小,内无明显强化,消融区周边仍见环形延迟强化信号; G.术后90天增强MRI示消融区无明显强化,范围较前明显缩小,周边异常延迟强化环消失 (箭示肿瘤/消融区)
1.2.2 射频消融 经CT扫描确定皮肤穿刺点及进针路径后,以2%利多卡因行局部麻醉。采用Covidien llc CTRF 220射频消融系统,于CT引导下行射频消融;对多发癌灶逐一予以消融,对较大癌灶行多点穿刺消融。术后行增强CT扫描,明确消融范围,观察有无并发症。
1.3 观察指标 ①治疗成功率、术中严重不良反应及并发症;②实验室相关指标,术后7天、30天检测肝功能变化;③术后严重不良反应及并发症,记录术后30天内治疗相关不良反应及并发症,参照美国国家癌症研究所通用毒性标准(national cancer institute common toxicity criteria, NCI-CTC)3.0[6]进行分级。
于术后7、30及90天行增强MR检查,观察动脉期目标癌灶显影范围,应用改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors disease, mRECIST)[7]评价治疗效果:目标癌灶消失为完全缓解(complete response disase, CR),直径总和缩小≥30%为部分缓解(partial response, PR),直径总和增加≥20%或出现新病灶为疾病进展(progressive disease, PD),癌灶缩小未达PR或增加未达PD为疾病稳定(stable disease, SD);总缓解率(overall response rate, ORR)=CR+PR;疾病控制率(disease control rate, DCR)=CR+PR+SD。对多发癌灶患者,针对较差进行评价并记为最终结果;计算术后7天肿瘤消融成功率,以无影像学可见残留肿瘤为完全消融,肿瘤消融成功率=完全消融癌灶数/治疗总癌灶数×100%;以无影像学可见肿瘤肝内复发为无复发,计算术后30、90天肿瘤局部无复发率,局部无复发率=无复发癌灶数/治疗总癌灶数×100%。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以t检验比较组间年龄。以频数及百分率表示计数资料,采用Fisher精确概率法比较组间性别、肿瘤消融成功率及局部无复发率等差异。P<0.05为差异有统计学意义。
2 结果
组间患者性别(P=0.740)、年龄(t=-1.16,P=0.252)及癌灶直径(t=-0.702,P=0.486)差异均无统计学意义。
2.1 治疗安全性
2.1.1 术中安全性 试验组24例,其中14处癌灶位于特殊部位,即邻近膈肌、胆囊、肝门区胆管或血管,均于全身麻醉下顺利完成IRE消融,未见心律失常、血压变化等严重不良反应;1例于术后接受增强CT检查时,因对比剂严重过敏导致过敏性休克而死亡;治疗成功率为100%(23/23)。对照组24例,包括10处特殊部位癌灶,均于局部麻醉下顺利完成射频消融,术中无严重不良反应及并发症,治疗成功率100%(24/24)。
2.1.2 实验室指标 试验组11例、对照组9例出现肝功能一过性损伤,术后7天谷丙转氨酶升高2倍以上,经对症保肝治疗后,术后30天复查肝功能均恢复至正常。
2.1.3 术后不良反应 试验组4例(4/23,17.39%)出现2级不良反应,包括胸腔积液2例、腹痛及发热各1例;对照组9例(9/24,37.50%)出现2级不良反应,包括腹痛8例、呕吐1例,经对症治疗后均完全缓解。2组均未发生治疗相关3~4级严重不良反应及并发症。
2.2 疗效评价 对试验组23例共以IRE治疗28处癌灶,术后7天,27处(27/28,96.43%)癌灶完全灭活,1处边缘残余活性,即22例CR、1例PR;术后30天,27处(27/28,96.43%)癌灶完全灭活,1处癌灶残余活性无变化,即22例CR、1例SD;术后90天,25处(25/28,89.29%)癌灶完全灭活,1处残余活性增大,2处局部复发,即20例CR、3例PD。
对照组24例共33处肝内癌灶,射频消融治疗后7天,32处(32/33,96.97%)完全灭活、1处仍残余活性,即23例CR、1例PR;术后30天,31处(31/33,93.94%)肝内癌灶无复发(其中1例肝内病灶完全灭活但出现髂骨转移),1处残余活性无变化,1处直肠癌肝转移局部复发,即21例CR、2例PD、1例SD;术后90天,30处(30/33,90.91%)肝内癌灶无复发(其中1例肝内出现新发癌灶,1例出现髂骨转移灶),1处癌灶残余活性增大,2处局部复发,即19例CR、5例PD。
术后7天肿瘤消融成功率、术后30天及90天局部无复发率组间差异均无统计学意义(P均>0.05);术后各时间点ORR、DCR差异均无统计学意义(P均>0.05),见表1。
3 讨论
IRE消融治疗肝癌的安全性及有效性已为国内外临床研究[8-9]结果所证实,其技术成功率达93%,局部复发率5%,肝功能较差患者亦可耐受,术后不良反应主要为腹痛、胸腹腔积液、发热及肝功能一过性损伤等。NIESSEN等[10]以IRE消融治疗肝癌,术后6周完全消融率达95.4%,术后3、6及12个月肿瘤无复发生存率分别为87.4%、78.4%及74.8%,但重度并发症发生率达11.5%,主要包括肝脓肿、门静脉血栓、腹腔大出血及心血管相关并发症等。本研究1例试验组患者死于对比剂过敏,其余患者均未出现严重并发症,IRE消融治疗肿瘤成功率96.43%,术后30、90天局部无复发率分别为96.43%、89.29%,与对照组无显著差异,提示IRE消融治疗肝癌安全性较高,疗效与射频消融相当。
影响IRE消融疗效的因素较多,肿瘤大小及位置均为主要影响因素[9]。准确穿刺定位及确定有效消融范围是保证局部完全消融的关键。根据术前CT图像,结合多层面重建图像,尽量使电极针之间相互平行,可避免因电场分布不均而影响消融效果[11];消融后即时行增强CT扫描有助于明确实际消融边界,确保消融范围超过肿瘤边界1 cm以上,避免肿瘤残留。CHENG等[12]采用IRE消融治疗特殊部位肝癌,成功率达91.4%,且未出现相关严重并发症。本研究试验组共14处、对照组共10处癌灶位于特殊部位,获益于术中合理选择消融参数及有效控制消融范围,均未发生严重不良反应及并发症。试验组1处癌灶邻近膈肌及右肝静脉,术后残余活性并出现中量胸腔积液,其余癌灶均获得完全灭活;对照组1处特殊部位癌灶术后7天残余活性、1处术后90天复发。肿瘤位于特殊部位仍是影响消融治疗效果的重要因素。
综上,IRE消融治疗肝癌安全可靠、疗效明确,结合全身静脉麻醉及有效肌松药治疗,可显著降低手术风险;局部肿瘤控制效果与射频消融治疗相当,可作为替代方案,针对特殊部位肿瘤优势明显。但本研究样本量有限,且1~2级不良反应个体差异较大,故未对2级不良反应数据进行对比,有待进一步观察。