不同光质对朝鲜淫羊藿生长、生理和黄酮类成分积累的影响
2022-06-14代艾林张永刚艾强滕熙超杨利民
代艾林, 张永刚, 艾强, 滕熙超, 杨利民
(吉林农业大学中药材学院,长春 130118)
朝鲜淫羊藿(Epimedium koreanum Nakai)为小檗科淫羊藿属多年生草本植物,主要分布于中国东北长白山地区、日本海沿岸、朝鲜北部[1]。朝鲜淫羊藿作为常用中药淫羊藿的重要基原,1977年起被历版《中国药典》收载,以其干燥叶入药,具有补肾阳、祛风湿、强筋骨的功效。朝鲜淫羊藿的主要活性成分为黄酮类物质,其中,总黄酮、淫羊藿苷、朝藿定A、朝藿定B、朝藿定C被2020年版《中国药典》列为指标性成分[2]。
吉林省长白山地区是朝鲜淫羊藿的主要分布地。近年来,由于需求量增加和不合理采集,野生朝鲜淫羊藿资源急剧减少,亟需扩大人工栽培以解决朝鲜淫羊藿资源短缺的现状。栽培环境和生态因子是影响朝鲜淫羊藿产量和品质的重要因素。野生朝鲜淫羊藿多生于疏林下、灌丛间或林缘半阴环境,上层林木对太阳辐射的吸收、反射,使得林下透射光的光强和光质发生改变[3]。研究表明,包括光质在内的光环境会影响药用植物的生长和品质[4-6]。因此,光调控成为朝鲜淫羊藿栽培生产中的重要影响因素[7-8]。目前,有关光质对朝鲜淫羊藿生长、生理和黄酮类成分积累的研究还较为缺乏。因此,本文以朝鲜淫羊藿为研究对象,设置4个光质处理,探讨不同光质处理对其生长、生理和黄酮类成分积累的影响,以期为朝鲜淫羊藿培育过程中的光照管理优化、提高药材的产量和品质提供理论依据。
1 材料与方法
1.1 试验材料
将由吉林省临江市错草沟的野生朝鲜淫羊藿根茎繁殖而来的朝鲜淫羊藿栽植于吉林农业大学药用植物园,于2020年6月移栽于塑料盆(长、宽、高分别为43.0、18.5、14.0 cm)中培养,选取长势一致的植株作为试验材料。
1.2 试验设计
设置白光(400~690 nm,对照)、红光(600~690 nm)、黄光(560~580 nm)和蓝光(400~510 nm)4种光质处理。将试验材料移至具有不同光源的培养间培养(光照16 h·d-1,日间温度24~27℃,夜间温度15~19℃,空气湿度60%),处理30 d后采收样品,进行相关指标测定。LED光源购自深圳宸华节能照明有限公司。
1.3 测定指标与方法
1.3.1 形态指标测定 采用直尺测量朝鲜淫羊藿株高;游标卡尺测量茎粗;电子天平(德国Sartorius)测量其鲜重;CI-203叶面积仪(美国CID公司)测定叶面积;60℃干燥至恒重后测量干重,粉碎备用。
1.3.2 叶绿素含量测定 采用95%乙醇浸提法[9]测定朝鲜淫羊藿叶片中叶绿素a(chlorophyll a,Chl a)和叶绿素b(chlorophyll b,Chl b)含量,计算叶绿素a+b(chlorophyll a+b,Chl a+b)含量和叶绿素a/b(chlorophyll a/b,Chl a/b)的值。
1.3.3 叶片光合参数测定 使用LCpro+便携式光合作用系统(英国 ADC BioScientific Ltd.)在9:00—10:00测定4个光质处理组的朝鲜淫羊藿叶片光合参数,包括净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)和 胞 间 CO2浓 度(intercellular CO2concentration,Ci)。
1.3.4 抗氧化酶活性和渗透调节物质测定 采集4个处理组新鲜朝鲜淫羊藿叶片各0.50 g,3次重复。加适量液氮彻底研磨成粉末,转入10 mL离心管中,加磷酸盐缓冲液(phosphate buffer saline,PBS)至终体积5 mL,混匀,12 000 r·min-1、4 ℃低温离心20 min,取上清液使用酶标仪进行检测。超氧化物歧化酶(superoxide dismutase,SOD)活性采取NBT光化还原法于560nm测定;过氧化物酶(peroxidase,POD)活性采取愈创木酚法于420 nm测定;过氧化氢酶(catalase,CAT)活性采取可见光法于405 nm测定;丙二醛(malondialdehyde,MDA)含量采取硫代巴比妥酸比色法于532 nm测定;可溶性蛋白质含量采取考马斯亮蓝染色法于595 nm测定[9]。
1.3.5 黄酮类成分含量测定 取4个处理组朝鲜淫羊藿烘干样品各0.50 g,3次重复。参照《中国药典》[2]测定总黄酮、淫羊藿苷、朝藿定A、朝藿定B、朝藿定C的含量,总黄酮醇苷含量为淫羊藿苷、朝藿定A、朝藿定B、朝藿定C含量的总和。
1.4 数据处理
采用DPS软件对相关数据进行统计分析,利用Origin 2017软件作图。
2 结果与分析
2.1 光质对朝鲜淫羊藿生长的影响
由表1可知,不同光质处理对朝鲜淫羊藿株高、茎粗影响不显著。蓝光、黄光、红光处理下的叶面积与对照白光处理均无显著差异;蓝光和黄光处理的叶面积显著高于红光处理(P<0.05)。与白光处理相比,黄光和蓝光处理均显著增加了朝鲜淫羊藿的叶鲜重和干重(P<0.05),其中,黄光和蓝光处理的叶干重分别较对照增加25.9%和13.9%。综合各项生长指标表明,与对照白光相比,短期黄光和蓝光处理对株高、茎粗及叶面积无显著影响,但叶鲜重和干重显著增加。

表1 不同光质下朝鲜淫羊藿的生长指标Table 1 Growth indexes of Epimedium koreanum under different light quality
2.2 光质对朝鲜淫羊藿叶片叶绿素含量的影响
由图1可知,光质对朝鲜淫羊藿叶片中叶绿素含量有显著影响。叶绿素a、叶绿素b和叶绿素a+b含量均以蓝光处理最高,表现为:蓝光处理>白光处理>黄光处理和红光处理。蓝光处理的叶绿素a/b值最高,显著高于黄光处理,但与白光和红光处理差异不显著。综合表明,蓝光处理增加了朝鲜淫羊藿叶片中叶绿素含量,而黄光处理和红光处理不利于朝鲜淫羊藿叶片中叶绿素的积累。

图1 不同光质下朝鲜淫羊藿的叶绿素含量Fig.1 Chlorophyll contents of Epimedium koreanum under different light quality
2.3 光质对朝鲜淫羊藿叶片光合参数的影响
由图2可知,光质对朝鲜淫羊藿叶片的光合参数有显著影响。蓝光处理下朝鲜淫羊藿叶片的净光合速率最高,显著高于红光和黄光处理,但与对照白光处理无显著差异。蓝光处理下叶片的Gs也最高,显著高于其他处理;而红光和黄光处理叶片的Gs显著低于白光对照。不同处理间的Tr和Ci均存在显著差异,但Tr表现为蓝光处理>白光处理>黄光处理>红光处理;Ci表现为白光处理>蓝光处理>黄光处理>红光处理。以上结果表明,蓝光处理能够更有效地诱导气孔开放,有利于朝鲜淫羊藿叶片的光合作用;而红光和黄光处理则会抑制其光合作用。

图2 不同光质下朝鲜淫羊藿的光合参数Fig.2 Photosynthetic parameters of Epimedium koreanum under different light quality
2.4 光质对朝鲜淫羊藿叶片MDA和可溶性蛋白含量及抗氧化酶活性的影响
由图3可知,光质对朝鲜淫羊藿叶片中抗氧化酶活性及可溶性蛋白和MDA含量有显著影响。朝鲜淫羊藿叶片中SOD、POD、CAT活性总体呈现黄光和红光处理较高,蓝光处理低于对照白光处理,即黄光和红光处理增强了叶片中SOD、POD和CAT活性,有利于叶片中活性氧的清除。蓝光处理显著提高了叶片中可溶性蛋白含量,较对照白光处理提高12.7%;而红光、黄光处理可溶性蛋白含量分别较对照白光处理显著降低22.8%和22.2%。红光、黄光、蓝光处理叶片中MDA含量均显著低于对照白光处理,减轻了膜脂过氧化程度。

图3 不同光质下朝鲜淫羊藿的抗氧化酶活性及MDA和可溶性蛋白含量Fig.3 Antioxidant enzyme activity,MDA and soluble protein content of Epimedium koreanum under different light quality
2.5 光质对朝鲜淫羊藿叶片黄酮类成分含量的影响
由表2可知,不同光质对朝鲜淫羊藿叶中总黄酮、朝藿定A、淫羊藿苷、总黄酮醇苷含量的影响趋势一致。蓝光处理朝鲜淫羊藿叶中总黄酮、淫羊藿苷和总黄酮醇苷含量最大,较对照白光处理分别显著提高12.9%、14.3%和8.6%。红光和黄光处理叶中总黄酮、淫羊藿苷和总黄酮醇苷含量显著低于蓝光和对照白光处理。综上表明,蓝光处理促进了朝鲜淫羊藿黄酮类成分的积累,而红光、黄光处理不利于黄酮类成分的积累。
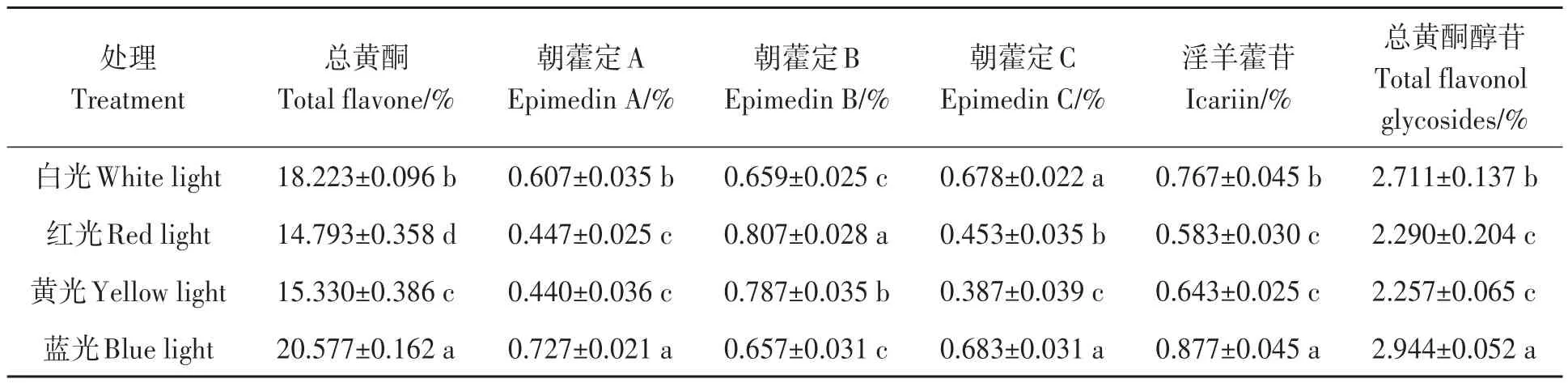
表2 不同光质下朝鲜淫羊藿的黄酮类成分含量Table 2 Content of flavonoids in Epimedium koreanum under different light quality
3 讨论
光是植物生长发育的基本环境因素,光质对植物的形态建成具有重要的调节作用。研究显示,红光促进茎伸长,而蓝光则抑制茎伸长、增加叶面积,补充蓝光显著降低了丹参种子直播苗以及根栽苗的株高[10]。远志的株高在红光、黄光处理下显著增加,叶宽则表现为蓝光处理下显著高于红光和黄光处理[11]。草珊瑚幼苗进行红光处理,表现为促进茎伸长,但抑制茎的横向增长,叶面积相对较小,根部发育明显弱化,导致鲜重和干重较白光和蓝光处理显著降低[12]。本研究中,朝鲜淫羊藿在各光质处理30 d后,株高、茎粗虽差异不显著,但蓝光处理有降低趋势;叶面积在蓝光和黄光处理下显著高于红光处理,但与对照白光处理差异不显著;叶鲜重在红光、黄光、蓝光处理下较对照增加;叶干重在黄光和蓝光处理下显著高于对照白光处理。即光质在一定程度上对朝鲜淫羊藿的生长起调控作用,与前人研究结果相一致。但对分布于我国贵州、广西等省(自治区、市)的同属植物拟巫山淫羊藿的研究显示,蓝光和红光处理显著降低了拟巫山淫羊藿的叶面积,而黄光处理与白光处理差异不显著[6,13]。由此表明,环境可能影响植物对光调控的响应,且不同植物对同种光质的应答也可能存在差异。
光质通过植物体内光敏色素来调控植物的光合作用,不同光质对叶绿素的调节可能因植物种类、组织器官的不同而存在差异。Johkan等[14]发现蓝光可提高叶片叶绿素a和类胡萝卜素含量;不同光质下紫苏叶片净光合速率表现为:蓝光>红光>绿光>黄光,可能是蓝光和红光有利于提高叶绿素a、b和类胡萝卜素的含量[15]。本研究中,蓝光处理下朝鲜淫羊藿叶片中叶绿素a、b和叶绿素a+b含量均较高,表现为:蓝光处理>白光处理>黄光处理>红光处理。净光合速率与叶绿素含量呈显著正相关。蓝光促进叶片气孔开放,增加了胞间CO2浓度,净光合速率高于其他处理。
光质对植物氮代谢有重要的调节作用,蓝光区光量子能量较高,有利于提供较多能量用于合成蛋白质[16]。MDA含量常被用来作为膜脂过氧化指标,间接测定膜脂受损伤程度。SOD、POD、CAT是植物体内重要的保护酶,其活性高低反映了某一时期植株体内代谢和抗逆性的变化及受活性氧毒害的程度。研究表明,草珊瑚幼苗在长时间蓝光诱导后,叶片MDA含量增加,植株膜系统受到一定程度损伤,SOD和POD活性增高以应对并减缓活性氧对植株的毒害;而红光诱导下MDA含量及SOD和POD活性均显著低于蓝光和白光,认为红光诱导下草珊瑚幼苗并未受到活性氧毒害[12]。卢素萍等[17]研究显示,蓝光和紫光处理后烤烟叶片CAT活性较白光降低,叶片中H2O2和MDA含量显著高于对照;红光和黄光处理后烟叶CAT活性升高,降低了烟叶中H2O2和MDA含量。本研究中,黄光和红光处理增强了朝鲜淫羊藿叶片SOD、POD、CAT活性,且显著降低了朝鲜淫羊藿叶片中MDA含量,减轻了膜脂过氧化程度;蓝光处理后,朝鲜淫羊藿叶中MDA含量及SOD、POD、CAT活性均低于对照白光处理,且蓝光处理后叶片的光合速率和可溶性蛋白含量也较高,表明其受到活性氧毒害的程度较低。
光质不仅影响植物的生长和初生代谢,还影响植物的次生代谢过程。研究表明,蓝光对黄酮、生物碱、萜类内酯、糖苷等次生代谢产物有显著影响[18];可促进水母雪莲中黄酮合成[19-20];提高苦荞麦芽中酚类化合物含量[21];短波段的蓝光更有利于植物叶内黄酮类化合物的积累,而长波段的红光对叶中黄酮类化合物积累有抑制作用[22];不同光质对金线莲中总黄酮含量的促进效果表现为蓝光>黄光>红光>白光,对总黄酮、槲皮素、异鼠李素和山柰酚的促进作用均表现为蓝光大于黄光,红光效果最差[23];LED蓝光处理更有利于青钱柳叶中异槲皮苷、山奈酚和槲皮素黄酮类化合物的积累[24]。本研究表明,蓝光处理后,朝鲜淫羊藿叶中总黄酮、淫羊藿苷和总黄酮醇苷含量均较高,表明蓝光有利于黄酮类成分的积累,与前人研究结果一致。
朝鲜淫羊藿作为常用中药材和保健品的重要原料,其黄酮类成分产量的高低,不仅与叶中黄酮类成分的含量高低有关,也与叶生物量的多少密切相关。本研究显示,和其他光质比较,补充蓝光会更有利于提高叶片产量和叶中黄酮类物质的积累。因此,在朝鲜淫羊藿栽培过程中可通过覆盖蓝色透光膜或在夜晚补充蓝色LED光源,从而提高叶片产量和叶中黄酮类成分含量。另外,本研究仅对朝鲜淫羊藿进行了30 d光质调控,关于阶段性及长期光质调控对朝鲜淫羊藿的影响还有待进一步研究。
